Acetato de sodio
El acetato de sodio, o acetato sódico, también llamado etanoato de sodio,[2] es la sal de sodio del ácido acético. Es un producto químico económico producido en cantidades industriales para una amplia gama de usos.
| Acetato de sodio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Etanoato de sodio | ||
| General | ||
| Fórmula semidesarrollada | ||
| Fórmula estructural |
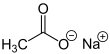 | |
| Fórmula molecular | ||
| Identificadores | ||
| Número CAS |
127-09-3 (Anhidrido) 6131-90-4 (Trihidratado)[1] | |
| ChEBI | 32954 | |
| ChEMBL | CHEMBL1354 | |
| ChemSpider | 29105 | |
| DrugBank | 09395 | |
| PubChem | 517045 | |
| UNII | NVG71ZZ7P0 | |
| Propiedades físicas | ||
| Densidad | 1450 kg/m³; 1,45 g/cm³ | |
| Masa molar | 8204 g/mol | |
| Punto de ebullición | 610 K (337 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Aplicaciones del acetato de sodio
El acetato de sodio es utilizado en la industria textil para neutralizar las corrientes residuales de ácido sulfúrico, y como fotorresistente cuando se usan colorantes de anilina. También se usa como agente de encurtido en el curtido con cromo. Ayuda a retardar la vulcanización del cloropreno en la producción sintética de caucho.
Es un compuesto químico usado para dar sabor a las patatas fritas y etiquetado con el código E 262 I. Se suele añadir a los alimentos como conservante; en este caso se nombra como diacetato de sodio y se etiqueta con el código E 262 II.
Como base conjugada de un ácido débil, una disolución de acetato de sodio y ácido acético puede actuar como disolución tampón para mantener relativamente constante el pH. Esto es especialmente útil en bioquímica, donde las reacciones dependen del pH.
También se utiliza en las bolsas térmicas autoactivables ("hielo caliente"). Cuando se calientan cristales de acetato de sodio trihidratado (punto de fusión 58 °C)(se debe poner cristales hasta que no se pueda disolver más) alrededor de 100 °C, estos se funden. Si se enfría tras este proceso, se obtiene una disolución supersaturada de acetato de sodio en agua. Esta disolución es capaz de enfriarse a temperatura ambiente, es decir, por debajo de su punto de fusión, sin formar cristales. Presionando en un disco metálico del interior de la bolsa, se forma un centro de nucleación que causa la cristalización de la disolución en acetato de sodio sólido.
Síntesis
El acetato de sodio es muy económico, y es comúnmente comprado a los distribuidores de productos químicos en vez de ser sintetizado en el laboratorio. Es algunas veces producido en el laboratorio experimentalmente por la reacción del ácido acético con carbonato de sodio, bicarbonato de sodio, o hidróxido de sodio, por nombrar unas pocas bases que contienen sodio.
Esta es una reacción conocida como "burbujeo" entre el bicarbonato de sodio y el vinagre. 84 gramos de bicarbonato de sodio reaccionan con 750 g de vinagre con 8% de concentración de ácido acético para hacer 82 g de acetato de sodio en solución. Por la posterior evaporación del agua, se puede obtener una solución más o menos pura de Acetato de sodio o sus cristales.
También mediante la reacción CH3-COOH + Na(OH). Para conseguir cantidades industriales[cita requerida]. 100 g de Hidróxido de sodio (NaOH) reaccionan con 175 g de ácido acético puro (1875 g de vinagre al 8%), para dar 45 g de agua y 205 g de Acetato de sodio.
Bolsas de calor

Una solución hiper-saturada de acetato de sodio en agua (disolviendo el acetato de sodio en agua caliente y posteriormente enfriando la solución) posee cierto calor latente que puede ser aprovechado para calentar. Cuando esta disolución se saca de su equilibrio, el acetato de sodio cristaliza de forma rápida liberando calor, al tratarse la cristalización de un proceso exotérmico, y es por lo que comúnmente se conoce como "Hielo caliente", "bolsa de calor", o "Hot ice". Esto se emplea para aplicar calor local, como mantas calientes, pudiéndose ser transportadas en su estado "activado" o "latente" (en disolución) y cristalizadas cuando se quieren usar. Estas bolsas suelen contener una pieza metálica que al doblarla actúa como punto de nucleación, saca del equilibrio al sistema y lo hace cristalizar.
Estas disoluciones contienen la cantidad de agua correspondiente al tri-hidrato de la sal del acetato. Cuando se funden los cristales la sal se disuelve en su propia agua de cristalización.
Gastronomía
Durante el Congreso de Alta Cocina "Andalucía Sabor" celebrado en Sevilla en septiembre de 2011, el Chef malagueño José Carlos García (JCG Restaurante) con el asesoramiento del químico Alejandro Jiménez, presentó el plato "Concha Fina Margarita", cuyo emplatado se basaba en la cristalización espontánea del acetato sódico, pasando éste de líquido sobre-enfriado a sólido, dando un efecto espectacular que configuraba el soporte (falso hielo) del emplatado.
Referencias
- [http://webbook.nist.gov/cgi/cbook.cgi?ID=127-09-3 (Anhidrido) 6131-90-4 (Trihidratado) Número CAS]
- Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 16 de enero de 2018.