Acetilacetona
La acetilacetona es un compuesto orgánico que existe en dos formas tautomericas que rápidamente se interconverten. A pesar de que el compuesto se llama vulgarmente así, el nombre IUPAC es el de pentano-2,4-diona. El enol en disolución acuosa es la forma tautomérica menos favorecida, aunque es la forma más favorecida en muchos otros disolventes.[2] Es un líquido incoloro precursor del quelato acetilacetonato (acac), un ligando bidentado común. También se usa para la síntesis de compuestos heterocíclicos.
| Acetilacetona | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Pentano-2,4-diona | ||
| General | ||
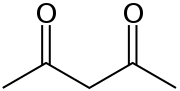
| Fórmula estructural |
| |
| Fórmula molecular | C5H8O2 | |
| Identificadores | ||
| Número CAS | 123-54-6[1] | |
| ChEBI | 14750 | |
| ChEMBL | CHEMBL191625 | |
| ChemSpider | 29001 | |
| PubChem | 31261 | |
| UNII | 46R950BP4J | |
| KEGG | C15499 | |
| Propiedades físicas | ||
| Densidad | 975 kg/m³; 0,975 g/cm³ | |
| Masa molar | 10 012 g/mol | |
| Punto de fusión | −23 | |
| Punto de ebullición | 140 °C (413 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 16 g/100 mL | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades
Tautomería

Las formas ceto (keto en inglés) y enol de la acetilacetona conviven en disolución. Estas formas son tautomeros. La forma enol tiene la simetría molecular C2v, ya que el hidrógeno está compartido igualmente entre los dos átomos de oxígeno.[3] En la fase gaseosa, la constante de equilibrio, Kceto-enol es 11.7, favoreciéndose la forma enol. Las dos formas tautoméricas pueden ser fácilmente distinguidas por RMN, IR y otros métodos.[4][5] La constante de equilibrio suele ser alta en disolventes no polares; mientras que la forma ceto es más favorable en los polares, disolventes con enlaces de hidrógeno, como el agua.[6] La forma enol es un vinílogo de un ácido carboxílico.
| Disolvente | Kceto-enol |
|---|---|
| Fase gaseosa | 11.7 |
| Ciclohexano | 42 |
| Tolueno | 10 |
| THF | 7.2 |
| DMSO | 2 |
| Agua | 0.23 |
Propiedades ácido-base
La acetilacetona es un ácido débil:
- C5H8O2
 C5H7O2− + H+
C5H7O2− + H+
La IUPAC establece valores de pKa para este equilibrio en disolución acuosa a 25 °C 8,99±0,04 (I = 0), 8,83±0,02 (I = 0.1 M NaClO4) y 9,00±0,03 (I =1.0 M NaClO4) (I=fuerza iónica).[8] Los valores para disolventes mixtos también están disponibles.
Preparación
La acetilacetona se obtiene de manera industrial por el reagrupamiento térmico de isopropenilacetato.[9]
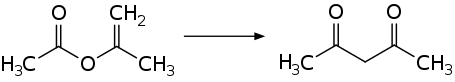
Las síntesis de laboratorio de acetilacetona empiezan también con acetona y anhídrido acético con la adición de BF3 como catalizador:[10]
- (CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Una segunda síntesis implica la condensación de acetona catalizada por base con acetato de etilo, seguida de acidificación:[10]
- NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
- NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
Debido a la facilidad de estas síntesis, muchos derivados de acetilacetonatos se conocen.
Reacciones
Condensaciones
La acetilacetona es un precursor bifuncional versátil para heterociclos, ya que ambos grupos ceto experimentan condensación. La hidrazina reacciona para producir pirazoles, la urea da pirimidinas, etc.
Química de coordinación
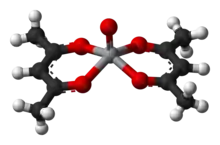
El anión acetilacetonato, acac−, forma complejos con muchos iones de metales de transición. Un método general de síntesis consiste en reaccionar el ion del metal con acetilacetona en presencia de una base (B):[11]
- MBz + z (acacH)
 M(acac)z +z BH
M(acac)z +z BH
la cual asiste la extracción de un protón de la acetilacetona y cambia el equilibrio a favor del complejo. Ambos átomos de oxígeno se unen al metal para formar un anillo quelato de 6 eslabones. En algunos casos el efecto de quelato es tan fuerte que ninguna base añadida es necesaria para formar el complejo. Como el complejo del metal que se forma no posee carga neta, es soluble en disolventes orgánicos no polares.
Referencias
- Número CAS
- Co(tfa)3 & Co(acac)3 handout.
- W. Caminati, J.-U. Grabow (2006). «The C2v Structure of Enolic Acetylacetone». Journal of the American Chemical Society 128 (3): 854-857. PMID 16417375. doi:10.1021/ja055333g.
- Kimberly A. Manbeck, Nicholas C. Boaz, Nathaniel C. Bair, Allix M. S. Sanders, and Anderson L. Marsh (2011). «Substituent Effects on Keto-Enol Equilibria Using NMR Spectroscopy». Journal of Chemical Education 88 (10): 1444-1445. doi:10.1021/ed1010932.
- Z. Yoshida, H. Ogoshi, T. Tokumitsu (1970). «Intramolecular hydrogen bond in enol form of 3-substituted-2,4-pentanedione». Tetrahedron 26: 5691-5697. doi:10.1016/0040-4020(70)80005-9.
- Solvents and Solvent Effects in Organic Chemistry, Christian Reichardt Wiley-VCH; 3 edition 2003 3-527-30618-8
- IUPAC SC-Database Archivado el 19 de junio de 2017 en Wayback Machine. A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- Stary, J.; Liljenzin, J.O. (1982). «Critical evaluation of equilibrium constants involving acetylacetone and its metal chelates». Pure and Applied Chemistry 54 (12): 2557-2592. doi:10.1351/pac198254122557.
- Hardo Siegel, Manfred Eggersdorfer “Ketones” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, Wienheim. doi 10.1002/14356007.a15_077
- C. E. Denoon, Jr.. "Acetylacetone". Org. Synth.; Coll. Vol. 3: 16.
- R.C. Mehrotra "Metal Beta-diketonates and Allied Derivatives" Academic Press, 1978. 0-12-488150-5