Activación de basófilos
Los síntomas alérgicos son causados por una liberación sistémica inicial de histamina por parte de basófilos y mastocitos activados, que puede provocar un shock con edema laríngeo, obstrucción de las vías respiratorias inferiores e hipotensión. Esta es la razón por la cual los basófilos se consideran, junto con los mastocitos, células clave en las enfermedades alérgicas.
Proceso de activación
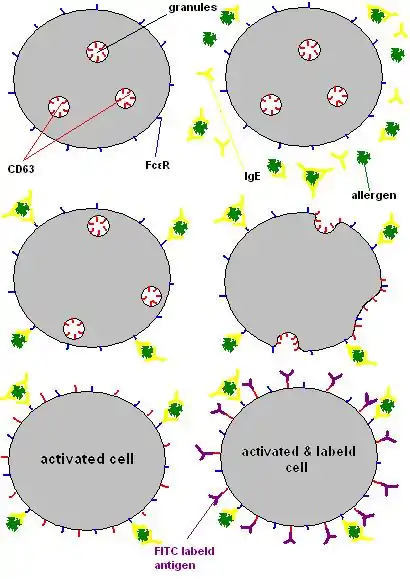
La inmunoglobulina E (IgE) es una clase de anticuerpo (o "isotipo" de inmunoglobulina) que solo se ha encontrado en mamíferos. Desempeña un papel importante en la alergia, y se asocia especialmente a la hipersensibilidad tipo 1. Hay receptores (FcεR) para la región constante de IgE, la región Fc, en varios tipos de células, incluidos los mastocitos y los basófilos. Los basófilos contienen muchos gránulos dentro de la célula, que están llenos de una variedad de sustancias activas que desencadenan una respuesta alérgica tras la desgranulación. Las células se activan y comienzan la desgranulación cuando el anticuerpo IgE, unido a un alérgeno que puede unirse a la región variable específica de la IgE, la región Fab, se une al receptor Fc.
Método de prueba de alergia in vitro
En la mayoría de los casos, una prueba cutánea positiva se utiliza en la identificación de alergias, pero la activación de granulocitos basófilos con anti-IgE, la expresión del antígeno CD63 en la superficie celular (membrana plasmática) permite identificar el alérgeno responsable de la reacción de hipersensibilidad sin realizar la prueba común de alergia. Solo se necesita una pequeña cantidad de sangre para este experimento, lo que lo hace cómodo de usar, ya que se puede efectuar en paralelo a un análisis de sangre normal. Se puede emplear para diferentes alergias (por ejemplo, veneno de abeja, medicamentos, medios de contraste[1]).
Desgranulación
Las células desgranuladas exponen moléculas CD63[2] en su membrana celular externa, por lo tanto, los gránulos, que contienen moléculas CD63 en su superficie interna, se fusionaron con la membrana celular. La superficie celular interna de los gránulos se convierte en la superficie celular externa de los basófilos/mastocitos durante el proceso de desgranulación.
| materiales | objetivo |
|---|---|
| BSB | estimulación de basófilos |
| IL-3 | estimulación de basófilos |
| alérgeno | |
| EDTA | tapón de desgranulación |
| marcador | marca los basófilos |
| solución de lisis | lisa los glóbulos rojos |
| centrífugo | hacer girar los glóbulos rojos |
| PBS | solución de lisis de lavado |
| FACS | contando celdas |
Etiquetado y clasificación
Dado que la citometría de flujo es una herramienta valiosa para analizar grandes cantidades de células y para identificar poblaciones celulares, incluso a bajas concentraciones, se puede determinar el porcentaje de basófilos activados después de la estimulación in vitro por alérgenos y que expresan el marcador CD63. El marcador CD63 es un antígeno marcado con isotiocianato de fluoresceína que se puede unir a una proteína CD63 y se utiliza para clasificar las células a través de FACS (clasificación/clasificación de células activadas por fluorescencia). Este antígeno marcado con FITC emite luz a una longitud de onda de 530 nm. Dado que la intensidad de la fluorescencia emitida es proporcional a los sitios de unión de cada célula individual, la intensidad aumentará según el número de anticuerpos conjugados con FITC unidos a las células que expresan CD63.
Procedimiento
Se prepara un tubo de ensayo con tampón de estimulación de basófilos (BSB) que incluye interleucina 3 y un alérgeno que se va a analizar. Se añade la muestra de sangre y se incuba el tubo a 37 °C durante varios minutos, para garantizar que los alérgenos puedan unirse a la IgE. Al agregar EDTA al tubo de ensayo, el proceso de desgranulación se detiene inmediatamente. Después de la desgranulación, se agrega al tubo de ensayo un marcador CD63 (anticuerpos marcados). Varios minutos a temperatura ambiente dan tiempo al marcador para unirse a las proteínas CD63 en la membrana celular del basófilo. Se realiza un paso de lisis para lisar los glóbulos rojos. Debido a que superan en número a los leucocitos, es necesario eliminarlos para efectuar un análisis FACS de los basófilos.
Véase también
Referencias
- Böhm I et al. Pilot study on basophil activation induced by contrast medium. Fundam Clin Pharmacol 2011;25:267 - 276
- Janeway CA, Jr. (2001). Immunobiology (5th edición). Garland Publishing. (electronic full text via NCBI Bookshelf) ISBN 0-8153-3642-X.