Receptor Fc
Un receptor Fc, (FcR en inglés) es una proteína que se encuentra en la superficie de ciertas células (incluidos, entre otros, linfocitos B, células dendríticas foliculares, células asesinas naturales, macrófagos, neutrófilos, eosinófilos, basófilos, plaquetas humanas y mastocitos) que contribuyen a las funciones protectoras del sistema inmunológico. Su nombre se deriva de su especificidad de unión para una parte de un anticuerpo conocido como región Fc (fragmento cristalizable). Los receptores Fc se unen a anticuerpos que se adhieren a células infectadas o patógenos invasores. Su actividad estimula las células fagocíticas o citotóxicas para destruir microbios, o células infectadas por fagocitosis mediada por anticuerpos o citotoxicidad mediada por células dependiente de anticuerpos. Algunos virus, como los flavivirus, utilizan receptores Fc para ayudarles a infectar células, mediante un mecanismo conocido como potenciación de la infección dependiente de anticuerpos.[1]
| Receptor Fc | ||
|---|---|---|
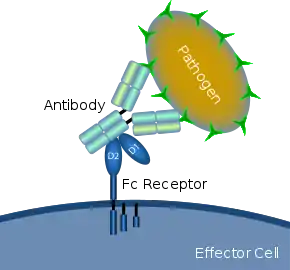 Diagrama esquemático que muestra la interacción del receptor Fc con un patógeno microbiano recubierto de anticuerpo | ||
| Identificadores | ||
| Símbolo | Receptor Fc | |
Clases
Hay varios tipos diferentes de receptores Fc (abreviado FcR), que se clasifican según el tipo de anticuerpo que reconocen. La letra latina utilizada para identificar un tipo de anticuerpo se convierte en la letra griega correspondiente, que se coloca después de la parte 'Fc' del nombre. Por ejemplo, los que se unen a la clase más común de anticuerpos, IgG, se denominan receptores Fc-gamma (FcγR), los que se unen a IgA se denominan receptores Fc-alfa (FcαR) y los que se unen a IgE se denominan receptores Fc-épsilon (FcεR). Las clases de FcR también se distinguen por las leucocitos que las expresan (macrófagos, granulocitos, células asesinas naturales, células T y B) y las propiedades de señalización de cada receptor.[2]
Receptores Fc-gamma
Todos los receptores Fcγ (FcγR) pertenecen a la superfamilia de inmunoglobulinas y son los receptores Fc más importantes para inducir la fagocitosis de microbios opsonizados (marcados).[3] Esta familia incluye varios miembros, FcγRI (CD64), FcγRIIA (CD32), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b), que difieren en sus afinidades de anticuerpos debido a su diferente estructura molecular.[4] Por ejemplo, FcγRI se une a IgG con más fuerza que FcγRII o FcγRIII. FcγRI también tiene una porción extracelular compuesta por tres dominios similares a inmunoglobulina (Ig), un dominio más que el que tiene FcγRII o FcγRIII. Esta propiedad permite que FcγRI se una a una única molécula de IgG (o monómero), pero todos los receptores de Fcγ deben unirse a múltiples moléculas de IgG dentro de un complejo inmune para activarse.[5]
Los receptores Fc-gamma difieren en su afinidad por IgG y, de la misma forma, las diferentes subclases de IgG tienen afinidades únicas para cada uno de los receptores Fc gamma. Estas interacciones se sintonizan aún más mediante el glicano (oligosacárido) en la posición CH2-84.4 de IgG. Por ejemplo, al crear un impedimento estérico, la fucosa que contiene glucanos CH2-84.4 reduce la afinidad de IgG por FcγRIIIA. Por el contrario, los glicanos G0, que carecen de galactosa y terminan en cambio con restos GlcNAc, tienen una mayor afinidad por FcγRIIIA.[6]
Otro FcR se expresa en múltiples tipos de células y es similar en estructura al MHC de clase I. Este receptor también se une a IgG y participa en la conservación de este anticuerpo.[7] Sin embargo, dado que este receptor Fc también está involucrado en la transferencia de IgG de la madre, ya sea a través de la placenta a su feto o en la leche a su niño de pecho lactante, se llama la neonatal receptor Fc (FcRn).[8] [9] Recientemente, la investigación sugirió que este receptor juega un papel en la homeostasis de los niveles séricos de IgG.
Receptores Fc-alfa
Solo un receptor Fc pertenece al subgrupo FcαR, que se denomina FcαRI (o CD89).[10] El FcαRI se encuentra en la superficie de neutrófilos, eosinófilos, monocitos, algunos macrófagos (incluidas las células de Kupffer) y algunas células dendríticas. Se compone de dos dominios extracelulares similares a Ig y es miembro tanto de la superfamilia de inmunoglobulinas como de la familia de receptores de reconocimiento inmunitario multicadena (MIRR).[3] Señala al asociarse con dos cadenas de señalización FcRγ. Otro receptor también puede unirse a IgA, aunque tiene mayor afinidad por otro anticuerpo llamado IgM.[11] Este receptor se llama receptor Fc-alfa/mu (Fcα/μR) y es una proteína transmembrana de tipo I. Con un dominio similar a Ig en su porción extracelular, este receptor Fc también es miembro de la superfamilia de inmunoglobulinas.[12]
Receptores Fc-épsilon
Se conocen dos tipos de FcεR[3]
- El receptor de alta afinidad FcεRI es un miembro de la superfamilia de inmunoglobulinas (tiene dos dominios similares a Ig). El FcεRI se encuentra en células de Langerhans epidérmicas, eosinófilos, mastocitos y basófilos.[13][14] Como resultado de su distribución celular, este receptor juega un papel importante en el control de las respuestas alérgicas. El FcεRI también se expresa en las células presentadoras de antígenos y controla la producción de importantes mediadores inmunitarios llamados citocinas que promueven la inflamación.[15]
- El receptor de baja afinidad FcεRII (CD23) es una lectina de tipo C. El FcεRII tiene múltiples funciones como receptor soluble o unido a la membrana; controla el crecimiento y la diferenciación de las células B y bloquea la unión a IgE de eosinófilos, monocitos y basófilos.[16]
Tabla de resumen
| Nombre del receptor | Ligando principal de anticuerpos | Afinidad por ligando | Distribución celular | Efecto después de la unión al anticuerpo |
| FcγRI (CD64) | IgG1 e IgG3 | Alto (Kd ~ 10−9 M) | Macrófagos Neutrófilos Eosinófilos Células dendríticas |
Fagocitosis Activación celular Activación del estallido respiratorio Inducción de la muerte de microbios |
| FcγRIIA
(CD32) |
IgG | Bajo (Kd>10−7 M) | Macrófagos Neutrófilos Eosinófilos Plaquetas Células de Langerhans |
Fagocitosis Desgranulación (eosinófilos) |
| FcγRIIB1
(CD32) |
IgG | Bajo (Kd>10 −7 M) | Células B Mastocitos |
Sin fagocitosis Inhibición de la actividad celular. |
| FcγRIIB2
(CD32) |
IgG | Bajo (Kd>10−7 M) | Macrófagos Neutrófilos Eosinófilos |
Fagocitosis Inhibición de la actividad celular. |
| FcγRIIIA
(CD16a) |
IgG | Bajo (Kd>10−6 M) | Células NK Macrófagos (ciertos tejidos) |
Inducción de citotoxicidad mediada por células dependiente de anticuerpos (ADCC) Inducción de la liberación de citocinas por macrófagos. |
| FcγRIIIB
(CD16b) |
IgG | Bajo (Kd>10−6 M) | Eosinófilos Macrófagos Neutrófilos Mastocitos Células dendríticas foliculares |
Inducción de la muerte de microbios |
| FcεRI | IgE | Alto (Kd ~ 10−10 M) | Mastocitos Eosinófilos Basófilos Células de Langerhans Monocitos |
Desgranulación Fagocitosis |
| FcεRII
(CD23) |
IgE | Bajo (Kd> 10−7 M) | Células B Eosinófilos Células de Langerhans |
Posible molécula de adhesión Transporte de IgE a través del epitelio intestinal humano Mecanismo de retroalimentación positiva para mejorar la sensibilización alérgica (células B) |
| FcαRI
(CD89) |
IgA | Bajo (Kd> 10−6 M) | Monocitos Macrófagos Neutrófilos Eosinófilos |
Fagocitosis Inducción de la muerte de microbios |
| Fcα/μR | IgA e IgM | Alto para IgM, medio para IgA | Células B Células mesangiales Macrófagos |
Endocitosis Inducción de la muerte de microbios |
| FcRn | IgG | Monocitos Macrófagos Células dendríticas Células epiteliales Células endoteliales Hepatocitos |
Transfiere IgG de la madre al feto a través de la placenta. Transfiere IgG de la madre al bebé en la leche. Protege la IgG de la degradación. |
Funciones

Los receptores Fc se encuentran en varias células del sistema inmunitario, incluidos fagocitos como macrófagos y monocitos, granulocitos como neutrófilos y eosinófilos y linfocitos del sistema inmunitario innato (células asesinas naturales) o del sistema inmunitario adaptativo (porque ejemplo, células B).[17][18] [19] Permiten que estas células se unan a anticuerpos que están adheridos a la superficie de microbios o células infectadas por microbios, lo que ayuda a estas células a identificar y eliminar patógenos microbianos. Los receptores Fc se unen a los anticuerpos en su región Fc (o cola), una interacción que activa la célula que posee el receptor Fc.[20] La activación de los fagocitos es la función más común atribuida a los receptores Fc. Por ejemplo, los macrófagos comienzan a ingerir y matar un patógeno recubierto de IgG por fagocitosis después de la activación de sus receptores Fcγ.[21] Otro proceso que involucra a los receptores Fc se llama citotoxicidad mediada por células dependiente de anticuerpos (ADCC). Durante la ADCC, los receptores FcγRIII en la superficie de las células asesinas naturales (NK) estimulan a las células NK para que liberen moléculas citotóxicas de sus gránulos para matar las células diana cubiertas de anticuerpos.[22] FcεRI tiene una función diferente. El FcεRI es el receptor de Fc en los granulocitos, que participa en las reacciones alérgicas y la defensa contra las infecciones parasitarias. Cuando está presente un antígeno o parásito alérgico apropiado, la reticulación de al menos dos moléculas de IgE y sus receptores Fc en la superficie de un granulocito provocará que la célula libere rápidamente mediadores preformados de sus gránulos.[3]
Mecanismos de señalización: receptores Fc gamma
Activación
Los receptores Fc gamma pertenecen al grupo de receptores fosforilados de tirosina no catalíticos que comparten una vía de señalización similar que implica la fosforilación de residuos de tirosina.[23] Los receptores generan señales dentro de sus células a través de un importante motivo de activación conocido como motivo de activación inmunorreceptor basado en tirosina (ITAM).[24] Un ITAM es una secuencia específica de aminoácidos (YXXL) que ocurre dos veces en sucesión cercana en la cola intracelular de un receptor. Cuando se agregan grupos fosfato al residuo de tirosina (Y) del ITAM mediante enzimas ancladas a la membrana de la familia de quinasas Src, se genera una cascada de señalización dentro de la célula. Esta reacción de fosforilación sigue típicamente a la interacción de un receptor Fc con su ligando. Un ITAM está presente en la cola intracelular de FcγRIIA y su fosforilación induce la fagocitosis en los macrófagos. FcγRI y FcγRIIIA no tienen un ITAM, pero pueden transmitir una señal de activación a sus fagocitos al interactuar con otra proteína que lo tenga. Esta proteína adaptadora se denomina subunidad Fcγ y, como FcγRIIA, contiene las dos secuencias YXXL que son características de un ITAM.
Inhibición
La presencia de un solo motivo YXXL no es suficiente para activar las células y representa un motivo (I/VXXYXXL) conocido como motivo inhibidor inmunorreceptor basado en tirosina (ITIM). FcγRIIB1 y FcγRIIB2 tienen una secuencia ITIM y son receptores inhibidores de Fc; no inducen fagocitosis. Las acciones inhibidoras de estos receptores están controladas por enzimas que eliminan los grupos fosfato de los residuos de tirosina; las fosfatasas SHP-1 y SHIP-1 inhiben la señalización de los receptores Fcγ.[25] La unión del ligando a FcγRIIB conduce a la fosforilación de la tirosina del motivo ITAM. Esta modificación genera el sitio de unión para la fosfatasa, un dominio de reconocimiento SH2. La derogación de la señalización de activación de ITAM es causada por la inhibición de las proteínas tirosina quinasas de la familia Src y por hidrolización de la membrana PIP3 interrumpiendo la señalización posterior de los receptores de activación, como la activación de FcγR, TCR, BCR y receptores de citocina (por ejemplo, C-Kit).[26]
La señalización negativa de FcγRIIB es principalmente importante para la regulación de las células B activadas. La señalización positiva de las células B se inicia mediante la unión de un antígeno extraño a la inmunoglobulina de superficie. Se secreta el mismo anticuerpo específico de antígeno y puede suprimir por retroalimentación o promover la señalización negativa. Esta señalización negativa la proporciona FcγRIIB.[27] Experimentos que utilizan mutantes de deleción de células B y enzimas dominantes negativas han establecido firmemente un papel importante para la inositol 5-fosfatasa (SHIP) que contiene el dominio SH2 en la señalización negativa. La señalización negativa a través de SHIP parece inhibir la vía Ras a través de la competencia del dominio SH2 con Grb2 y Shc y puede implicar el consumo de mediadores lipídicos intracelulares que actúan como activadores de enzimas alostéricas o que promueven la entrada de Ca2+ extracelular.[28]
Activación celular
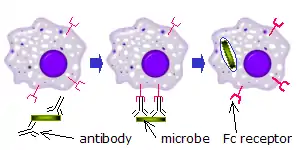
Sobre los fagocitos
Cuando las moléculas de IgG, específicas para un determinado antígeno o componente de superficie, se unen al patógeno con su región Fab (región de unión al antígeno del fragmento), sus regiones Fc apuntan hacia afuera, en el alcance directo de los fagocitos. Los fagocitos se unen a esas regiones Fc con sus receptores Fc.[21] Se forman muchas interacciones de baja afinidad entre el receptor y el anticuerpo que trabajan juntos para unirse estrechamente al microbio recubierto de anticuerpo. La baja afinidad individual evita que los receptores Fc se unan a los anticuerpos en ausencia de antígeno y, por lo tanto, reduce la posibilidad de activación de las células inmunitarias en ausencia de infección. Esto también evita la aglutinación (coagulación) de los fagocitos por el anticuerpo cuando no hay antígeno. Una vez que se ha unido un patógeno, las interacciones entre la región Fc del anticuerpo y los receptores Fc del fagocito dan como resultado el inicio de la fagocitosis. El patógeno es engullido por el fagocito mediante un proceso activo que implica la unión y liberación del complejo región Fc/receptor Fc, hasta que la membrana celular del fagocito encierra completamente al patógeno.[29]
En células NK
El receptor Fc en las células NK reconoce la IgG que está unida a la superficie de una célula diana infectada por patógenos y se llama CD16 o FcγRIII.[30] La activación de FcγRIII por IgG provoca la liberación de citocinas como IFN-γ que envían señales a otras células inmunes, y mediadores citotóxicos como perforina y granzima que ingresan a la célula diana y promueven la muerte celular al desencadenar la apoptosis. Este proceso se conoce como citotoxicidad mediada por células dependiente de anticuerpos (ADCC). FcγRIII en células NK también puede asociarse con IgG monomérico (es decir, IgG que no está unida a antígeno). Cuando esto ocurre, el receptor Fc inhibe la actividad de la célula NK.[31]
En mastocitos

Los anticuerpos IgE se unen a antígenos de alérgenos. Estas moléculas de IgE unidas a alérgenos interactúan con los receptores Fcε en la superficie de los mastocitos. La activación de los mastocitos tras el acoplamiento de FcεRI da como resultado un proceso llamado desgranulación, mediante el cual el mastocito libera moléculas preformadas de sus gránulos citoplasmáticos; estos son una mezcla de compuestos que incluyen histamina, proteoglicanos y serina proteasas.[32] Los mastocitos activados también sintetizan y secretan mediadores derivados de lípidos (como prostaglandinas, leucotrienos y factor activador de plaquetas) y citocinas (interleucina 1, interleucina 3, interleucina 4, interleucina 5, interleucina 6, interleucina 13, factor de necrosis tumoral -alfa, GM-CSF y varias quimiocinas).[33][34] Estos mediadores contribuyen a la inflamación al atraer a otros leucocitos.
En eosinófilos
Los parásitos grandes como el helminto (gusano) Schistosoma mansoni son demasiado grandes para que los fagocitos los ingieran. También tienen una estructura externa llamada tegumento que es resistente al ataque de sustancias liberadas por macrófagos y mastocitos. Sin embargo, estos parásitos pueden recubrirse con IgE y ser reconocidos por FcεRI en la superficie de los eosinófilos. Los eosinófilos activados liberan mediadores preformados como la proteína básica principal y enzimas como la peroxidasa, contra las cuales los helmintos no son resistentes.[35][36] La interacción del receptor FcεRI con la porción Fc de la IgE unida a helmintos hace que el eosinófilo libere estas moléculas en un mecanismo similar al de la célula NK durante la ADCC.[37]
En linfocitos T
Las células T CD4 + (células Th maduras) ayudan a las células B que producen anticuerpos. En la patología de la enfermedad se observan varios subconjuntos de células T efectoras CD4+ activadas. Estudios anteriores sugirieron roles críticos para los FcR en las respuestas inmunes mediadas por células T CD4 + y propusieron la formación de un complejo de señalización conjunta entre FcR y TCR en la superficie celular.[38] [39] [40] [41] Se ha informado de la colocalización de los CI marcados con el complejo CD3 en la superficie de las células T CD4 + activadas, lo que sugiere la coexistencia de FcR junto con el complejo TCR.[42] Se observa que ambos receptores forman una estructura apical en la membrana de las células T CD4 + activadas, lo que sugiere el movimiento lateral de estos receptores.[42] La co-migración de FcR con el complejo TCR y BCR se observa en la superficie de las células y los citoconjugados de células T: B muestran esta coexistencia en el punto de contacto.[39] Una revisión anterior sugirió que la expresión de FcR en las células T CD4+ es una cuestión abierta.[43] Esto estableció el paradigma actual de que las células T no expresan FcR y estos hallazgos nunca fueron desafiados ni probados experimentalmente.[44] Se ha mostrado la unión de inmunocomplejos (CI), el ligando FcR a las células T CD4+ activadas. La expresión de CD16a se induce en las células T CD4+ vírgenes humanas activadas, que expresan CD25, CD69 y CD98 y la unión a los CI conduce a la generación de células de memoria efectoras.[45] La señalización de CD16a está mediada por la fosforilación de Syk (pSyk).[45][46][47]
Un estudio sugiere la expresión inducida de CD32a tras la activación de células T CD4+ humanas, similar a CD16a.[46][48] La expresión de CD32a en las células T CD4 + también fue sugerida estudios de investigadores del VIH-1. Ahora se confirma la expresión de CD16a y CD32a en un subconjunto de células T CD4 + activadas. Los FcR en la superficie celular al unirse a los CI compuestos de ácidos nucleicos desencadenan la producción de citocinas y regulan positivamente las vías de detección de ácidos nucleicos. Los FcR están presentes tanto en la superficie celular como en el citosol. La señalización de CD16a regula al alza la expresión de receptores de tipo toll que detectan ácidos nucleicos y los reubica en la superficie celular.[45][49] CD16a es una nueva señal coestimuladora para las células T CD4+ humanas, que sustituye con éxito el requisito de CD28 durante la autoinmunidad.[50] En un fondo autoinmune, las células T CD4+ evitan el requisito de la cososeñalización CD28 para activarse por completo. Además, el bloqueo de la cososeñalización de CD28 no inhibe el desarrollo de células TFH, un subconjunto clave para la generación de autoanticuerpos productores de células B plasmáticas autorreactivas.[51] Se requiere un equilibrio entre las señales coestimuladoras e inhibidoras para la homeostasis inmunitaria. La coestimulación excesiva y/o la co-inhibición insuficiente conducen a la degradación de la tolerancia y la autoinmunidad. La coestimulación mediada por CD16a proporciona una señal positiva en las células T CD4+ activadas y no en las células inactivas que carecen de expresión de FcγR.[46]
Véase también
- Molécula similar al receptor de Fc
Referencias
- Anderson, Robert (2003). «Manipulation of cell surface macromolecules by flaviviruses». Advances in Virus Research 59: 229-274. ISSN 0065-3527. PMC 7252169. PMID 14696331. doi:10.1016/S0065-3527(03)59007-8.
- Owen, Judith A.; Stranford, Sharon A.; Jones, Patricia P.; Kuby, Janis (2013). Kuby immunology (7th ed edición). W.H. Freeman. p. 423. ISBN 978-1-4292-1919-8. OCLC 820117219. Consultado el 5 de abril de 2021.
- Fridman, W. H. (1991-09). «Fc receptors and immunoglobulin binding factors». FASEB journal: official publication of the Federation of American Societies for Experimental Biology 5 (12): 2684-2690. ISSN 0892-6638. PMID 1916092. doi:10.1096/fasebj.5.12.1916092.
- Indik, Z. K.; Park, J. G.; Hunter, S.; Schreiber, A. D. (15 de diciembre de 1995). «The molecular dissection of Fc gamma receptor mediated phagocytosis». Blood 86 (12): 4389-4399. ISSN 0006-4971. PMID 8541526.
- Harrison, P. T.; Davis, W.; Norman, J. C.; Hockaday, A. R.; Allen, J. M. (30 de septiembre de 1994). «Binding of monomeric immunoglobulin G triggers Fc gamma RI-mediated endocytosis». The Journal of Biological Chemistry 269 (39): 24396-24402. ISSN 0021-9258. PMID 7929100.
- Maverakis, Emanual; Kim, Kyoungmi; Shimoda, Michiko; Gershwin, M. Eric; Patel, Forum; Wilken, Reason; Raychaudhuri, Siba; Ruhaak, L. Renee et al. (2015-2). «Glycans In The Immune system and The Altered Glycan Theory of Autoimmunity: A Critical Review». Journal of autoimmunity 0: 1-13. ISSN 0896-8411. PMC 4340844. PMID 25578468. doi:10.1016/j.jaut.2014.12.002.
- Zhu, Xiaoping; Meng, Gang; Dickinson, Bonny L.; Li, Xiaotong; Mizoguchi, Emiko; Miao, Lili; Wang, Yuansheng; Robert, Caroline et al. (1 de marzo de 2001). «MHC Class I-Related Neonatal Fc Receptor for IgG Is Functionally Expressed in Monocytes, Intestinal Macrophages, and Dendritic Cells». Journal of immunology (Baltimore, Md. : 1950) 166 (5): 3266-3276. ISSN 0022-1767. PMC 2827247. PMID 11207281.
- Firan, M.; Bawdon, R.; Radu, C.; Ober, R. J.; Eaken, D.; Antohe, F.; Ghetie, V.; Ward, E. S. (2001-08). «The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans». International Immunology 13 (8): 993-1002. ISSN 0953-8178. PMID 11470769. doi:10.1093/intimm/13.8.993.
- Simister, N. E.; Jacobowitz Israel, E.; Ahouse, J. C.; Story, C. M. (1997-05). «New functions of the MHC class I-related Fc receptor, FcRn». Biochemical Society Transactions 25 (2): 481-486. ISSN 0300-5127. PMID 9191140. doi:10.1042/bst0250481.
- Otten, Marielle A.; van Egmond, Marjolein (29 de marzo de 2004). «The Fc receptor for IgA (FcalphaRI, CD89)». Immunology Letters 92 (1-2): 23-31. ISSN 0165-2478. PMID 15081523. doi:10.1016/j.imlet.2003.11.018.
- Shibuya, Akira; Honda, Shin-Ichiro (2006-12). «Molecular and functional characteristics of the Fcalpha/muR, a novel Fc receptor for IgM and IgA». Springer Seminars in Immunopathology 28 (4): 377-382. ISSN 0344-4325. PMID 17061088. doi:10.1007/s00281-006-0050-3.
- Cho, Yukiko; Usui, Kenta; Honda, Shin-Ichiro; Tahara-Hanaoka, Satoko; Shibuya, Kazuko; Shibuya, Akira (23 de junio de 2006). «Molecular characteristics of IgA and IgM Fc binding to the Fcalpha/muR». Biochemical and Biophysical Research Communications 345 (1): 474-478. ISSN 0006-291X. PMID 16681999. doi:10.1016/j.bbrc.2006.04.084.
- Ochiai, K.; Wang, B.; Rieger, A.; Kilgus, O.; Maurer, D.; Födinger, D.; Kinet, J. P.; Stingl, G. et al. (1994). «A review on Fc epsilon RI on human epidermal Langerhans cells». International Archives of Allergy and Immunology. 104 Suppl 1 (1): 63-64. ISSN 1018-2438. PMID 8156009. doi:10.1159/000236756.
- Prussin, Calman; Metcalfe, Dean D. (2006-02). «5. IgE, mast cells, basophils, and eosinophils». The Journal of Allergy and Clinical Immunology 117 (2 Suppl Mini-Primer): S450-456. ISSN 0091-6749. PMID 16455345. doi:10.1016/j.jaci.2005.11.016.
- von Bubnoff, D.; Novak, N.; Kraft, S.; Bieber, T. (2003-03). «The central role of FcepsilonRI in allergy». Clinical and Experimental Dermatology 28 (2): 184-187. ISSN 0307-6938. PMID 12653710. doi:10.1046/j.1365-2230.2003.01209.x.
- Kikutani, H.; Yokota, A.; Uchibayashi, N.; Yukawa, K.; Tanaka, T.; Sugiyama, K.; Barsumian, E. L.; Suemura, M. et al. (1989). «Structure and function of Fc epsilon receptor II (Fc epsilon RII/CD23): a point of contact between the effector phase of allergy and B cell differentiation». Ciba Foundation Symposium 147: 23-31; discussion 31-35. ISSN 0300-5208. PMID 2695308. doi:10.1002/9780470513866.ch3.
- Selvaraj, Periasamy; Fifadara, Nimita; Nagarajan, Shanmugam; Cimino, Ashley; Wang, Guixian (2004). «Functional regulation of human neutrophil Fc gamma receptors». Immunologic Research 29 (1-3): 219-230. ISSN 0257-277X. PMID 15181284. doi:10.1385/IR:29:1-3:219.
- Sulica, A.; Chambers, W. H.; Manciulea, M.; Metes, D.; Corey, S.; Rabinowich, H.; Whiteside, T. L.; Herberman, R. B. (1995). «Divergent signal transduction pathways and effects on natural killer cell functions induced by interaction of Fc receptors with physiologic ligands or antireceptor antibodies». Natural Immunity 14 (3): 123-133. ISSN 1018-8916. PMID 8832896.
- Sarfati, M.; Fournier, S.; Wu, C. Y.; Delespesse, G. (1992). «Expression, regulation and function of human Fc epsilon RII (CD23) antigen». Immunologic Research 11 (3-4): 260-272. ISSN 0257-277X. PMID 1287120. doi:10.1007/BF02919132.
- Raghavan, M.; Bjorkman, P. J. (1996). «Fc receptors and their interactions with immunoglobulins». Annual Review of Cell and Developmental Biology 12: 181-220. ISSN 1081-0706. PMID 8970726. doi:10.1146/annurev.cellbio.12.1.181.
- Swanson, Joel A.; Hoppe, Adam D. (2004-12). «The coordination of signaling during Fc receptor-mediated phagocytosis». Journal of Leukocyte Biology 76 (6): 1093-1103. ISSN 0741-5400. PMID 15466916. doi:10.1189/jlb.0804439.
- Sun, Peter D. (2003). «Structure and function of natural-killer-cell receptors». Immunologic Research 27 (2-3): 539-548. ISSN 0257-277X. PMID 12857997. doi:10.1385/IR:27:2-3:539.
- Dushek, Omer; Goyette, Jesse; van der Merwe, P. Anton (2012-11). «Non-catalytic tyrosine-phosphorylated receptors». Immunological Reviews 250 (1): 258-276. ISSN 1600-065X. PMID 23046135. doi:10.1111/imr.12008.
- Cambier, J. C. (1995-02). «New nomenclature for the Reth motif (or ARH1/TAM/ARAM/YXXL)». Immunology Today 16 (2): 110. ISSN 0167-5699. PMID 7888063. doi:10.1016/0167-5699(95)80105-7.
- Huang, Zhen-Yu; Hunter, Sharon; Kim, Moo-Kyung; Indik, Zena K.; Schreiber, Alan D. (2003-06). «The effect of phosphatases SHP-1 and SHIP-1 on signaling by the ITIM- and ITAM-containing Fcgamma receptors FcgammaRIIB and FcgammaRIIA». Journal of Leukocyte Biology 73 (6): 823-829. ISSN 0741-5400. PMID 12773515. doi:10.1189/jlb.0902454.
- Cambier, John C. (10 de junio de 1997). «Inhibitory receptors abound?». Proceedings of the National Academy of Sciences of the United States of America 94 (12): 5993-5995. ISSN 0027-8424. PMID 9177155.
- Takai, T.; Ono, M.; Hikida, M.; Ohmori, H.; Ravetch, J. V. (25 de enero de 1996). «Augmented humoral and anaphylactic responses in Fc gamma RII-deficient mice». Nature 379 (6563): 346-349. ISSN 0028-0836. PMID 8552190. doi:10.1038/379346a0.
- Coggeshall, K. M. (1998-06). «Inhibitory signaling by B cell Fc gamma RIIb». Current Opinion in Immunology 10 (3): 306-312. ISSN 0952-7915. PMID 9638367. doi:10.1016/s0952-7915(98)80169-6.
- Joshi, Trupti; Butchar, Jonathan P.; Tridandapani, Susheela (2006-10). «Fcgamma receptor signaling in phagocytes». International Journal of Hematology 84 (3): 210-216. ISSN 0925-5710. PMID 17050193. doi:10.1532/IJH97.06140.
- Trinchieri, G.; Valiante, N. (1993-07). «Receptors for the Fc fragment of IgG on natural killer cells». Natural Immunity 12 (4-5): 218-234. ISSN 1018-8916. PMID 8257828.
- Sulica, A.; Galatiuc, C.; Manciulea, M.; Bancu, A. C.; DeLeo, A.; Whiteside, T. L.; Herberman, R. B. (1 de abril de 1993). «Regulation of human natural cytotoxicity by IgG. IV. Association between binding of monomeric IgG to the Fc receptors on large granular lymphocytes and inhibition of natural killer (NK) cell activity». Cellular Immunology 147 (2): 397-410. ISSN 0008-8749. PMID 8453679. doi:10.1006/cimm.1993.1079.
- Yamasaki, Sho; Saito, Takashi (2005). «Regulation of mast cell activation through FcepsilonRI». Chemical Immunology and Allergy 87: 22-31. ISSN 1660-2242. PMID 16107760. doi:10.1159/000087568.
- Wakahara, S.; Fujii, Y.; Nakao, T.; Tsuritani, K.; Hara, T.; Saito, H.; Ra, C. (21 de noviembre de 2001). «Gene expression profiles for Fc epsilon RI, cytokines and chemokines upon Fc epsilon RI activation in human cultured mast cells derived from peripheral blood». Cytokine 16 (4): 143-152. ISSN 1043-4666. PMID 11792124. doi:10.1006/cyto.2001.0958.
- Metcalfe, D. D.; Baram, D.; Mekori, Y. A. (1997-10). «Mast cells». Physiological Reviews 77 (4): 1033-1079. ISSN 0031-9333. PMID 9354811. doi:10.1152/physrev.1997.77.4.1033.
- David, J. R.; Butterworth, A. E.; Vadas, M. A. (1980-09). «Mechanism of the interaction mediating killing of Schistosoma mansoni by human eosinophils». The American Journal of Tropical Medicine and Hygiene 29 (5): 842-848. ISSN 0002-9637. PMID 7435788. doi:10.4269/ajtmh.1980.29.842.
- Capron, M.; Soussi Gounni, A.; Morita, M.; Truong, M. J.; Prin, L.; Kinet, J. P.; Capron, A. (1995). «Eosinophils: from low- to high-affinity immunoglobulin E receptors». Allergy 50 (25 Suppl): 20-23. ISSN 0105-4538. PMID 7677229. doi:10.1111/j.1398-9995.1995.tb04270.x.
- Gounni, A. S.; Lamkhioued, B.; Ochiai, K.; Tanaka, Y.; Delaporte, E.; Capron, A.; Kinet, J. P.; Capron, M. (13 de enero de 1994). «High-affinity IgE receptor on eosinophils is involved in defence against parasites». Nature 367 (6459): 183-186. ISSN 0028-0836. PMID 8114916. doi:10.1038/367183a0.
- Pichler, W. J.; Lum, L.; Broder, S. (1978-10). «Fc-receptors on human T lymphocytes. I. Transition of Tgamma to Tmu cells». Journal of Immunology (Baltimore, Md.: 1950) 121 (4): 1540-1548. ISSN 0022-1767. PMID 308968.
- Sandor, M.; Lynch, R. G. (1993-05). «Lymphocyte Fc receptors: the special case of T cells». Immunology Today 14 (5): 227-231. ISSN 0167-5699. PMID 8517922. doi:10.1016/0167-5699(93)90168-K.
- Engelhardt, W.; Matzke, J.; Schmidt, R. E. (1995-04). «Activation-dependent expression of low affinity IgG receptors Fc gamma RII(CD32) and Fc gamma RIII(CD16) in subpopulations of human T lymphocytes». Immunobiology 192 (5): 297-320. ISSN 0171-2985. PMID 7649565. doi:10.1016/s0171-2985(11)80172-5.
- Moretta, L.; Webb, S. R.; Grossi, C. E.; Lydyard, P. M.; Cooper, M. D. (1 de julio de 1977). «Functional analysis of two human T-cell subpopulations: help and suppression of B-cell responses by T cells bearing receptors for IgM or IgG». The Journal of Experimental Medicine 146 (1): 184-200. ISSN 0022-1007. PMC 2180738. PMID 301544. doi:10.1084/jem.146.1.184.
- Chauhan AK, Moore TL (2011). «T cell activation by terminal complex of complement and immune complexes». The Journal of Biological Chemistry 286 (44): 38627-38637. PMC 3207419. PMID 21900254. doi:10.1074/jbc.M111.266809.
- Nimmerjahn, Falk; Ravetch, Jeffrey V. (2008-01). «Fcgamma receptors as regulators of immune responses». Nature Reviews. Immunology 8 (1): 34-47. ISSN 1474-1741. PMID 18064051. doi:10.1038/nri2206.
- Bruhns, Pierre; Jönsson, Friederike (2015-11). «Mouse and human FcR effector functions». Immunological Reviews 268 (1): 25-51. ISSN 1600-065X. PMID 26497511. doi:10.1111/imr.12350.
- Chauhan, Anil K.; Moore, Terry L.; Bi, Ye; Chen, Chen (15 de enero de 2016). «FcγRIIIa-Syk Co-signal Modulates CD4+ T-cell Response and Up-regulates Toll-like Receptor (TLR) Expression». The Journal of Biological Chemistry 291 (3): 1368-1386. ISSN 1083-351X. PMC 4714221. PMID 26582197. doi:10.1074/jbc.M115.684795.
- Chauhan, Anil K; Chen, Chen; Moore, Terry L.; DiPaolo, Richard J (20 de febrero de 2015). «Induced Expression of FcγRIIIa (CD16a) on CD4+ T Cells Triggers Generation of IFN-γhigh Subset». The Journal of Biological Chemistry 290 (8): 5127-5140. ISSN 0021-9258. PMC 4335247. PMID 25556651. doi:10.1074/jbc.M114.599266.
- Chauhan AK, Moore TL (2012). «Immune complexes and late complement proteins trigger activation of Syk tyrosine kinase in human CD4(+) T cells». Clin Exp Immunol 167 (2): 235-245. PMC 3278689. PMID 22235999. doi:10.1111/j.1365-2249.2011.04505.x.
- Holgado, María Pía; Sananez, Inés; Raiden, Silvina; Geffner, Jorge R.; Arruvito, Lourdes (2018). «CD32 Ligation Promotes the Activation of CD4+ T Cells». Frontiers in Immunology 9: 2814. ISSN 1664-3224. PMC 6284025. PMID 30555482. doi:10.3389/fimmu.2018.02814.
- Chauhan AK (2017). «FcgammaRIIIa Signaling Modulates Endosomal TLR Responses in Human CD4+ T Cells». J Immunol 198 (12): 4596-4606. PMC 5505339. PMID 28500073. doi:10.4049/jimmunol.1601954.
- Bour-Jordan, Hélène; Esensten, Jonathan H.; Martinez-Llordella, Marc; Penaranda, Cristina; Stumpf, Melanie; Bluestone, Jeffrey A. (2011-05). «Intrinsic and extrinsic control of peripheral T-cell tolerance by costimulatory molecules of the CD28/ B7 family». Immunological Reviews 241 (1): 180-205. ISSN 1600-065X. PMC 3077803. PMID 21488898. doi:10.1111/j.1600-065X.2011.01011.x.
- Weber, Jan P.; Fuhrmann, Franziska; Feist, Randi K.; Lahmann, Annette; Al Baz, Maysun S.; Gentz, Lea-Jean; Vu Van, Dana; Mages, Hans W. et al. (9 de febrero de 2015). «ICOS maintains the T follicular helper cell phenotype by down-regulating Krüppel-like factor 2». The Journal of Experimental Medicine 212 (2): 217-233. ISSN 1540-9538. PMC 4322049. PMID 25646266. doi:10.1084/jem.20141432.
Otras lecturas
- Laneway, Charles A.; Travers, Paul; Waldport, Mark; Shlomchik, Mark J (2001). «Chapter 9. The Humoral Immune Response». Immunobiology: The Immune System in Health and Disease (5th edición). New York: Garland. ISBN 978-0-8153-3642-6.
- Abbas, Abul K.; Lichtman, Andrew H.; Pillai, Shiv (2012). «Chapter 12: Effector Mechanisms of Humoral Immunity». Cellular and molecular immunology (7th edición). Philadelphia: Elsevier/Saunders. ISBN 978-1-4377-1528-6.
- Gerber JS, Mosser DM (February 2001). «Stimulatory and inhibitory signals originating from the macrophage Fcgamma receptors». Microbes and Infection 3 (2): 131-9. PMID 11251299. doi:10.1016/s1286-4579(00)01360-5.
- Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (February 2015). «Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review». Journal of Autoimmunity 57: 1-13. PMC 4340844. PMID 25578468. doi:10.1016/j.jaut.2014.12.002.
Enlaces externos
- MeSH: Fc+Receptor (en inglés)