Quimiocina
Las quimiocinas o quimioquinas, también conocidas como «citocinas quimiotácticas» son proteínas de tamaño pequeño y bajo peso molecular (8 a 14 kDa) pertenecientes a la familia de las citocinas. Se llaman de este modo debido a que inicialmente fueron identificadas por su capacidad de activar, atraer y dirigir diversas familias de leucocitos circulantes hacia los sitios dañados. Las quimiocinas presentan una serie de características estructurales comunes, como su disposición tridimensional y la presencia de pares de cisteína unidos por puentes de disulfuro, las cuales son clave para ejercer su función.[1][2]

Las quimiocinas no solo participan en la coordinación del movimiento de leucocitos en los procesos inflamatorios sino que también tienen importancia en múltiples procesos fisiológicos y patológicos: desarrollo del sistema inmunitario; vigilancia, memoria, respuesta y regulación inmunitaria; inflamación; embriogénesis, angiogénesis y organogénesis; desarrollo y función del sistema nervioso; migración de células germinales; desarrollo del cáncer y metástasis.[3][4]
Estas proteínas han sido históricamente conocidas bajo otros nombres, tales como: la familia de las citoquinas SIS, la familia de las citoquinas SIG, la familia de las citoquinas SCY, factor plaquetario 4 o superfamilia de las intercrinas.[cita requerida]
Las quimiocinas se encuentran en todos los vertebrados y en algunos virus y bacterias, pero no se encuentran en ningún otro invertebrado. Estas proteínas ejercen sus efectos biológicos mediante la interacción con los receptores transmembrana unidos a proteínas G, llamados receptores de quimiocina, que se encuentran selectivamente en las superficies de sus células diana.
Estructura
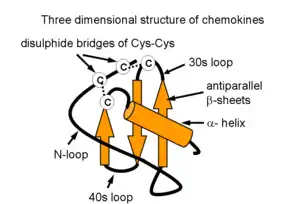
La estructura de las quimiocinas está basada en un monómero compuesto: por una región flexible N-terminal que precede una cisteína, es la región involucrada en la activación del receptor; luego del N-terminal hay un bucle de 10 a 20 residuos que tiene que ver con la especificidad del receptor; luego una hélice 310, una lámina beta conformada de 3 hebras beta antiparalelas; y finalmente una hélice alfa C-terminal que se plega contra la lámina beta. Los bucles que unen la primera con la segunda hebra y la segunda con la tercera hebra de la lámina beta se denominan 30s y 40s respectivamente.[5] (Ver figura)
Todas las quimiocinas comparten la estructura de llave griega que es estabilizada por puentes disulfuro entre residuos de cisteína. Las proteínas se clasifican como quimiocinas basándose en sus características estructurales, no solo por su capacidad para atraer a las células. Todas las quimiocinas son pequeñas (peso molecular entre 8 y 10 kDa). Son aproximadamente un 20-50% idénticas entre sí, es decir, comparten homología de secuencia genética y de secuencia de aminoácidos. Todos ellos poseen los aminoácidos que son necesarios para la creación de su estructura tridimensional o estructura terciaria, tales como (en la mayoría de los casos) cuatro cisteínas que interactúan entre sí en parejas para crear una forma de Llave griega que es característica de las quimiocinas. El primer residuo de cisteína se une con el tercero, y el segundo con el cuarto mediante puentes disulfuro. Las quimocinas típicas se producen como pro-péptidos, a partir de un péptido señal de aproximadamente 20 aminoácidos que se escinde de la porción activa (madura) de la molécula durante el proceso de su secreción de la célula. Las primeras dos cisteínas de una quimiocina están muy juntas y se encuentran situadas cerca del extremo N terminal de la proteína madura, con la tercera cisteína situada en el centro de la molécula y la cuarta cerca del extremo C terminal. A las primeras dos cisteínas le sigue un bucle de aproximadamente 10 aminoácidos y es conocida como bucle N. Esto es continuado por una hélice simple, llamada hélice 310, tres hebras beta y un C terminal hélice alfa. Estas hélices y hebras se conectan por giros llamados bucles 30s 40s y 50s. La tercera y la cuarta cisteína se encuentran en las hélices 30s y 50s.[6]
Clasificación
 | ||||
| Quimiocinas CC | ||||
|---|---|---|---|---|
| Nombre | Gen | Otros nombres | Receptor | Función[7] |
| CCL1 | Scya1 | I-309, TCA-3 | CCR8 | Atrae monocitos, linfocitos T asesinos, linfocitos B inmaduros y células dendríticas |
| CCL2 | Scya2 | MCP-1, MCAF(JE) | CCR2 | Atrae monocitos y basófilos; participa en patogenia de psoriasis, artritis reumatoide y ateroesclerosis |
| CCL3 | Scya3 | MIP-1a, LD8α | CCR1 | Efecto adhesivo en linfocitos |
| CCL3L1 | LD8β | CCR1 | Suprime el VIH | |
| CCL4 | Scya4 | MIP-1ß | CCR1, CCR5 | Atrae e induce adherencia de linfocitos, especialmente CD4+ |
| CCL5 | Scya5 | RANTES | CCR5 | Atrae monocitos, linfocitos T CD4+ de memoria y eosinófilos |
| CCL6 | Scya6 | C10, MRP-2 | CCR1 | Solo en ratones. Participa en la diferenciación mieloide |
| CCL7 | Scya7 | MARC, MCP-3 | CCR2 | Atrae macrófagos en inflamación y metástasis |
| CCL8 | Scya8 | MCP-2 | CCR1, CCR2B, CCR5 | Atrae monocitos, linfocitos, basófilos y eosinófilos |
| CCL9/CCL10 | Scya9 | MRP-2, CCF18, MIP-1? | CCR1 | Participa en la excreción biliar de varios aniones orgánicos |
| CCL11 | Scya11 | Eotaxin | CCR2, CCR3, CCR5 | Regula el reclutamiento y activación de leucocitos inflamatorios, especialmente eosinófilos; rol en las enfermedades alérgicas |
| CCL12 | Scya12 | MCP-5 | Atrae monocitos fuertemente | |
| CCL13 | Scya13 | MCP-4, NCC-1, Ckß10 | CCR2, CCR3, CCR5 | Similar al CCL7 |
| CCL14 | Scya14 | HCC-1, MCIF, Ckß1, NCC-2, CCL | CCR1 | Precursor de CCL3 y CCL4 |
| CCL15 | Scya15 | Leukotactin-1, MIP-5, HCC-2, NCC-3 | CCR1, CCR3 | Induce cambio en el calcio intracelular de monocitos |
| CCL16 | Scya16 | LEC, NCC-4, LMC, Ckß12 | CCR1, CCR2, CCR5, CCR8 | Atrae linfocitos y monocitos |
| CCL17 | Scya17 | TARC, dendrokine, ABCD-2 | CCR4 | Atrae linfocitos T |
| CCL18 | Scya18 | PARC, DC-CK1, AMAC-1, Ckß7, MIP-4 | Atrae linfocitos | |
| CCL19 | Scya19 | ELC, Exodus-3, Ckß11 | CCR7 | Atrae (in vitro) linfocitos, células dendríticas y progenitores hematopoiéticos |
| CCL20 | Scya20 | LARC, Exodus-1, Ckß4 | CCR6 | Atrae linfocitos y neutrófilos |
| CCL21 | Scya21 | SLC, 6Ckine, Exodus-2, Ckß9, TCA-4 | CCR7 | Participa en la migración de linfocitos a los tejidos linfáticos secundarios |
| CCL22 | Scya22 | MDC, DC/ß-CK | CCR4 | Atrae linfocitos T asesinos, linfocitos T activados, monocitos y células dendríticas |
| CCL23 | Scya23 | MPIF-1, Ckß8, MIP-3, MPIF-1 | CCR1 | Atrae monocitos, linfocitos T no activados y neutrófilos; inhibe la proliferación del progenitor mieloide |
| CCL24 | Scya24 | Eotaxin-2, MPIF-2, Ckß6 | CCR3 | Activa y atrae eowinófilos y basófilos |
| CCL25 | Scya25 | TECK, Ckß15 | CCR9 | Atrae células dendríticas, timocitos y macrófagos activados |
| CCL26 | Scya26 | Eotaxin-3, MIP-4a, IMAC, TSC-1 | CCR3 | Atrae eosinófilos y basófilos |
| CCL27 | Scya27 | CTACK, ILC, Eskine, PESKY, skinkine | CCR10 | Atrae linfocitos T de memoria en la piel |
| CCL28 | Scya28 | MEC | CCR3, CCR10 | Atrae linfocitos T CD4+ y CD8+ no activados, y eosinófilos |
| Quimiocinas CXC | ||||
| Nombre | Gen | Otros nombres | Receptor | Función[7] |
| CXCL1 | Scyb1 | Gro-α, GRO1, NAP-3, KC, MGSAα | CXCR2 | Atrae neutrófilos |
| CXCL2 | Scyb2 | Gro-ß, GRO2, MIP-2a, MGSAβ | CXCR2 | Promueve quimiotaxis y degranulación de neutrófilos y basófilos |
| CXCL3 | Scyb3 | Gro-γ, GRO3, MIP-2ß, MGSAγ | CXCR2 | Induce quimiotaxis en neutrófilos |
| CXCL4 | Scyb4 | PF-4 | CXCR3B | Inhibe actividad de antitrombina III, promueve coagulación. Fuerte atracción de neutrófilos y fibroblastos |
| CXCL5 | Scyb5 | ENA-78 | CXCR2 | Atracción y activación de neutrófilos |
| CXCL6 | Scyb6 | GCP-2 | CXCR1, CXCR2 | Reclutamiento de neutrófilos a sitios inflamados |
| CXCL7 | Scyb7 | NAP-2, CTAPIII, ß-Ta, PEP | CXCR2 | Potente atracción y activación de neutrófilos. Estimula varios procesos celulares. Estimula formación y secreción del activador tisular del plasminógeno |
| CXCL8 | Scyb8 | IL-8, NAP-1, MDNCF, GCP-1 | CXCR1, CXCR2 | Principal mediador de la inflamación. Atrae neutrófilos, basófilos y linfocitos T. Angiogénesis. |
| CXCL9 | Scyb9 | MIG, CRG-10 | CXCR3 | Atrae linfocitos Th1; inhibe crecimiento tumoral; estimula angiogénesis; inhibe colonias progenitores hematopoiéticos |
| CXCL10 | Scyb10 | IP-10, CRG-2 | CXCR3 | Atrae linfocitos CD4+; inhibe proliferación de progenitores hematopoiéticos normales y leucémicos; ¿regulación de angiogénesis en cáncer? |
| CXCL11 | Scyb11 | I-TAC, ß-R1, IP-9 | CXCR3 | Atrae linfocitos T activados por interleucinas, las induce a liberar calcio; rol en enfermedades neurológicas relacionadas con linfocitos y en enfermedades autoinmunes de la piel |
| CXCL12 | Scyb12 | SDF-1, PBSF | CXCR4 | Atrae fuertemente a linfocitos. En embriogénesis, dirige movimiento de células hematopoiéticas; angiogénesisv; muy importante en la generación de cáncer. |
| CXCL13 | Scyb13 | BCA-1, BLC | CXCR5 | Promueve migración de linfocitos B |
| CXCL14 | Scyb14 | BRAK, bolekine | Atrae monocitos | |
| CXCL15 | Scyb15 | Lungkine, WECHE | Recluta neutrófilos en el pulmón | |
| CXCL16 | Scyb16 | SRPSOX | CXCR6 | Atrae linfocitos T; rol en aterogénesis |
| CXCL17 | VCC-1 | DMC, VCC-1 | ||
| Quimiocinas CC | ||||
| Nombre | Gen | Otros nombres | Receptor | Función[7] |
| XCL1 | Scyc1 | Lymphotactin a, SCM-1a, ATAC | XCR1 | Mensajero entre linfocitos T |
| XCL2 | Scyc2 | Lymphotactin ß, SCM-1ß | XCR1 | Atrae células que tienen el receptor XCR1 |
| Quimiocinas CX3C | ||||
| Nombre | Gen | Otros nombres | Receptor | Función[7] |
| CX3CL1 | Scyd1 | Fractalkine, Neurotactin, ABCD-3 | CX3CR1 | Participa en migración y adhesión leucocitaria; rol en metástasis |
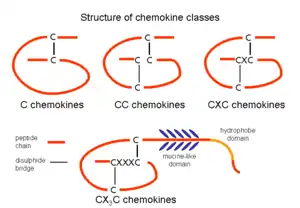
Las quimiocinas se dividen en cuatro familias: dos mayores con numerosas proteínas y dos menores con una o dos proteínas cada una. La nomenclatura se estandarizó el año 2000 basado en la secuencia de residuos de cisteína. Una de las familias mayores se caracteriza por la presencia de un aminoácido entre las dos primeras cisteínas, se denomina CXC o alfa. La otra familia mayor presenta las dos primeras cisteínas en forma adyacente y se denomina CC o beta. La proteína de la familia menor CX3C presenta tres aminoácidos entre las dos primeras cisteínas. Por último, la familia menor XC, tiene proteínas con un solo enlace disulfuro.[5]
La clasificación tiene un significado funcional, y las familias de quimiocinas se relacionan con sus respectivas familias de receptores, si bien esta relación no es uno a uno.[4]
Quimiocinas CC
La mayoría de las quimiocinas CC (o quimiocinas beta) están codificadas en la ubicación cromosómica 17q11-21.[4]
Las quimiocinas CC tienen dos cisteínas adyacentes, cerca de su extremo amino terminal. Se conocen al menos 27 miembros distintos dentro de este subgrupo que estén presentes en los mamíferos, llamados ligandos de quimiocinas CC (CCL) -1 a -28; CCL10 es lo mismo que CCL9.[8] Las quimiocinas de esta subfamilia contienen normalmente seis cisteínas (C6-CC quimiocinas). Las quimiocinas CC inducen la migración de monocitos y otros tipos celulares tales como células NK y células dendríticas.
Como ejemplo de quimiocina CC se encuentra la proteína quimioatrayente de monocitos 1 (MCP-1 o CCL2) que induce a los monocitos a liberar el torrente sanguíneo y entrar en el tejido circundante para convertirse en macrófagos tisulares.
Las CCL5(o RANTES) atraen células como por ejemplo las células T, eosinófilos y basófilos que expresan el receptor CCR5.
Quimiocinas CXC
La mayoría de las quimiocinas CXC (o quimiocinas alfa) están codificadas en la ubicación cromosómica 4q12-21.[4]
Las dos cisteínas N terminales de las quimiocinas CXC están separadas por un aminoácido, representado en este nombre con una X. Se han descubierto 17 quimiocinas CXC en mamíferos, que se subdividen en dos categorías, aquellos con una secuencia específica de aminoácidos (o motivo) de ácido glutámico-leucina-arginina (ELR ) inmediatamente antes de la primera cisteína del motivo CXC (ELR-positivo), y los que no tienen un motivo ELR (ELR-negativo). Las quimiocinas CXC ELR-positivas inducen específicamente la migración de neutrófilos, e interactúan con los receptores de quimiocina CXCR1 y CXCR2. Un ejemplo de quimiocina CXC ELR-positiva es la interleucina-8 (IL-8), la cual induce a los neutrófilos a viajar por el torrente sanguíneo y entrar al tejido circundante. Otras quimiocinas CXC que no tienen el motivo ELR, como la CXCL13, tienden a ser quimioatrayentes para los linfocitos. Las quimiocinas CXC se unen a los receptores de quimiocina CXC, de los cuales han sido descubiertos siete, y se designan CXCR1-7.
Quimiocinas C
El tercer grupo de quimiocinas es conocido como las C quimiocinas(o quimiocinas gamma), y es distinto de todas las demás quimiocinas en que solo presenta dos cisteínas. Se han descubierto dos quimiocinas que pertenezcan a este subgrupo, y se llaman XCL1 y XCL2. Estas quimiocinas atraen a los precursores de las células T al timo.
Quimiocinas CX3C
El cuarto grupo de quimiocinas, quimiocinas CX (o quimiocinas delta), presenta tres aminoácidos entre las dos cisteínas. La única que se ha descubierto hasta ahora ha sido la fractalquina(o CX3CL1). Es a la vez secretada y atada a la superficie de la célula que lo expresa, por lo que sirve tanto como un quimioatrayente como una molécula de adhesión.
Receptores
Los receptores de quimiocina están acoplados a receptores de proteínas g con siete dominios transmembrana que se encuentran en la superficie de los leucocitos. Se han descubierto diecinueve receptores de quimiocina distintos hasta ahora, que se dividen en cuatro familias dependiendo del tipo de quimiocina al que se unen; los receptores CXCR se unen a quimiocinas CXC, los receptores CCR se unen a quimiocinas CC, los CX3CR1 se unen a la única quimiocina CX3C (CX3CL1), y el receptor XCR1 se une a las dos quimiocinas XC (XCL1 y XCL2). Comparten muchas características estructurales: en primer lugar, son similares en tamaño (alrededor de 350 aminoácidos), tienen un extremo N terminal corto y ácido, siete dominios transmembrana helicoidales con tres bucles hidrofílicos intracelulares y tres bucles hidrofílicos extracelulares, y un extremo C terminal intracelular que contiene los residuos de serina y treonina, necesarios para la regulación. Los primeros dos bucles de receptores de quimiocina extracelulares tienen cada uno un residuo de cisteína protegido que permite la formación de un puente disulfuro entre estos dos bucles. Las proteínas G se acoplan al C terminal de los receptores de quimiocina para permitir la señalización intracelular después de la activación del receptor, mientras el dominio N terminal del receptor de quimiocina determina la especificidad de unión del ligando.[9]
Transducción de señales
Los receptores de quimiocina se asocian con proteínas G para transmitir señales de la célula tras la unión del ligando. La activación de las proteínas G por los receptores de quimiocinas causa la posterior activación de una enzima conocida como fosfolipasa C (PLC). La fosfolipasa C hidrolizará una molécula llamada fosfatidilinositol (4,5)-bisfosfato (PIP2) para formar moléculas que actúan como segundos mensajeros, conocidas por el nombre de Inositol trisfosfato (IP3) y diacilglicerol (DAG) que desencadenan los eventos de señalización intracelular; el DAG activa otra enzima llamada proteína quinasa C (PKC), y el IP3 provoca la liberación de calcio desde las reservas intracelulares. Estos procesos promueven varias cascadas de señalización (como por ejemplo la vía de la MAP quinasa) que genera respuestas tales como la quimiotaxis, degranulación, liberación de aniones de superóxido y cambios en la avidez de las moléculas de adhesión de las células(integrinas) dentro de la célula que alberga el receptor de quimiocina.[9]
Función

El papel más importante que desempeñan las quimiocinas es el de actuar como un quimioatrayente para guiar la migración celular. Las células que son atraídas por las quimiocinas siguen una señal de incremento de la concentración de quimiocinas hacia la fuente de la quimiocina. Algunas quimiocinas controlan a las células del sistema inmunitario durante procesos de vigilancia inmunitaria, como la dirección de los linfocitos hacia los nódulos linfáticos para que puedan detectar la invasión de los patógenos mediante la interacción con células presentadoras de antígenos que residen en estos tejidos. Estas quimiocinas son conocidas como quimiocinas homeostáticas y son producidas y secretadas sin ninguna necesidad de estimular sus células fuente. Algunas quimiocinas tienen un papel en el desarrollo: promueven la angiogénesis (crecimiento de nuevos vasos sanguíneos) o guían a células hacia tejidos que proporcionan señales críticas específicas para la maduración celular. Otras quimiocinas son inflamatorias y son liberadas por una gran variedad de células como respuesta a una infección bacteriana o a virus o agentes infecciosos que causan daño físico, que puede ser, por ejemplo la sílice o los cristales de urato que se producen en la gota. Su liberación es a menudo estimulada por citoquinas pro-inflamatorias tales como la interleucina 1. Las quimiocinas inflamatorias funcionan sobre todo como quimiotácticos para los leucocitos, reclutan monocitos, neutrófilos y otras células efectoras desde la sangre hasta lugares de infección o daño tisular. Algunas quimiocinas inflamatorias activan las células para iniciar una respuesta inmunitaria o promover la cicatrización de la herida. Son liberadas por muchos tipos de células distintas y sirven para guiar tanto células del sistema inmunitario innato como del sistema inmunitario adaptativo.
Control de la infección
El descubrimiento de que las quimiocinas β RANTES, MIP (proteínas inflamatorias de macrófagos) 1 α y 1 β (ahora conocidas como CCL5, CCL3 y CCL4 respectivamente) suprimen el VIH-1 proporcionaron la conexión inicial en indicaron que esas moléculas podrían controlar la infección como parte de la respuesta inmunitaria in vivo.[10] La asociación de la producción de quimiocina con las respuestas proliferativas inducidas por antígenos, el estado clínico más favorable en cuanto a la infección por VIH, así como un estado de no infección en sujetos con riesgo de infección sugiere un papel positivo de estas moléculas en el control del curso natural de la infección por VIH.[11]
Véase también
Referencias
- Lezama Asencio, Pedro (octubre de 2006). «Rol de quimiocinas y sus receptores en la inflamación». Rev. Med. Vallejiana (Lima, Perú: Universidad César Vallejo. Facultad de Medicina) 3 (2): 133-139. Consultado el 16 de febrero de 2017.
- Cano Londoño, Nancy Fanory; Montoya Guarín, Carlos Julio (marzo de 2001). «Las quimioquinas: citoquinas proinflamatorias y reguladoras del tráfico celular». Iatreia Revista Médica Universidad de Antioquia (Medellín, Colombia) 14 (1): 57-72. ISSN 2011-7965. Consultado el 16 de febrero de 2017.
- Comerford, Iain; McColl, Shaun R (febrero de 2011). «Mini-review series: focus on chemokines» [Serie de mini-revisiones: foco en quimiocinas]. Immunology and Cell Biology (en inglés) (Australia: Australasian Society for Immunology) 89 (2): 183-184. ISSN 0818-9641. doi:10.1038/icb.2010.164. Consultado el 18 de febrero de 2017.
- Ransohoff, Richard M (octubre de 2009). «Chemokines and Chemokine Receptors: Standing at the Crossroads of Immunobiology and Neurobiology» [Quimiocinas y receptores de quimiocinas: posicionándose en el cruce de la inmunología y la neurobiología]. Immunity (en inglés) (Estados Unidos: Elsevier) 31 (5): 711-721. ISSN 1074-7613. doi:10.1016/j.immuni.2009.09.010. Consultado el 18 de febrero de 2017.
- Lolis, Elias; Murphy, James W (2007). «The Structural Biology of Chemokines» [La biología estructural de las quimiocinas]. En Harrison, Jeffrey K; Lukacs, Nicholas W, eds. The Chemokine Receptors [Los receptores de quimiocinas] (en inglés) (1 edición). Nueva Jersey, Estados Unidos: Humana Press. pp. 9-30. ISBN 9781588297730. doi:10.1007/978-1-59745-020-1. Consultado el 18 de febrero de 2017.
- Fernandez E, Lolis E (2002). «Structure, function, and inhibition of chemokines». Annu Rev Pharmacol Toxicol 42: 469-99. PMID 11807180. doi:10.1146/annurev.pharmtox.42.091901.115838.
- «Chemokines and their receptors» [Qumiocinas y sus receptores] (en inglés). 2009. Consultado el 19 de febrero de 2017.
- Laing K, Secombes C (2004). «Chemokines». Dev Comp Immunol 28 (5): 443-60. PMID 15062643. doi:10.1016/j.dci.2003.09.006.
- Craig Murdoch and Adam Finn (2000). «Chemokine receptors and the role in inflammation and infectious disease». Journal of the American Society of Hematology 95 (10): 3032-3043.
- Cocchi F, DeVico AL, Garzino-Demo A, Arya SK, Gallo RC, and Lusso P (octubre de 1995). «Identification of RANTES, MIP-1a, and MIP-1b as the major HIV-suppressive factor produced by CD8+ T cells». Science 270: 1811-1815. PMID 8525373. doi:10.1126/science.270.5243.1811.
- Alfredo Garzino-Demo, Ronald B. Moss, Joseph B. Margolick, Farley Cleghorn, Anne Sill, William A. Blattner, Fiorenza Cocchi, Dennis J. Carlo, Anthony L. DeVico, and Robert C. Gallo (octubre de 1999). «Spontaneous and antigen-induced production of HIV-inhibitory β-chemokines are associated with AIDS-free status». Proc Natl Acad Sci USA 96 (21): 11986-11991. PMID 10518563. doi:10.1073/pnas.96.21.11986.
Enlaces externos
- List of chemokines and their receptors at nlm.nih.gov
- The cytokine family database - Chemokines at kumamoto-u.ac.jp
- The correct chemokine nomenclature at rndsystems.com