Proteína
Las proteínas (del griego antiguo: πρωτεῖος [prōteîos] ‘fundamental, principal’)[1] o prótidos[2] son macromoléculas formadas por cadenas lineales de aminoácidos. Las proteínas están formadas por aminoácidos y esta secuencia está determinada por la secuencia de nucleótidos de su gen correspondiente (llamados genes estructurales). La información genética determina qué proteínas tiene una célula, un tejido y un organismo.[3][4]

La síntesis de las proteínas se presenta a través de la traducción ribosomal, es decir que está a cargo de los ribosomas y guiada por la información de una molécula de ARNm que actúa como molde.[5]
Muchas proteínas están compuestas por una sola cadena polipeptídica, por lo que se les llama proteínas monoméricas. Por otro lado, las proteínas oligoméricas presentan más de una cadena, que puede ser una copia adicional de la misma o una cadena diferente, y a cada cadena polipeptídica se le llama subunidad. Las proteínas oligoméricas presentan estructura cuaternaria. La mioglobina es un ejemplo de proteína monomérica y la hemoglobina de proteína oligomérica.
Las proteínas pueden presentar adicionalmente una molécula orgánica o bien uno o más iones[6] para ser completamente funcionales, como es el caso de la mayoría de enzimas. Los grupos prostéticos son estos componentes orgánicos no proteicos que están unidos fuertemente a la proteína y que hacen posibles sus funciones. Por otro lado, los iones unidos a las proteínas son cofactores.
Son biomoléculas muy diversas y son esenciales para la vida. La mayoría de proteínas desempeñan más de una función (ver más adelante).
Son polímeros constituidas por 3 unidades estructurales llamados aminoácidos.[7] Las proteínas son necesarias para la vida, sobre todo por su función plástica (constituyen el 80 % del protoplasma deshidratado de toda célula), pero también por sus funciones biorreguladoras (forman parte de las enzimas) y de defensa (los anticuerpos son proteínas).[8] Por este motivo el crecimiento, la reparación y el mantenimiento del organismo dependen de ellas.[9] Representan alrededor del 50 % del peso seco de los tejidos.[10]
Se clasifican de acuerdo a diversos criterios de forma general, localización, función, composición o elementos estructurales. A la fecha no existe un sistema único de clasificación.
La localización espacial y temporal de las proteínas depende de la regulación de la expresión genética. Por lo tanto, son susceptibles a señales o factores externos. El conjunto de las proteínas expresadas en una circunstancia determinada es denominado proteoma
Muchos organismos presentan otras biomoléculas formadas por aminoácidos[11], pero cuya biosíntesis no depende del ribosoma, tal es el caso de algunos péptidos antimicrobianos de síntesis no ribosomal, los péptidos que entrelazan a los polisacáridos en la peptidoglicana (pared celular bacteriana) y las toxinas de diversos organismos, como las microcistinas.
Las moléculas proteicas abarcan una diversidad extraordinaria : presentes en enzimas, hormonas, proteínas de almacenamiento como los huevos de las aves y las de las semillas, proteínas de transporte como la hemoglobina, proteínas de contráctiles como las de los músculos, inmunoglobulinas (anticuerpos), proteínas de membranas y muchos otros tipos de proteínas estructurales. En relación con sus funciones la diversidad es abrumadora, pero en cuanto a su estructura, todas siguen un mismo plan general muy sencillo porque todas son polímeros de aminoácidos dispuestas en secuencias lineales.[12]
Bioquímica
Los prótidos o proteínas son biopolímeros formados por un gran número de unidades estructurales simples denominadas aminoácidos, unidas por enlaces peptídicos. La formación de cada enlace peptídico ocurre por una reacción de condensación, entre el grupo carboxilo (-COOH) y el grupo amino (-NH2) de aminoácido subsecuentes, acompañado de la liberación de una molécula de agua, motivo por el cual se habla de residuos de aminoácidos.[13]
Los aminoácidos que se incorporan durante la traducción son los estereoisómeros L-α-aminoácidos. La mayoría de organismos estudiados tiene proteínas formadas por combinaciones de 20 aminoácidos, que están especificados en el código genético estándar. También se pueden encontrar en varias proteínas distintos aminoácidos modificados, como la 4-hidroxiprolina, 5-hidroxilisina, 6-N-metil-lisina, desmosina, γ-carboxiglutamato y la desmosina.[14] Muchos otros organismos presentan codones modificados para la incorporación de selenocisteína o de pirrolisina.
Debido a su gran tamaño, cuando estas moléculas se dispersan en un disolvente adecuado, forman siempre dispersiones coloidales, con características que las diferencian de las disoluciones de moléculas más pequeñas. Muchas proteínas presentan carga neta en ciertos rangos de pH del medio. Por ello pueden considerarse ionómeros.
Por hidrólisis, las moléculas de proteína se dividen en numerosos compuestos relativamente simples, de masa molecular pequeña, que son las unidades fundamentales constituyentes de la macromolécula. Estas unidades son los aminoácidos, de los cuales existen veinte especies diferentes y que se unen entre sí mediante enlaces peptídicos. Desde decenas a miles aminoácidos pueden participar en la formación de la gran molécula polimérica de una proteína.
Todas las proteínas tienen carbono, hidrógeno, oxígeno y nitrógeno, y casi todas poseen también azufre. Si bien hay ligeras variaciones en diferentes proteínas, el contenido de nitrógeno representa, por término medio, 16 % de la masa total de la molécula; es decir, cada 6,25 g de proteína contienen 1 g de N. El factor 6,25 se utiliza para estimar la cantidad de proteína existente en una muestra a partir de la medición de N de la misma.[15]
La síntesis proteica es un proceso complejo cumplido por las células[16] según las directrices de la información suministrada por los genes. La secuencia de aminoácidos en una proteína está codificada en su gen (una porción de ADN) mediante el código genético. Los residuos en una proteína sufren a veces modificaciones químicas por modificación postraduccional. Dichas modificaciones ocurren antes de que la proteína sea funcional en la célula o como parte de mecanismos de control. Las proteínas también pueden trabajar juntas para cumplir una función particular, a menudo asociándose para formar complejos proteicos estables. Las proteínas se ensamblan de diversas formas, lo que les permite participar como los principales componentes estructurales de las células y los tejidos.
Por sus propiedades fisicoquímicas, las proteínas se pueden clasificar en proteínas simples (holoproteidos), formadas solo por aminoácidos o sus derivados; o proteínas conjugadas (heteroproteidos), formadas por aminoácidos acompañados de sustancias diversas, y proteínas derivadas, sustancias formadas por desnaturalización y desdoblamiento de las anteriores.
Síntesis
Biosíntesis
Las proteínas se ensamblan a partir de sus aminoácidos utilizando la información codificada en los genes. Cada proteína tiene su propia secuencia de aminoácidos que está especificada por la secuencia de nucleótidos del gen que la codifica. El código genético está formado por un conjunto de tri-nucleótidos denominados codones. Cada codón (combinación de tres nucleótidos) designa un aminoácido, por ejemplo AUG (adenina-uracilo-guanina) es el código para la metionina. Como el ADN contiene cuatro nucleótidos distintos, el número total de codones posibles es 64; por lo tanto, existe cierta redundancia en el código genético, estando algunos aminoácidos codificados por más de un codón. Los genes codificados en el ADN se transcriben primero en ARN pre-mensajero mediante proteínas como la ARN polimerasa. La mayor parte de los organismos procesan entonces este pre-ARNm (también conocido como tránscrito primario) utilizando varias formas de modificación post-transcripcional para formar ARNm maduros, que se utilizan como molde para la síntesis de proteínas en el ribosoma. En los procariotas el ARNm puede utilizarse tan pronto como se produce, o puede unirse al ribosoma después de haberse alejado del nucleoide. Por el contrario, los eucariotas sintetizan el ARNm en el núcleo celular y lo translocan a través de la envoltura nuclear hasta el citoplasma donde se realiza la síntesis proteica. La tasa de síntesis proteica es mayor en procariotas que en eucariotas y puede alcanzar los 20 aminoácidos por segundo.[17]
El proceso de sintetizar una proteína a partir de un molde de ARNm se denomina traducción. El ARNm se carga en el ribosoma y se lee, tres nucleótidos cada vez, emparejando cada codón con su anticodón complementario localizado en una molécula de ARN de transferencia que lleva el aminoácido correspondiente al codón que reconoce. La enzima aminoacil ARNt sintetasa "carga" las moléculas de ARN de transferencia (ARNt) con los aminoácidos correctos. El polipéptido creciente se denomina cadena naciente. Las proteínas se biosintetizan siempre del extremo N-terminal al extremo C-terminal.
De esta forma, se consigue la estructura primaria de la proteína, es decir, su secuencia de aminoácidos. Ahora ésta debe plegarse de la forma adecuada para llegar a su estructura nativa, la que desempeña la función. Anfinsen en sus trabajos con la ribonucleasa A, postuló su hipótesis que dice que toda la información necesaria para el plegamiento se encuentra contenida enteramente en la estructura primaria.[18] Esto dio pie a que en 1969 Levinthal sugiriese la existencia de una paradoja a la que se conoce como la paradoja de Levinthal: si una proteína se pliega explorando al azar todas las conformaciones posibles necesitaría un tiempo mayor que la edad del propio Universo. Dado que las proteínas se pliegan en un tiempo razonable y de forma espóntanea, se ha resuelto esta paradoja indicando que las proteínas no prueban todas las conformaciones posibles, sino que eligen una vía de plegamiento específica con un número de pasos finitos, es decir, se reduce el hiperespacio potencial de plegamiento. También cabe mencionar la existencia de chaperonas moleculares, proteínas que ayudan a otras a plegarse con gasto energético (ATP).[19]
El tamaño de la proteína sintetizada puede medirse por el número de aminoácidos que contiene y por su masa molecular total, que normalmente se expresa en daltons (Da) (sinónimo de unidad de masa atómica), o su unidad derivada kilodalton (kDa). Por ejemplo, las proteínas de la levadura tienen en promedio 466 aminoácidos y una masa de 53 kDa. Las proteínas más largas que se conocen son las titinas, un componente del sarcómero muscular, con una masa molecular de casi 3000 kDa y una longitud total de casi 27 000 aminoácidos.[20]
Síntesis química
Mediante una familia de métodos denominados de síntesis peptídica es posible sintentizar químicamente proteínas pequeñas. Estos métodos dependen de técnicas de síntesis orgánica como la ligación para producir péptidos en gran cantidad.[21] La síntesis química permite introducir aminoácidos no naturales en la cadena polipeptídica, como por ejemplo aminoácidos con sondas fluorescentes ligadas a sus cadenas laterales.[22] Estos métodos son útiles en laboratorios de bioquímica y biología celular, pero no tanto para aplicaciones comerciales. La síntesis química es ineficiente para polipéptidos de más de 300 aminoácidos, y las proteínas sintetizadas puede que no adopten fácilmente su estructura tridimensional nativa. La mayor parte de los métodos de síntesis química proceden del extremo C-terminal al extremo N-terminal, en dirección contraria por tanto a la reacción biológica.[23]
Degradación de las proteínas
Al igual que la síntesis de las proteínas, su degradación es un proceso complejo y regulado con cuidado. la conjugación de las proteínas con el polipéptido de 74 aminoácidos ubiquitina las marca para su degradación. Este polipéptido se ha conservado mucho a lo largo de la evolución y está presente en especies que van de desde las bacterias hasta los seres humanos. Se ha sostenido que es esencial un grupo NH2- libre terminal para unirse a la ubiquitina, pero la conformación causante del proceso es, en la actualidad, un tema de debate y de activa investigación.[24]
Funciones
Todas las proteínas realizan elementales funciones para la vida celular, pero hay proteínas que tienen más de una actividad. Entre las distintas funciones se conocen las siguientes:
- Catálisis: Las enzimas proteicas que se encargan de realizar reacciones químicas de una manera más rápida y eficiente. Procesos que resultan de suma importancia para el organismo. Por ejemplo la pepsina, esta enzima se encuentra en el sistema digestivo y se encarga de degradar los alimentos.
- Reguladoras: Las hormonas proteicas ayudan a mantener la homeostasis en el cuerpo. Tal es el caso de la insulina que se encarga de regular la glucosa que se encuentra en la sangre.
- Estructural: Muchas proteínas determinan la forma o el soporte en las células y los tejidos, ya que forman cables o rieles para dirigir el movimiento y se forman por el ensamble de subunidades.[26] Este es el caso de la tubulina que se encuentra en el citoesqueleto. También otras proteínas tienen la función de dar resistencia y elasticidad que permite formar tejidos así como la de dar soporte a otras estructuras. Por ejemplo, la colágena es el principal componente de la matriz extracelular del tejido conectivo.
- Defensiva: Son las encargadas de defender el organismo. Las inmunoglobulinas son glicoproteínas que defienden al organismo contra cuerpos extraños. Otros ejemplos son la queratina que protege la piel, así como el fibrinógeno y protrombina que forman coágulos.
- Transporte: La función de estas proteínas es llevar sustancias a través del organismo a donde sean requeridas. Por ejemplo, la hemoglobina lleva el oxígeno por medio de la sangre. Otras proteínas permiten o impulsan el paso solutos a través de las membranas celulares. En esta segunda categoría se encuentran los translocadores, permeasas, canales iónicos y poros membranales.
- Receptoras: Este tipo de proteínas se encuentran en la membrana celular y llevan a cabo la función de recibir señales para que la célula pueda realizar su función, como el receptor de acetilcolina que recibe señales para producir la contracción muscular.
- Proteínas motoras. Estas proteínas actúan como motores de escala nanométrica que mueven a otros componentes celulares. Por ejemplo, en las fibras musculares la actina compone a los microfilamentos de las células y la miosina activa el movimiento durante la contracción muscular.
- Funciones de reserva y almacenamiento. Son materia prima como fuente de carbono y de energía química en diferentes organismos. Ejemplos: la ovoalbúmina en el huevo, o la caseína de la leche. La ferritina forma una estructura hueca donde se almacena hierro.
- Prácticamente todos los procesos biológicos dependen de la presencia o la actividad de este tipo de moléculas. Muchas proteínas que se encuentran en el citoplasma colaboran además en el mantenimiento del pH, ya que actúan como un tampón químico.
Estructura

Es la manera como se organiza una proteína para adquirir cierta forma, presentan una disposición característica en condiciones fisiológicas, pero si se cambian estas condiciones como temperatura o pH pierde la conformación y su función, proceso denominado desnaturalización. La función depende de la conformación y ésta viene determinada por la secuencia de aminoácidos en un medio determinado. Una hipótesis propone que solamente una conformación es funcional termodinámicamente.
Y es esa manera de organización que tiene cada proteína la que definirá sus propiedades biológicas tales como las inmunológicas, enzimáticas u hormonales. Si ocurre una modificación o pérdida de esa confomación "nativa" se sucederán cambios en su entorno y por lo tanto cambios en sus propiedades.[27]
Para el estudio de la estructura es frecuente considerar una división en cuatro niveles de organización, aunque el cuarto no siempre está presente.
Niveles estructurales
Para describir una proteína:[28]
- Estructura primaria, es la secuencia de aminoácidos de una cadena polipeptídica.
- Estructura secundaria, son patrones locales de plegamiento que presentan ciertas secuencias de la proteína.
- Estructura terciaria, es la conformación plegada tridimensional de una cadena polipeptídica.
- Estructura cuaternaria, es la organización de una proteína oligomérica o ensamble de proteínas.
Las proteínas adquieren su estructura instantáneamente, no pasan por cada una de las estructuras.
En la forma tridimensional de una proteína globular, podemos identificar los siguientes elementos de la estructura secundaria de las proteínas:
Giros
Están compuestos por tres o cuatro aminoácidos, son giros se encuentran en la superficie de una proteína, formando curvas cerradas que redirigen el esqueleto del polipéptido de vuelta hacia el interior, glicina y prolina son comúnmente presentes en los giros, son estructuras definidas.[29]
Bucles
Pueden presentar diferentes formas, estos son partes del esqueleto polipeptídico, son curvas más largas que los giros.[29]
Motivos
Son combinaciones particulares de estructura secundaria, se acumulan en la estructura terciaria de una proteína. En algunos casos, los motivos son para una función específica asociada, los tres principales motivos[29] son:
- Hélice-giro-hélice: caracteriza a la familia de factores transcripcionales.
- Dedo de cinc: encontrado en proteínas que enlazan ARN o ADN.
- Hélice superenrollada: presente en proteínas fibrosas.
Dominios
Son parte de la estructura terciaria de las proteínas, es una región compacta plegada del polipéptido, que no dependen de otras partes de la proteína para mantener su estabilidad. Pueden ser diferentes combinaciones de motivos, por ejemplo, la membrana viral presenta dos tipos de dominios, un dominio globular y un dominio fibroso.
Propiedades de las proteínas
Cinco son las propiedades principales que permiten la existencia y aseguran la función de las proteínas:
- Amortiguador de pH (conocido como efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos (donando electrones) o como bases (aceptando electrones).
- Capacidad electrolítica: Se determina a través de la electroforesis, técnica analítica en la cual si las proteínas se trasladan al polo positivo es porque su molécula tiene carga negativa y viceversa.
- Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
- Estabilidad: La proteína debe ser estable en el medio donde desempeñe su función. Para ello, la mayoría de proteínas acuosas crean un núcleo hidrofóbico empaquetado. Está relacionado con su vida media y el recambio proteico.
- Solubilidad: Es necesario solvatar la proteína, lo cual se consigue exponiendo residuos de similar grado de polaridad al medio en la superficie proteica. Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH se pierde la solubilidad.
Estas propiedades son el resultado de tres actividades principales que presentan distintas proteínas:[26]
- se unen a otras biomoléculas, incluyendo otras proteínas
- catalizan reacciones químicas
- se pliegan para formar un canal o un poro.
Desnaturalización
El cumplimiento de su función por parte de una proteína depende del mantenimiento de una conformación adecuada, lo cual, a su vez, exige que sus estructuras (primaria, secundaria, terciaria y cuaternaria) no sufran alteraciones. La desorganización en la estructura molecular lleva a la pérdida de las propiedades y funciones naturales la proteína. Por eso se llama a este proceso desnaturalización.[30]
Cuando las proteínas pierden su función y estructura por cambios repentinos y drásticos en las condiciones del medio, se dice que se desnaturalizaron. Las enzimas pierden sus propiedades catalíticas, ya sea por la pérdida de la estructura en el sitio activo o de la coenzima. Esta variación de la conformación se denomina desnaturalización. La desnaturalización no afecta a los enlaces peptídicos: al volver a las condiciones normales, puede darse el caso de que la proteína recupere la conformación primitiva, lo que se denomina renaturalización.
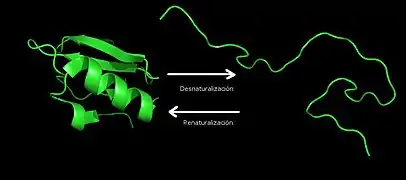
Los cambios que provocan la desnaturalización pueden ser variaciones bruscas de temperatura, pH, fuerza iónica, presión osmótica o presión hidrostática o la adición de solventes orgánicos (por ej. acetona, hexanos, tolueno). A estos factores que provocan la desnaturalización se les llama agentes desnaturalizantes.
En las proteínas globulares se asume que la conformación nativa de una proteína es la estructura funcional, la cual consiste en una forma compacta, con los residuos hidrofóbicos localizados en el interior de su estructura y con los residuos polares o cargados expuestos en la superficie de la proteína. Pero la conformación desnaturalizada es aquella en la que están expuestos estos residuos hidrofóbicos. Ambas conformaciones, nativa y desnaturalizada, corresponden a estructuras de mínima energía, ya que las interacciones entre las distintas partes de la proteína y el solvente se encuentran estabilizadas.[31] En muchas ocasiones, las proteínas desnaturalizadas forman agregados inespecíficos y se precipitan. De este modo, la capa de moléculas de agua no recubre completamente a las moléculas proteicas, las cuales tienden a unirse entre sí dando lugar a grandes partículas que precipitan.
Los agentes desnaturalizantes mencionados arriba, desestabilizan a las proteínas y provocan que pierdan su plegamiento, o lo que es lo mismo, vuelven al estado desnaturalizado más favorable en comparación con el estado plegado compacto. Los distintos destaturalizantes actúan por mecanismos diferentes, pero es probable que muchos (como los disolventes orgánicos, sales, ácidos y bases) actúen por medio de uniones favorables con la columna vertebral de enlaces peptídicos. De esta manera estabilizan a la forma desnaturalizada, ya que presenta un mayor número de estos enlaces.[31] Algunos de estos agentes desnaturalizantes provocan el rompimiento de enlaces covalentes cuando están en concentraciones muy elevadas (por ej., hidrólisis ácida de los enlaces peptídicos), y en estas circunstancias es imposible la recuperación de la conformación nativa.
Bajo condiciones controladas, se puede provocar la desnaturalización suave o lenta de las proteínas y después aplicar un método inverso para la renaturalización de las proteínas de la muestra. Esto solamente es posible con algunas proteínas, como la ribonucleasa A (RNasa A, ver experimento de Anfinsen).
Ejemplos de desnaturalización son la leche cortada como consecuencia de la desnaturalización de la caseína, la precipitación de la clara de huevo al desnaturalizarse la ovoalbúmina por efecto del calor o la fijación de un peinado del cabello por efecto de calor sobre las queratinas del pelo.[32]
Determinación de la estabilidad proteínica
La determinación de la estabilidad proteínica puede realizarse con diversas técnicas. La única de ellas que mide directamente los parámetros energéticos es la calorimetría (normalmente en la modalidad de calorimetría diferencial de barrido). En ésta se mide la cantidad de calor que absorbe una disolución de proteína cuando es calentada, de modo que al aumentar la temperatura se produce una transición entre el estado nativo y el estado desnaturalizado que lleva asociada la absorción de una gran cantidad de calor.
El resto de técnicas miden propiedades de las proteínas que son distintas en el estado nativo y en el estado desplegado. Entre ellas se pueden citar la fluorescencia de triptófanos y tirosinas, el dicroísmo circular, radio hidrodinámico, espectroscopia infrarroja y la resonancia magnética nuclear. Una vez hemos elegido la propiedad que vamos a medir para seguir la desnaturalización de la proteína, podemos distinguir dos modalidades: Aquellas que usan como agente desnaturalizante el incremento de temperatura y aquellas que hacen uso de agentes químicos (como urea, cloruro de guanidinio, tiocianato de guanidinio, alcoholes, etc.). Estas últimas relacionan la concentración del agente utilizado con la energía necesaria para la desnaturalización. Una de las técnicas que han emergido en el estudio de las proteínas es la microscopía de fuerza atómica, esta técnica es cualitativamente distinta de las demás, puesto que no trabaja con sistemas macroscópicos, sino con moléculas individuales. Mide la estabilidad de la proteína a través del trabajo necesario para desnaturalizarla cuando se aplica una fuerza por un extremo mientras se mantiene el otro extremo fijo a una superficie.
La importancia del estudio de la estabilidad proteica está en sus implicaciones biomédicas y biotecnológicas. Así, enfermedades como el Alzheimer o el Parkinson están relacionadas con la formación de amiloides (polímeros de proteínas desnaturalizadas). El tratamiento eficaz de estas enfermedades podría encontrarse en el desarrollo de fármacos que desestabilizaran las formas amiloidogénicas o bien que estabilizaran las formas nativas. Por otro lado, cada vez más proteínas van siendo utilizadas como fármacos. Resulta obvio que los fármacos deben presentar una estabilidad que les dé un alto tiempo de vida cuando están almacenados y un tiempo de vida limitado cuando están realizando su acción en el cuerpo humano.
Su uso en las aplicaciones biotecnológicas se dificulta debido a que pese a su extrema eficacia catalítica presentan una baja estabilidad, ya que muchas proteínas de potencial interés apenas mantienen su configuración nativa y funcional por unas horas.
Clasificación
Se pueden aplicar distintos criterios para clasificar a las proteínas y no existe un sistema universal de clasificación. Se ofrecen los que se citan con más frecuencia.
Según su forma
- Fibrosas: presentan cadenas polipeptídicas largas y una estructura secundaria en la cual predomina un tipo de estructura secundaria: hélice alfa u hoja beta. Tienen secuencias repetitivas de residuos. Usualmente tienen función estructural. Se asocian en forma paralela y con frecuencia las cadenas vecinas están entrecruzadas con enlaces covalentes (disulfuro o de otro tipo).[33] Son insolubles en agua y en disoluciones acuosas. Algunos ejemplos de éstas son queratina, colágeno y fibrina.
- Globulares: se caracterizan por doblar sus cadenas en una forma esférica apretada o compacta dejando grupos hidrófobos hacia adentro de la proteína y grupos hidrófilos hacia afuera, lo que hace que sean solubles en disolventes polares como el agua. Presentan elementos diversos de estructura secundaria en una misma cadena polipeptídica (hélices alfa, hojas beta, giros, vueltas, regiones intrínsecamente desordenadas). Las hojas beta comúnmente están enrolladas o envueltas.[33] La mayoría de las enzimas, anticuerpos, algunas hormonas y proteínas de transporte, son ejemplos de proteínas globulares.
- Mixtas: posee una parte fibrilar (comúnmente en el centro de la proteína) y otra parte globular (en los extremos).
Según su solubilidad:[26]
- Proteínas globulares (ver arriba)
 Proteína Globular
Proteína Globular - Proteínas fibrosas (ver arriba)
- Proteínas integrales de membrana (o proteínas transmembranales): presentan secuencias de residuos hidrofóbicos, que usualmente adoptan conformaciones de hélice alfa o hebras beta afines a la parte hidrofóbica de las membranas celulares. Siguen mecanismos de plegamiento distintos a las de las proteínas citoplásmicas.
- Proteínas intrínsecamente desordenadas. Tienen una estructura flexible que cambia en función de sus interacciones con el disolvente o con otras moléculas que actúan como ligandos. Usualmente tienen una composición rica en residuos cargados (lisina, arginina, glutamato, aspartato e histidina) y se les encuentra con mayor frecuencia en células eucariontes que en procariontes. Muchas proteínas presentan dominios intrínsecamente desordenados (como p53), pero otras carecen completamente de estructura rígida (por ej., las proteínas ribosomales o del spliceosoma).[34]
Según su composición química
Las proteínas según su composición química pueden ser clasificadas en:
- Proteínas simples u holoproteínas: en su hidrólisis solo produce aminoácidos. Ejemplos de estas son la insulina y el colágeno (globulares y fibrosas), albúminas.Proteína simple
- Proteínas conjugadas o heteroproteína: estas proteínas contienen cadenas polipeptídicas y un grupo prostético. La porción no aminoacídica se denomina grupo prostético, estos pueden ser un ácido nucleico, un lípido, un azúcar o ion inorgánico. Ejemplo de estas son la mioglobina y los citocromo. Las proteínas conjugados o heteroproteínas se clasifican de acuerdo a la naturaleza de su grupo prostético:
- Nucleoproteínas: Su grupo prostético son los ácidos nucleicos.
- Lipoproteínas: Su grupo prostético son los fosfolípidos, colesterol y triglicéridos.
- Metaloproteínas: El grupo prostético está formado por metales.
- Cromoproteínas: Son proteínas conjugadas por un grupo cromóforo (sustancia coloreada que contiene un metal).
- Glucoproteínas: El grupo prostético está formado por los carbohidratos.[35]
- Fosfoproteínas: Son proteínas conjugadas con un radical que contiene fosfato, distinto de un ácido nucleico o de un fosfolípido.
Nutrición
Fuentes de proteínas
Las fuentes dietéticas de proteínas incluyen carne, huevos, legumbres, frutos secos, cereales, verduras y productos lácteos tales como queso o yogur. Tanto las fuentes proteínas animales como los vegetales poseen los 20 aminoácidos necesarios para la alimentación humana.
Calidad proteica
Las diferentes proteínas tienen diferentes niveles de familia biológica para el cuerpo humano. Muchos índices han sido definidos para medir la tasa de utilización y retención de proteínas en humanos. Estos incluyen valor biológico, NPU (Net Protein Utilization), NPR (Cociente Proteico Neto) y PDCAAS (Protein Digestibility Corrected Amino Acids Score), la cual fue desarrollado por la FDA mejorando el PER (Protein Efficiency Ratio). Estos métodos examinan qué proteínas son más eficientemente usadas por el organismo.
Reacciones de reconocimiento
El reactivo de Biuret está formado por una disolución de sulfato de cobre en medio alcalino, este reconoce el enlace peptídico de las proteínas mediante la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógeno que forma parte de los enlaces peptídicos, lo que produce una coloración rojo-violeta.
- Reacción de los aminoácidos azufrados
Se pone de manifiesto por la formación de un precipitado negruzco de sulfuro de plomo. Se basa esta reacción en la separación mediante un álcali, del azufre de los aminoácidos, el cual al reaccionar con una solución de acetato de plomo, forma el sulfuro de plomo.
- Reacción de Millon
Reconoce residuos fenólicos, o sea aquellas proteínas que contengan tirosina. Las proteínas se precipitan por acción de los ácidos inorgánicos fuertes del reactivo, dando un precipitado blanco que se vuelve gradualmente rojo al calentar.
Reconoce grupos aromáticos, o sea aquellas proteínas que contengan tirosina o fenilalanina, con las cuales el ácido nítrico forma compuestos nitrados amarillos
Requerimientos proteínicos de la dieta por edad y sexo
| Edad
(años) |
Peso
(kg) |
Proteínas
(g/día) | |
|---|---|---|---|
| Lactantes | 0-0.5
0.5 |
6
9 |
13
14 |
| Niños | 1-3
4-6 7-10 |
13
20 28 |
16
24 28 |
| Hombres | 11-14
15-18 19-24 25-50 más de 50 |
45
66 72 79 77 |
45
59 58 63 63 |
| Mujeres | 11-14
15-18 19-24 25- 50 más de 50 |
46
55 58 63 65 |
46
44 46 50 50 |
- Food and Nutrition Board, National Academy of Science/National Research Council 1989
Deficiencia de proteínas
Deficiencia de proteínas en países en vías de desarrollo
La deficiencia de proteína es una causa importante de enfermedad y muerte en países en vías de desarrollo. La deficiencia de proteína juega una parte en la enfermedad conocida como kwashiorkor. La guerra, la hambruna, la sobrepoblación y otros factores incrementaron la tasa de malnutrición y deficiencia de proteínas. La deficiencia de proteína puede conducir a una inteligencia reducida o retardo mental.
La malnutrición proteico calórica afecta a 500 millones de personas y más de 10 millones anualmente.[cita requerida] En casos severos el número de células blancas disminuye, de la misma manera se ve reducida drásticamente la habilidad de los leucocitos de combatir una infección.
Deficiencia de proteínas en países desarrollados
La deficiencia de proteínas es rara en países desarrollados, pero un pequeño número de personas tiene dificultad para obtener suficiente proteína debido a la pobreza. La deficiencia de proteína también puede ocurrir en países desarrollados en personas que están haciendo dieta para perder peso, o en adultos mayores quienes pueden tener una dieta pobre. Las personas convalecientes, recuperándose de cirugía, trauma o enfermedades pueden tener déficit proteico si no incrementan su consumo para soportar el incremento en sus necesidades. Una deficiencia también puede ocurrir si la proteína consumida por una persona está incompleta y falla en proveer todos los aminoácidos esenciales.
Exceso de consumo de proteínas
Como el organismo es incapaz de almacenar las proteínas, el exceso de proteínas es digerido y convertido en azúcares o ácidos grasos. El hígado retira el nitrógeno de los aminoácidos, una manera de que estos pueden ser consumidos como combustible, y el nitrógeno es incorporado en la urea, la sustancia que es excretada por los riñones. Estos órganos normalmente pueden lidiar con cualquier sobrecarga adicional, pero si existe enfermedad renal, una disminución en la proteína frecuentemente será prescrita.
El exceso en el consumo de proteínas también puede causar la pérdida de calcio corporal, lo cual puede conducir a pérdida de masa ósea a largo plazo. Sin embargo, varios suplementos proteicos vienen suplementados con diferentes cantidades de calcio por ración, de manera que pueden contrarrestar el efecto de la pérdida de calcio.
Algunos médicos sospechan[¿quién?] que el consumo excesivo de proteínas está ligado a varios problemas:
- Disfunción hepática debido a incremento de residuos tóxicos.
- Hiperactividad del sistema inmune.
- Pérdida de densidad ósea; la fragilidad de los huesos se debe a que el calcio y la glutamina se filtran de los huesos y el tejido muscular para balancear el incremento en la ingesta de ácidos a partir de la dieta. Este efecto no está presente si el consumo de minerales alcalinos (a partir de frutas y vegetales [los cereales son ácidos como las proteínas; las grasas son neutrales]) es alto.
En tales casos, el consumo de proteínas es anabólico para el hueso. Algunos investigadores[¿quién?] piensan que un consumo excesivo de proteínas produce un incremento forzado en la excreción del calcio. Si hay consumo excesivo de proteínas, se piensa que un consumo regular de calcio sería capaz de estabilizar, o inclusive incrementar, la captación de calcio por el intestino delgado,[cita requerida] lo cual sería más beneficioso en mujeres mayores.[cita requerida]
Las proteínas son frecuentemente causa de alergias y reacciones alérgicas a ciertos alimentos. Esto ocurre porque la estructura de cada forma de proteína es ligeramente diferente. Algunas pueden desencadenar una respuesta a partir del sistema inmune, mientras que otras permanecen perfectamente seguras. Muchas personas son alérgicas a la caseína (la proteína en la leche), al gluten (la proteína en el trigo y otros granos), a la proteína particular encontrada en el maní o aquellas encontradas en mariscos y otras comidas marinas.
Es extremadamente inusual que una misma persona reaccione adversamente a más de dos tipos diferentes de proteínas, debido a la diversidad entre los tipos de proteínas o aminoácidos. Aparte de eso, las proteínas ayudan a la formación de la masa muscular.
Análisis de proteínas en alimentos
Las proteínas en los alimentos, es un parámetro de importancia desde el punto de vista económico y de la calidad y cualidades organolépticas y nutricionales. Debido a ello su medición está incluida dentro del Análisis Químico Proximal de los alimentos (en el cual se mide principalmente el contenido de humedad, grasa, proteína y cenizas).[37]
El clásico ensayo para medir concentración de proteínas en alimentos es el método de Kjeldahl. Este ensayo determina el nitrógeno total en una muestra. El único componente de la mayoría de los alimentos que contiene nitrógeno son las proteínas (las grasas, los carbohidratos y la fibra dietética no contienen nitrógeno). Si la cantidad de nitrógeno es multiplicada por un factor dependiente del tipo de proteína esperada en el alimento, la cantidad total de proteínas puede ser determinada. En las etiquetas de los alimentos, la proteína es expresada como el nitrógeno multiplicado por 6,25, porque el contenido de nitrógeno promedio de las proteínas es de aproximadamente 16 %. El método de Kjeldahl es usado porque es el método que la AOAC International ha adoptado y por lo tanto es usado por varias agencias alimentarias alrededor del mundo.[38]
Existen otros ensayos realizados para cuantificar del contenido de proteínas y se basan en distintos principios:
- Reacción química del enlace peptídico y posterior medida fotométrica ( por ejemplo el método de Biuret)
- Reacción química de determinados aminoácidos de la proteína y posterior medida fotométrica (por ejemplo determinación con el reactivo Folin-Ciocalteu; reacciona fundamentalmente la tirosina)
- Medida de absorción ultravioleta (determinación de los aminoácidos aromáticos Triptófano, tirosina y fenilalanina)
- Medida de la turbidez por floculación de la proteína disuelta mediante un precipitante de proteínas.
Digestión de proteínas
La digestión de las proteínas se inicia típicamente en el estómago, cuando el pepsinógeno es convertido a pepsina por la acción del ácido clorhídrico, y continúa por la acción de la tripsina y la quimotripsina en el intestino. Las proteínas de la dieta son degradadas a péptidos cada vez más pequeños, y estos hasta aminoácidos y sus derivados, que son absorbidos por el epitelio gastrointestinal. La tasa de absorción de los aminoácidos individuales es altamente dependiente de la fuente de proteínas. Por ejemplo, la digestibilidad de muchos aminoácidos en humanos difiere entre la proteína de la soja y la proteína de la leche[39] y entre proteínas de la leche individuales, como beta-lactoglobulina y caseína.[40] Para las proteínas de la leche, aproximadamente el 50 % de la proteína ingerida se absorbe en el duodeno o el yeyuno,[41] y el 90 % se ha absorbido ya cuando los alimentos ingeridos alcanzan el íleon.[42]
Además de su rol en la síntesis de proteínas, los aminoácidos también son una importante fuente nutricional de nitrógeno. Las proteínas, al igual que los carbohidratos, contienen cuatro kilocalorías por gramo, mientras que los lípidos contienen nueve kcal., y los alcoholes, siete kcal. Los aminoácidos pueden ser convertidos en glucosa a través de un proceso llamado gluconeogénesis.
Métodos de estudio
Las estructuras y actividades de las proteínas pueden ser estudiadas in vitro, in vivo e in silico. Los estudios in vitro de proteínas purificadas en ambientes controlados son útiles para comprender de qué manera una proteína lleva a cabo su función: por ejemplo, los estudios de cinética enzimática exploran los mecanismos químicos de la actividad catalítica de una enzima y su afinidad relativa por diferentes sustratos moleculares. Por su parte, los experimentos in vivo pueden aportar información sobre el papel fisiológico de una determinada enzima en el contexto de la célula o incluso de todo un organismo. Los estudios in silico usan métodos computacionales para el estudio de las proteínas.[43]
Purificación de proteínas
Para realizar el análisis in vitro de una proteína, esta debe ser separada de otros componentes celulares. Este proceso generalmente empieza con la lisis de la célula, en la cual se destruye la membrana celular y su contenido se libera formando una solución llamada lisado crudo. La mezcla resultante puede ser purificada utilizando centrifugación diferencial, que separa los distintos componentes celulares en fracciones que contienen proteínas solubles; lípidos y proteínas de membrana; orgánulos celulares y ácidos nucléicos. La precipitación por un método que se basa en la utilización de elevadas concentraciones salinas puede concentrar las proteínas del lisado. Diversos tipos de cromatografía se usan para aislar la proteína o proteínas de interés basándose en propiedades como la masa molecular, carga neta o afinidad de unión. El nivel de purificación puede ser monitorizado empleando varios tipos de electroforesis en gel si se conocen la masa molecular y el punto isoeléctrico de la proteína estudiada, por espectroscopía si la proteína tiene características espectroscópicas distinguibles, o bien por ensayos de enzimas si la proteína tiene una actividad enzimática. Además, las proteínas pueden ser aisladas según su carga por medio de la técnica de isoelectroenfoque.
Para las proteínas naturales, pueden ser necesarios varios pasos de purificación para obtener proteína suficientemente pura para su uso en laboratorios. Para simplificar este proceso se utiliza a menudo la ingeniería genética para añadir características químicas a la proteína que faciliten su purificación, sin alterar su estructura o función. Como ejemplo, se le puede unir al final de la proteína una etiqueta consistente en una secuencia de aminoácidos específica, a menudo una serie de residuos de histidina. Como resultado, cuando el lisado se hace pasar por una columna de cromatografía que contenga níquel los residuos de histidina se unen al níquel y anclan la proteína a la columna mientras que los componentes no etiquetados del lisado pasan sin impedimento.
Localización celular

El estudio de las proteínas in vivo trata de conocer cual es la localización y el lugar de síntesis de la proteína en la célula. Aunque muchas proteínas intracelulares se sintetizan en el citoplasma y las proteínas de membrana o secretadas en el retículo endoplasmático, los detalles de cómo las proteínas son dirigidas a orgánulos o estructuras celulares específicas no se conocen bien. Una técnica útil para estimar la localización celular utiliza la ingeniería genética para expresar en la célula una proteína de fusión o quimera formada por la proteína natural de interés unida a un reportero como la proteína verde fluorescente. La localización en la célula de la proteína fusionada puede ser visualizada de forma clara y eficiente por microscopía, como se ve en el ejemplo de la figura.
Otro método para elucidar la localización celular de las proteínas de marcadores de compartimento conocidos para regiones como el retículo endoplasmático, aparato de golgi, lisosomas, vacuolas, mitocondrias, cloroplastos, membrana plasmática, etc. Con el uso se versiones etiquetadas con fluorescencia de estos marcadores o de anticuerpos para marcadores conocidos se facilita la localización celular de una proteína de interés. Por ejemplo, la inmunofluorescencia indirecta permite la colocalización por fluorescencia y la demostración de la localización. Las tinciones fluorescentes se usan para etiquetar compartimentos celulares con un propósito similar.
Existen otras posibilidades. Por ejemplo, la inmunohistoquímica utiliza un anticuerpo específico de una o varias proteínas de interés que están conjugadas a enzimas que producen señales por luminiscencia o cromogénicas que pueden detectarse y compararse entre muestras, lo que permite obtener información sobre la localización celular de las proteínas. Otra técnica aplicable es la cofraccionación en gradientes de sacarosa (u otro material) utilizando la centrifugación isopícnica o diferencial.
Cronología del estudio de las proteínas
- 1838 el nombre "Proteína" (del griego proteios, "primero") fue sugerido por Jöns Jacob Berzelius para la sustancia compleja rica en nitrógeno hallada en las células de todos los animales y vegetales.
- 1819-1904 se descubren la mayor parte de los 20 aminoácidos comunes en las proteínas.
- 1864 Felix Hoppe-Seyler cristaliza por primera vez y pone nombre a la hemoglobina.
- 1894 Hermann Emil Fischer propone una analogía "llave y cerradura" para las interacciones enzima-sustrato.
- 1897 Buchner y Buchner demostraron que los extractos exentos de células de levadura pueden fermentar la sacarosa para formar dióxido de carbono y etanol, por lo tanto sentaron las bases de la enzimología.
- 1926 James Batcheller Sumner cristalizó ureasa en forma pura, y demostró que las proteínas pueden tener actividad catalítica de enzimas. Svedberg desarrolló la primera centrifugadora analítica y la utilizó para calcular el peso molecular de la hemoglobina.
- 1933 Arne Wilhelm Kaurin Tiselius introdujo la electroforesis para separar a las proteínas en solución.
- 1934 Bernal y Crowfoot prepararon los primeros patrones detallados de una proteína por difracción de rayos X, obteniendo a partir de cristales de la enzima pepsina.
- 1942 Archer John Porter Martin y Richard L. M. Synge desarrollaron la cromatografía, una técnica que ahora se utiliza para separar proteínas.
- 1951 Linus Carl Pauling Y Robert Corey propusieron la estructura de una conformación helicoidal de una cadena de aminoácidos-la "hélice" α-y la estructura de la "lámina" β, las cuales fueron halladas posteriormente en muchas proteínas.
- 1955 Frederick Sanger determina por primera vez la secuencia de aminoácidos de una proteína (insulina).
- 1956 Vernon Ingram produjo la primera huella proteica y demostró que la diferencia entre la hemoglobina de la anemia falciforme y la hemoglobina normal se debe al cambio de un solo aminoácido.
- 1960 John Kendrew describió la primera estructura tridimensional detallada de una proteína (la mioglobina del esperma de la ballena) con una resolución de 0,2 nm, y Perutz propuso una estructura de resolución mucho más baja para la hemoglobina.
- 1963 Monod, Jacob y Changeux reconocieron que muchas enzimas se regulan por medio de cambios alostéricos en su conformación.
- 1969 Levinthal propone la parádoja sobre el plegamiento que se conoce con su nombre, Paradoja de Levinthal.
- 1972 Christian B. Anfinsen recibe el Nobel de Química por sus trabajos con la ribonucleasa, lo que le llevó a proponer su famosa hipótesis sobre el plegamiento.
- 1995 Marc R. Wilkins acuñó el término (Proteoma) a la totalidad de proteínas presentes en una célula.[44]
Véase también
Referencias
- Real Academia Española. «proteína». Diccionario de la lengua española (23.ª edición).
- Real Academia Española. «prótido». Diccionario de la lengua española (23.ª edición).
- «Del gen a la proteína.».
- Nutrición en Salud Pública. 2007-09. doi:10.4321/repisalud.4997. Consultado el 2 de junio de 2022.
- Martinez Silva, A.; Dinkova, T. (Septiembre, 2010). «Mecanismos de regulación traduccional mediados por el factor de inicio 4e:las dos caras de la moneda.». Revista de Educación Bioquímica 29 (3): 82:91.
- «Ion»
|url=incorrecta con autorreferencia (ayuda). - Blanco y Blanco, Quìmica de los Alimentos (2012). «3». Proteínas. El Ateneo. p. 120. ISBN 978-970-260-670-3.
- García, Tomás (2010). El Pequeño Larousse Ilustrado 2010 (Decimosexta edición). México: Larousse. p. 1824. ISBN 978-607-4-00139-6. Consultado el 20 de octubre de 2011. «Proteína ».
- Solomon (2013). «La química de la vida; compuestos orgánicos.». Biología. Cengage.
- Badui Dergal, Química de los Alimentos (2006). «capítulo 3». En Enrique Quintanar Duarte, ed. Química de los alimentos. Biblioteca de la Escuela Técnica 4-005 Josefa Capdivila Balcarce 96 San Martín: Pearson Educación. p. 209. ISBN 970-26-0670-5. Consultado el 5 de julio de 2019.
- «¿Qué son las proteínas? Tipos, funciones y beneficios - PharmaSalud.net». 20 de noviembre de 2021. Consultado el 30 de enero de 2022.
- Curtis, Helena (1991). «Capítulo 3. Moléculas orgánicas». Biología. Editorial Médica Panamericana. p. 87.
- «DEFINICIÓN DE BIOQUIMICA».
- Lehninger, Albert L.,; Cox, Michael M. (2005). Lehninger principles of biochemistry (Fourth edition edición). W.H. Freeman. ISBN 0-7167-4339-6. OCLC 55476414. Consultado el 9 de abril de 2020.
- Badui Dergal, Salvador.; Valdés Martínez, Sara Esther. (2006). Química de los alimentos (4a ed edición). Pearson Education. ISBN 970-26-0670-5. OCLC 503249720. Consultado el 9 de abril de 2020.
- «Estructuras celulares: Eucariotas y Procariotas». okdiario. 27/03/2017 18:59. Consultado el 1 de junio de 2020.
- Dobson, C. M.. Pain, R. H., ed. Mechanisms of Protein Folding. Oxford University Press. pp. 1-28. ISBN 0-19-963789-X.
- «Proteínas: de la estructura primaria a la cuaternaria».
- Arboledas Brihuega, David (2011). «El postulado de Anfinsen y la paradoja de Levinthal y siguientes». Jerarquía estructural de las proteínas. Alicante, España: Editorial Club Universitario. pp. 99 en adelante. ISBN 9788499484556. Consultado el 1 de julio de 2016.
- Fulton, A; Isaacs W (1991). «Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis». BioEssays 13 (4): 157-61. PMID 1859393. doi:10.1002/bies.950130403.
- Bruckdorfer, T; Marder O; Albericio F (2004). «From production of peptides in milligram amounts for research to multi-tons quantities for drugs of the future». Current Pharmaceutical Biotechnology 5 (1): 29-43. PMID 14965208. doi:10.2174/1389201043489620.
- Schwarzer, D; Cole P (2005). «Protein semisynthesis and expressed protein ligation: chasing a protein's tail». Current Opinions in Chemical Biology 9 (6): 561-69. PMID 16226484. doi:10.1016/j.cbpa.2005.09.018.
- Kent, SB (2009). «Total chemical synthesis of proteins». Chemical Society Reviews 38 (2): 338-51. PMID 19169452. doi:10.1039/b700141j.
- Ganong, William F. (1995). «Equilibrio energético, metabolismo y nutrición». Fisiología médica. Manual Moderno. p. 332.
- Lodish, Harvey F.,; Kaiser, Chris,; Krieger, Monty,; Bretscher, Anthony,; Ploegh, Hidde L.,; Amon, Angelika,; Martin, Kelsey C.,. Molecular cell biology (Eighth edition edición). ISBN 978-1-4641-8339-3. OCLC 949909675. Consultado el 7 de abril de 2020.
- Badui Dergal, Química de los alimentos (2006). «Proteínas». Organización estructural. Pearson. p. 153. ISBN 9702606705.
- Watson, James D., 1928-. Molecular biology of the gene (Seventh edition edición). ISBN 978-0-321-76243-6. OCLC 824087979. Consultado el 9 de abril de 2020.
- Molecular cell biology, Lodish H., Berk A., Matsudaira P., Kaiser C., Krieger M., Scott M., Zipursky S., Darnell J.(2004) 5ª Edición.RR Donelley & Sons Company. 59-72 pp.
- Blanco, Antonio (1993). «Proteínas». Química Biológica. El Ateneo. p. 46.
- Williamson, Mike (Michael Paul) (2012). How proteins work. Garland Science. ISBN 978-0-8153-4446-9. OCLC 668196960. Consultado el 9 de abril de 2020.
- Jimeno, Antonio; Ballesteros Vázquez, Manuel; Ugedo Ucar, Luis. Biología. Fuenlabrada: Santillana, 1997. ISBN 978-84-294-8385-7
- Mathews, Christopher K., 1937-; Ahern, Kevin G.; González de Buitrago, José Manuel, (2002). Bioquímica. Addison Wesley. ISBN 84-7829-053-2. OCLC 53317350. Consultado el 9 de abril de 2020.
- «The Orderly Chaos of Proteins». Scientific American (en inglés). Consultado el 9 de abril de 2020.
- Teijón Rivera, José María (2005). «5». Fundamentos de bioquímica estructural. México: Alfaomega. p. 72.
- Villaverde, Carmen (2007). «13». Fundamentos de bioquímica metabólica. México: Alfaomega. p. 156.
- «Manual de técnicas para laboratorio de nutrición de peces y crustáceos...». Depósito de documentos de la FAO. Consultado el 6 de septiembre de 2014.
- Matissek, Schnepel, Steiner. «3: Proteínas, péptidos, aminoácidos». Análisis de los Alimentos. Fundamentos-Métodos - Aplicaciones. Acribia S.A. p. 93.
- Gaudichon C, Bos C, Morens C, Petzke KJ, Mariotti F, Everwand J, Benamouzig R, Dare S, Tome D, Metges CC. (2002). Ileal losses of nitrogen and amino acids in humans and their importance to the assessment of amino acid requirements. Gastroenterology 123(1):50-9.
- Mahe S, Roos N, Benamouzig R, Davin L, Luengo C, Gagnon L, Gausseunrges N, Rautureau J, Tome D. (1996). Gastrojejunal kinetics and the digestion of 15Nbeta-lactoglobulin and casein in humans: the influence of the nature and quantity of the protein. Am J Clin Nutr 63(4):546-52.
- Auxiliares Sanitarios (Auxiliares de Clínica). Grupo Iv. Temario de la Xunta de Galicia.e-book. MAD-Eduforma. ISBN 9788466557580. Consultado el 23 de enero de 2018.
- Mahe S, Marteau P, Huneau JF, Thuillier F, Tome D. (1994). Intestinal nitrogen and electrolyte movements following fermented milk ingestion in man. Br J Nutr 71(2):169-80.
- Alberts, Bruce (1992). «4». Biología molecular de la célula (2ª edición). Omega. pp. 172-190. ISBN 84-282-0896-4.
- Alberts, Bray, Hopkin, Johnson, Lewis, Raff, Roberts, Walter. "Introducción a la Biología Celular". Segunda Edición
Bibliografía
- Kerstetter, J. E., O'Brien, K. O., Caseria, D.M, Wall, D. E. & Insogna, K. L (2005) The impact of dietary protein on calcium absorption and kinetic measures of bone turnover in women. J Clin Endocrinol Metab (2005) Vol. 90, p. 26-31.
- Rodríguez, Faride. La estructura de las proteínas (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (consultado el 24 de diciembre de 2007).
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre proteína.
Wikcionario tiene definiciones y otra información sobre proteína.
El Diccionario de la Real Academia Española tiene una definición para proteína.
- Estructura química de las proteínas, aminoácidos, péptidos, y polipéptidos.
- Información general sobre las proteínas.