Enlace peptídico
El enlace peptídico es un enlace de tipo amida entre el grupo amino (–NH2) de un aminoácido (AA) y el grupo carboxilo (–COOH) de otro aminoácido[1]. Los péptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos.[2] El enlace peptídico implica la formación de un enlace CO-NH y la deshidratación o pérdida de una molécula de agua (H2O), al perder el grupo carboxilo un hidrógeno y un oxígeno y el grupo amino un hidrógeno. Es, en realidad, un enlace amida sustituido.[3] La formación de este enlace requiere aportar energía, mientras que su rotura (hidrólisis) la libera.[1]
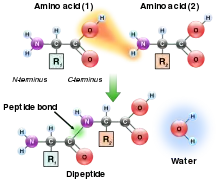

Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal (en la Figura 1, abajo a la derecha).
Para nombrar el péptido se empieza por el NH2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina.
Características estructurales del enlace

En las décadas de 1940 y 1950, estudios basados en la difracción de rayos X sobre muestras de cristales de aminoácidos, dipéptidos y tripéptidos realizados por Linus Pauling y Robert Corey ayudaron a comprender la estructura del enlace peptídico, observándose que:
- El enlace C-N que une a dos aminoácidos es más corto que otros enlaces C-N
- El enlace C-N presenta carácter parcial de doble enlace ya que se estabiliza por resonancia, lo que no permite el giro en dicho enlace.Sin embargo, el resto de los enlaces (N-C y C-C) son enlaces sencillos verdaderos, con lo que podría haber giro (señalado con a en la imagen).[4]
- Los cuatro átomos del enlace (CO-NH) se hallan en un mismo plano, con el Oxígeno y el Hidrógeno en posición trans.



Esta ordenación planar rígida es el resultado de la estabilización por resonancia del enlace peptídico. Por ello, el armazón de un péptido está constituido por la serie de planos sucesivos separados por grupos metileno sustituidos en los que sí puede haber giro. Pero no todos los giros son posibles, lo que impone restricciones importantes al número posible de conformaciones que puede adoptar una proteína.
Si denominamos "Φ" al valor del ángulo que puede adoptar el enlace N-C, y "Ψ" al del enlace C-C, solo existirán unos valores permitidos para Φ y Ψ (ver gráfico de Ramachandran); y dependerá en gran medida del tamaño y características de los grupos R sucesivos.
Degradación[5]
El enlace peptídico puede romperse por hidrólisis (añadiendo agua). En su presencia se romperá liberando 8–16 kilojulios/mol (2–4 kcal/mol) de energía libre. En la naturaleza este proceso es extremadamente lento (más de 1000 años), pero hay formas de acelerarlo:
- Hidrólisis ácida: Se basa en la ebullición prolongada de la proteína con soluciones ácidas fuertes (HCl y H2SO4). Este método destruye completamente el triptófano y parte de la serina y la treonina.
- Hidrólisis básica: Respeta los aminoácidos que se destruyen por la hidrólisis anterior. Normalmente se utiliza NaOH o Ba(OH)2.
- Hidrólisis enzimática: Es la forma más común en los seres vivos, se utilizan enzimas proteolíticas cuya actividad es lenta y a menudo incompleta, sin embargo no se produce racemización y no se destruyen los aminoácidos; por lo tanto es muy específica. Las enzimas tripsina y quimotripsina, presentes en los jugos digestivos, son ejemplos de enzimas proteolíticas.
- Hidrólisis por temperatura:[Nota 1] en condiciones normales, la alta temperatura no destruye los enlaces peptídicos, aunque sí puede llegar a desnaturalizar la proteína (ruptura de las estructuras secundaria, terciaria y cuaternaria). Sin embargo, temperaturas extremas aplicadas un largo tiempo pueden llegar a destruir los enlaces peptídicos (>110 grados 48 h).
Véase también
Notas
- Qian, Yaorong (1993). «Kinetics of peptide hydrolysis and amino acid decomposition at high temperature». Geochimica et Cosmochimica Acta (en inglés).
Referencias
- Stryer, 1993, p. 22.
- Alberts, Bruce (1992). «1». Biología molecular de la célula (2ª edición). Omega. p. 4. ISBN 84-282-0896-4.
- Lehninger, 1988, p. 111.
- Lehninger, 1988, p. 150.
- Lehninger, 1988, p. 113.