Fosfolipasa C
La fosfolipasa C o fosfoinositida fosfolipasa C (PLC) (EC 3.1.4.11) es una familia de enzimas intracelulares y de membrana en organismos eucariotas que participa en los procesos de transducción de señales.[1] Todas las fosfolipasas C pertenecen a la familia de las hidrolasas, es decir, actúan rompiendo enlaces diester fosfóricos utilizando agua.
| Fosfolipasa C | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 3.1.4 | |||
| Estructura/Función proteica | ||||
| Tipo de proteína | Hidrolasa | |||
| Funciones | Enzima | |||
| Ortólogos | ||||
| Especies |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||

Etimología
En general, la enzima se denota como fosfolipasa C, sin embargo, se han identificado otras tres familias de enzimas que son fosfolipasas C en otros organismos:
- la fosfolipasa C dependiente de zinc en algunas bacterias;
- la glicosilfosfatidilinositol diacilglicerol-liasa en los protista del género Trypanosoma.
Función
Las fosfolipasas C participan en el metabolismo de los fosfatidilinositol bifosfato (PIP2) y las vías calcio-dependientes de la señalización celular relacionados con lípidos. Hasta ahora, la superfamilia consiste en 6 subfamilias con un total de 13 isozimas individuales que difieren una de la otra en su modo de activación, sus niveles de expresión, su regulación catalítica, su localización celular, su afinitidad de unión a la membrana y su distribución en los tejidos. Todas son capaces de hidrolizar al (PIP2) en dos moléculas segundo mensajero de gran importancia, que terminan alterando las respuestas celulares a la proliferación, diferenciación celular, apoptosis, remodelaje del citoesqueleto, tráfico vesicular, canales iónicos, funciones endocrinas y neurotransmisión.
Las isozimas conocidas de la fosfolipasa C son:
Reacción química
La fosfoinositida fosfolipasa C cataliza la reacción química entre el 1-fosfatidil-1D-mio-inositol 4,5-bifosfato (PIP2) y el agua:
Los dos productos de la reacción son el inositol 1,4,5-trifosfato (IP3) y el diacilglicerol (DAG). Todos los miembros de esta familia pueden catalizar la hidrólisis de IP2, un fosfatidilinositol, en la cara interna de la membrana celular y producir como consecuencia insoitol trifosfato y DAG.
Tanto el IP3 como el DAG tienen funciones individuales, participando en el movimiento de calcio dentro del citosol y estimulando la fosforilación de las cadenas ligeras de miosina, respectivamente.
Secuencia
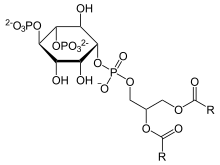
La reacción de hidrólisis catalizada por la PLC del IP2 ocurre en dos pasos secuenciales. El primer paso de la reacción es una fosfotransferencia en la que ocurre un ataque intramolecular ente el grupo hidroxilo de la posición 2' del anillo inositol y el grupo fosfato produciendo un IP3 cíclico intermediario y el DAG. Ocurre luego el segundo paso que es una fosfodiesterasa, en la que el intermediario cíclico permanece en el sitio activo de la enzima con suficiente tiempo para que sea atacado por una molécula de H2O produciendo un IP3 final, acíclico. Esta reacción difiere de las PLC bacterianas en que estas últimas producen solo compuestos cíclicos.
Regulación
Este proceso catalítico de la fosfolipasa C es altamente regulada por medio de una fosforilación reversible y por la unión de proteínas reguladoras.[2][3][4]
Ubicación celular
La fosfolipasa C es una enzima de la membrana celular, donde su sustrato, el PIP2, está presente. El anclaje a la membrana es mediada principalmente por sus dominios fijadores de lípidos, como lo son el dominio PH, el dominio C2, etc. Estas regiones en la enzima tienen afinidad por los varios componentes de los fosfolípidos de la membrana plasmática. Se ha descubierto en recientes investigaciones que la PLC puede también existir en otras regiones sub-celulares, como lo son el citoplasma y el núcleo celular. No está aún del todo claro por qué razón estas enzimas se ubican en estos compartimentos celulares, en particular en el núcleo.
Función
La PLC participa en mecanismos catalíticos que generan inositol trifosfatos (IP3) y diacilglicerol (DAG). Estas moléculas entonces modulan la actividad de proteínas en la cascada de señalización celular. El IP3 es soluble y difunde a través del citoplasma e interactúa con receptores específicos IP3 del retículo endoplásmico, causando la liberación de calcio, elevando así las concentraciones de calcio intracelular.
Referencias
- Meldrum E, Parker PJ, Carozzi A (1991). «The PtdIns-PLC superfamily and signal transduction». Biochim. Biophys. Acta 1092 (1): 49-71. PMID 1849017.
- Rhee SG, Choi KD (1992). «Multiple forms of phospholipase C isozymes and their activation mechanisms». Adv. Second Messenger Phosphoprotein Res. 26: 35-61. PMID 1419362.
- Rhee SG, Choi KD (1992). «Regulation of inositol phospholipid-specific phospholipase C isozymes». J. Biol. Chem. 267 (18): 12393-12396. PMID 1319994.
- Sternweis PC, Smrcka AV (1992). «Regulation of phospholipase C by G proteins». Trends Biochem. Sci. 17 (12): 502-506. PMID 1335185.