Regulación alostérica
La alostería (de griego ἄλλως, allos: otro y στερεός, stereós: forma) o alosterismo es un modo de regulación de las enzimas por el que la unión de una molécula en una ubicación (sitio alostérico) modifica las condiciones de unión de otra molécula, en otra ubicación (sitio catalítico) de la enzima, distante de la primera. Este concepto lo plantearon Jacques L. Monod, Jeffries Wyman y Jean-Pierre Changeux en una serie de artículos, el más importante de los cuales se publicó en 1965 en Journal of Molecular Biology.[1] En bioquímica, es la regulación de una enzima u otra proteína al unirse una molécula efectora en el sitio alostérico de la proteína (otro sitio que no sea el sitio activo de la proteína). Los efectores que aumentan la actividad de la enzima se denominan activadores alostéricos y aquellos que disminuyen dicha actividad se llaman inhibidores alostéricos.
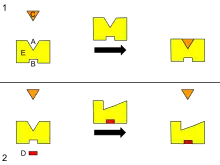
B -Sitio alostérico
C -Sustrato
D -regulador
E -Enzima
Diagrama que representa la regulación alostérica de una enzima
Principios de la alostería
La unión de la molécula induce un cambio de conformación espacial de la proteína enzimática, de tal modo que se modifica la ubicación del enlace de por lo menos uno de los reactivos implicados en el proceso de catálisis. En el modelo de Monod-Wyman-Changeux (MWC) las enzimas alostéricas deben presentar varias propiedades:
- Son multiméricas, cada monómero fija una molécula de ligando.
- Poseen al menos un eje de simetría.
- Existen bajo dos conformaciones diferentes: una llamada T (tensa), que por convenio designa la forma de menor afinidad por el sustrato, y la otra R (relajada), con mayor afinidad por el sustrato.
- En una misma molécula de proteína, todas las subunidades adoptan la misma configuración, R o T (transición concertada). Dicho de otro modo, no existe híbrido R/T en el modelo MWC.
Regulación alostérica de la hemoglobina

La hemoglobina constituye un ejemplo muy importante para la vida de la de proteína alostérica, aunque no es una enzima, sino una molécula transportadora. Cada una de las cuatro subunidades de la hemoglobina contiene un grupo prostético llamado grupo hemo, que puede fijar una molécula de oxígeno. La unión de la primera molécula de oxígeno aumenta la afinidad de unión al segundo grupo hemo, la unión de la segunda aumenta la afinidad para la tercera, etc. (cooperación positiva, efecto homotrópico).
Importancia fisiológica de la alostería
La alostería es una forma de regulación de la actividad de una enzima u otra proteína dependiente de condiciones cambiantes. Podemos distinguir los efectos de sensores y retroalimentación.
Véase también
Referencias
- J. Monod, J. Wyman, J.P. Changeux (mayo de 1965). «On the nature of allosteric transitions: A plausible model». Journal of Molecular Biology 12 (1): 88-118. PMID 14343300. doi:10.1016/S0022-2836(65)80285-6.