Alquino
Los alquinos son alifático|hidrocarburos alifáticos con al menos un triple enlace (dos enlaces π pi y uno Σ sigma) -C≡C- entre dos átomos de carbono.[1] Se trata de compuestos de ácido metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2 .[2]

Los alquinos se conocen tradicionalmente como acetilenos, aunque el nombre acetileno también se refiere específicamente a C
2H
2, conocido formalmente como eteno utilizando la nomenclatura IUPAC. Al igual que otros hidrocarburos, los alquinos son generalmente hidrófobos.[3].
Ejemplos de alquinos
CHCH etino(acetileno) CH3–CCH propino CH3–CH2–CCH 1-butino CH3-CC-CH3 2-butino CHC- etinilo CHC-CH2– 2-propinilo CH3–CC- 1-propinilo CH3–CH2–CH2–CCH 1-pentino
Generalidades
Los alquinos también se conocen como acetilenos, ya que son derivados del acetileno, el alquino más simple.
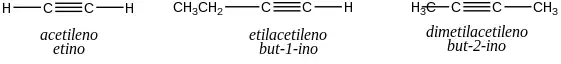
La química del enlace triple carbono-carbono es parecida a la del enlace doble. Los alquinos experimentan casi las mismas reacciones que los alquenos, en especial las adiciones y las oxidaciones. También consideramos reacciones que son específicas de los alquinos: algunas que dependen de las características únicas del enlace triple y otras que dependen de la acidez inusual del enlace acetilénico .[4]
Un enlace triple hace que un alquino tenga cuatro hidrógenos menos que el alcano correspondiente. Por lo tanto, el enlace triple aporta dos elementos de instauración (ei).

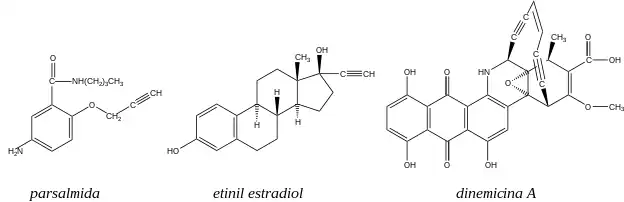
Los alquinos no son tan comunes en la naturaleza como los alquenos, pero algunas plantas utilizan alquinos para protegerse contra enfermedades o depredadores. La cicutoxina es un compuesto tóxico que se encuentra en la cicuta acuática, y la capilina protege a las plantas contra enfermedades fugitivas. El grupo funcional alquino no es común en medicamentos, pero la parsalmida se utiliza como analgésico, y el etinil estradiol (una hormona femenina sintética) es un ingrediente común en las píldoras anticonceptivas. La dinemicina A es un compuesto antibacterial que está siendo probado como agente antitumoral.[4]

Cicloalquinos
Los cicloalquinos incluyen la presencia de uno o más enlaces triples entre los carbonos que constituyen el compuesto cíclico. Tienen mayor categoría que los compuestos alquinos lineales. De manera similar a los cicloalquenos, los enlaces triples tienen prioridad cuando se enumeran los carbonos de un cicloalquino. El siguiente criterio es asignar los menores índices a las sustituciones encontradas y, finalmente, considerar el orden alfabético de los radicales.[5]
%252C_4-isobutil%253B_1-ciclobutino.svg.png.webp)
Nomenclatura
1. Nomenclatura IUPAC
Reglas:
- Se escoge como cadena principal aquella que contiene el mayor número de triples enlaces y el mayor número de carbonos.
- Se enumera esta cadena desde el extremo más cercano a un triple enlace.
- Se identifican las cadenas laterales con sus respectivos nombres.
- Se nombran las cadenas laterales en ORDEN ALFABÉTICO y se identifican con números las posiciones de las mismas en la cadena principal.
- A este nombre se anteponen los números que indican las posiciones de los triples enlaces y se introduce, previa la terminación INO, el prefijo que establece el número de triples enlaces existentes en la cadena principal (di, tri, tetra, etc.).[5]

2. Cadena Laterales
Los alquinos pueden formar parte de cadenas laterales. En este caso, deben ser nombrados como radicales, en los cuales se adopta la raíz del nombre del alquino y se escribe la terminación "INIL". Además, se debe indicar con números la posición del triple enlace respecto a la cadena principal.[5]
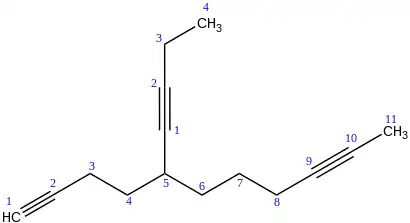
Cuando un triple enlace no es la función principal de un compuesto, pueden ser identificado con su posición y la palabra INO. Este nombre entra en el normal ordenamiento alfabético de las cadenas laterales.
3. Nomenclatura derivada(nombres comunes)
En este caso, se nombran los alquinos como derivados del acetileno o etino, de acuerdo con las siguientes reglas (Muñoz Bisesti et al., 2012)[5]:
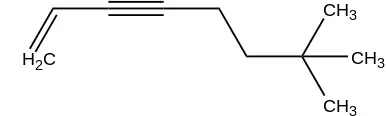
- Se debe identificar al grupo acetileno que se tomará como referencia para dar el nombre al compuesto.
- Se identifican las cadenas laterales unidas al grupo acetileno referencia. Se nombran los radicales en ORDEN ALFABÉTICO.
- Se termina con la palabra ACETILENO o ETINO.
Al igual que en el caso de los alquenos, no se utiliza la nomenclatura derivada cuando la estructura del alquino es muy compleja.
4. Caso Particular
Si en un hidrocarburo se presentan dobles y triples enlaces, se elige como cadena principal a la que incluya la mayor cantidad de enlaces múltiples y que contenga el mayor número de carbonos. La cadena se enumera por el extremo más cercano a un enlace múltiple; sin embargo, si los enlaces múltiples se encuentran a las mismas distancias desde ambos extremos, se escoge la enumeración que asigne números más bajos a los dobles enlaces.[5]
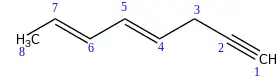
La terminación del hidrocarburo deberá indicar el número de dobles y triples enlaces presentes, como "en-ino", "dien-ino", "trien-diino", etc.
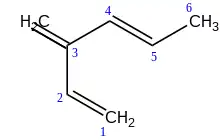
Los nombres de los radicales que se unen mediante enlace doble a una cadena principal, deben tener la terminación "IDEN" añadida al nombre del radical, según el número de carbonos que posea.
Propiedades físicas
1) Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: ligroína, éter, benceno, tetracloruro de carbono.
2) Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas.
3) Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado.
4) Los tres primeros términos son gases a temperatura ambiente.; los demás son líquidos o sólidos.
5)A medida que aumenta el peso molecular aumentan la densidad, el punto de fusión y el punto de ebullición.
6) Los acetilenos son compuestos de baja polaridad, por lo cual sus propiedades físicas son muy semejantes a la de los alquenos y alcanos.
7) Son inflamables
Hay que tener en cuenta que los acetilenos completen la regla del cuarteto.
| Propiedades físicas de alquinos seleccionados[4] | ||||
|---|---|---|---|---|
| Nombre | Estructura | pf (°C) | pe (°C) | Densidad (g/cm3) |
| etino (acetileno) | H−C≡C−H | -82 | -84 | 0.62 |
| propino | H−C≡C−CH3 | -101 | -23 | 0.67 |
| but-1-ino | H−C≡C−CH2CH3 | -126 | 8 | 0.67 |
| but-2-ino | CH3−C≡C−CH3 | -32 | 27 | 0.69 |
| pent-1-ino | H−C≡C−CH2CH2CH3 | -90 | 40 | 0.70 |
| pent-2-ino | CH3−C≡C−CH2CH3 | -101 | 55 | 0.71 |
| 3-metilbut-1-ino | CH3−CH(CH3)−C≡C−H | 28 | 0.67 | |
| hex-1-ino | H−C≡C−(CH2)3−CH3 | -132 | 71 | 0.72 |
| hex-2-ino | CH3−C≡C−CH2CH2CH3 | -90 | 84 | 0.73 |
| hex-3-ino | CH3CH2−C≡C−CH2CH3 | -101 | 82 | 0.73 |
| 3,3-dimetilbut-1-ino | (CH3)3C−C≡C−H | -81 | 38 | 0.67 |
| hept-1-ino | H−C≡C−(CH2)4CH3 | -81 | 100 | 0.73 |
| oct-1-ino | H−C≡C−(CH2)5CH3 | -79 | 125 | 0.75 |
| non-1-ino | H−C≡C−(CH2)6CH3 | -50 | 151 | 0.76 |
| dec-1-ino | H−C≡C−(CH2)7CH3 | -36 | 174 | 0.77 |
Propiedades químicas
Las reacciones más frecuentes son las de adición: de hidrógeno, halógeno, agua, etc. En estas reacciones se rompe el triple enlace y se forman enlaces de menor polaridad: dobles o sencillos.

Hidrogenación de alquinos
Los alquinos pueden ser hidrogenas para dar los correspondientes cis-alquenos (doble enlace) tratándolos con hidrógeno en presencia de un catalizador de paladio sobre sulfato de bario o sobre carbonato de calcio (catalizador Lindlar) parcialmente envenenado con óxido de plomo. Si se utiliza paladio sobre carbón activo el producto obtenido suele ser el alcano correspondiente (enlace sencillo).
- CH≡CH + H2 → CH2=CH2 + H2 → CH3-CH3
Aunque la densidad de electrones y con esto de carga negativa en el triple enlace es elevada pueden ser atacados por nucleófilos. La razón se encuentra en la relativa estabilidad del anión de vinilo formado.
Frente al sodio o el litio en amoníaco líquido, se hidrogena produciendo trans-alquenos.[6]
- CH3-C≡C-CH3 + 2 Na + 2 NH3 → CH3-CH=CH-CH3 (trans) + 2 NaNHH2
Halogenación, hidrohalogenación e hidratación de alquinos
Así como les ocurre a los alquenos, los alquinos participan en otras reacciones de adición:
= Halógeno
Dependiendo de las condiciones y de la cantidad añadida de halógeno (flúor, F2; cloro, Cl2; bromo, Br2...), se puede obtener derivados halogenados del alqueno o del alcano correspondiente.
- HC≡CH + Br2 → HCBr≡CHBr
- HC≡CH + 2 Br2 → HCBr2-CHBr2
Hidrohalogenación, hidratación, etc.
El triple enlace también puede adicionar halogenuros de hidrógeno, agua, alcohol, etc., con formación de enlaces dobles o sencillos. En general se sigue la regla de Markovnikov.
- HC≡CH + H-X → CH2=CHX donde X = F, Cl, Br...
- HC≡CH + H2O → CHOH=CH2
Acidez del hidrógeno terminal
En algunas reacciones (frente a bases fuertes, como amiduro de sodio Na-NH2 en amoniaco NH3) actúan como ácidos débiles pues el hidrógeno terminal presenta cierta acidez. Se forman acetiluros (base conjugada del alquino)que son buenos nucleófilos y dan mecanismos de sustitución nucleófila con los reactivos adecuados.[7] Esto permite obtener otros alquinos de cadena más larga.
- HC≡CH + Na-NH2 → HC≡C:- Na+
- HC≡C:- Na+ + Br-CH3 → HC≡C-CH3 + NaBr
En este caso el acetiluro de sodio formado ha reaccionado con bromometano con formación de propino.
Reacciones pericíclicas
Aplicaciones
- Generalmente, el acetileno (etino) es el alquino de mayor uso.
- En la industria química los alquinos son importantes productos de partida por ejemplo en la síntesis del PVC (adición de HCl) de caucho artificial etc.
- El grupo alquino está presente en algunos fármacos citostáticos.
- En Los polímeros generados a partir de los alquinos ya que el grupo alquino se encuentra en fármacos citostáticos y también en los polímeros producidos por los alquinos, llamados polialquinos, los polialquinos, son semiconductores orgánicos y pueden ser dotados parecido al silicio, aunque se trata de materiales flexibles.
- A partir de él también se sintetizan una gran cantidad de compuestos orgánicos, siendo el ácido acético uno de los más importantes junto a otros hidrocarburos insaturados capaces de polimerizarse dando plásticos y caucho. También se utiliza para soldar sillas, mesas, etc.
- En el hogar se emplean los solventes orgánicos como agentes para limpieza a seco, diluyentes de pintura y quitamanchas.
- En la oficina como limpiadores de los tipos de máquinas de escribir y de las superficies de los escritorios, y como removedores de cera.
- En las lavanderías comerciales, como líquido para limpieza a seco.
- En las granjas, como pesticidas.
- Los laboratorios como reactivos químicos y agentes deshidratantes, limpiadores y como líquidos para extracción.
Usos de los alquinos
- Acetileno o Etino
El etino, también llamado acetileno se conoce como el alquino de mayor utilidad. Este es un gas que al quemarse con oxígeno puro crea una llama de 2,800 grados centígrados usada en soldaduras.[8] También sirven como materia prima en la obtención del metilacetileno que se utiliza en los sopletes ya que no se descompone tan fácilmente como el acetileno y pueden alcanzarse temperaturas más altas; también se utiliza como combustible de cohetes.
Sus usos generales son:
- Fabricación de ácido acético.
- Equipos de soldadura gracias a sus altas temperaturas.
- Fabricación de neoprenos de caucho sintético y del etanal.
- Producción de cloro etileno destinado a plásticos.
- Butino
El butino se conoce como un gas alquino que es muy reactivo e inflamable a temperatura ambiente. Se usa en la creación de diversos compuestos sintéticos orgánicos.[8] Dentro de sus principales aplicaciones y usos están:
- Producción de plásticos.
- Producción de compuestos sintéticos orgánicos.
- Se usa en la industria para elaborar el caucho.
- Propino
Este tipo de alquino se emplea en soldaduras. Es un gas sin color, tiene un olor característico, posee mayor densidad que el aire y se extiende hasta llegar al suelo. Cuando se calienta intensamente, este se descompone y cuando se le ejerce presión produce dióxido de carbono y monóxido de carbono, generando peligro de explosión o de incendio.[8]
- Hexino
Este alquino es de cadena abierta. Tiene un estado semilíquido. Se usa básicamente en convulsiones parciales, totales y mínimas destinadas a la soldadura autógena. Posee un triple enlace de carbono carbono.
- Pentino
El pentino también es un alquino obtenido gracias a la síntesis del etanol y KOH de los compuestos dibromopentano y dihalopentano [8]. Las aplicaciones y usos principales en los que el pentino interviene son:
- Caucho sintético
- Corte de metales
- Soldadura
Riesgos
Impacto ambiental
Los alquinos son culpables del daño causado a múltiples ecosistemas marinos debido a que se encuentran en el petróleo. Estos, llegan al mar debido a los derrames accidentales o intencionales del mismo. También ocurre porque la gasolina usada por los humanos en las ciudades, en algunas ocasiones, cae al suelo y va a dar al mar por medio de corrientes fluviales que llegan al océano. Los animales marinos son los más afectados porque el petróleo les cubre la piel y las branquias lo que los lleva a morir por asfixia.
El impacto ambiental del acetileno en cuanto producto deriva, como un daño a la capa de ozono actuando como combustible, reacciona con los óxidos de nitrógeno y la luz solar para formar oxidantes fotoquímicos, gases de escape de vehículos de motor; evaporación de disolventes; procesos industriales; eliminación de residuos sólidos; combustión de combustibles.
Riesgos en la salud
Los alquinos surgen en algunos medicamentos recetados, incluido el noretinodrel anticonceptivo. Es probable que haya un triple enlace carbono-carbono en las píldoras comercializadas, incluido el antirretroviral Efavirenz y el antifúngico Terbinafina. Las moléculas conocidas como "ene-diynes" presentan un anillo que contiene un alqueno ("ene") entre los grupos alquino ("diyne"). Esos compuestos, p. La caliqueamicina, son algunas de las píldoras antitumorales más agresivas reconocidas, tanto que la subunidad ene-diyne a veces se conoce como “ojiva nuclear”. Los enediynes se reorganizan a través de la ciclación de Bergman, generando intermediarios radicales sorprendentemente reactivos que atacan el ADN dentro del tumor.[9]
Otros riesgos
- En contacto con superficies calientes o con llamas estas sustancias se descomponen formando humos tóxicos y corrosivo.
- Por inhalación causa mareos y dolores de estómago. Al entrar en contacto con la piel, la reseca, generando enrojecimiento. La ingestión causa fuerte dolor abdominal.
- Reacciona violentamente con bases y oxidantes fuertes, originando peligro de incendio y explosión.
- Por inhalación causa vértigo, somnolencia, pérdida de conocimiento e incluso la muerte
- Ataca a algunas formas de plástico, caucho y recubrimientos.
Análisis
Los alquinos decolorean una solución ácida de permanganato de potasio y el agua de bromo. Si se trata de alquinos terminales (con el triple enlace a uno de los carbonos finales de la molécula) forman sales con soluciones amoniacales de plata o de cobre (estas sales son explosivas).
Abundancia de los alquinos en el universo
El Acetileno es el más común y es el etino, después sigue el propino, butino, etc. El acetileno es un importante gas industrial y producto de partida petroquímico, inestable a presión y debe almacenarse en forma de disolución en acetona.[10]
Estructura electrónica
Hibridación
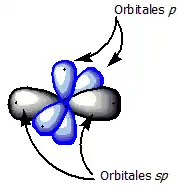
Los alquinos presentan hibridación sp; los orbitales son más pequeños que los orbitales sp2 de los alquenos y los sp3 de los alcanos. En consecuencia, el carbono con hibridación sp, forma enlaces más cortos que los otros y facilita la ruptura heterolítica de del enlace C-H.
Hay un progresivo acortamiento en la longitud del enlace carbono-carbono en la serie etano (1.53 Å), etileno (1.34 Å) y acetileno (1.20 Å). La longitud del enlace carbono-hidrógeno también disminuye.
Un triple enlace carbono-carbono resulta de la superposición de dos átomos de carbono con hibridación sp. Recuérdese que los dos orbitales híbridos sp de carbono adoptan un ángulo de 180o entre sí, a lo largo de un eje perpendicular a los ejes de los dos orbitales no híbridos 2py y 2pz. Cuando dos carbonos con hibridación sp se aproximan uno a otro para enlazarse, la configuración geométrica es adecuada para que se forme un enlace sigma sp-sp y dos enlaces pi p-p; es decir, un triple enlace.
Este tipo de hibridación, al producir enlaces de 180°, toma una forma geométrica del tipo lineal, el cual es común en los compuestos orgánicos alquinos, es decir aquellos que poseen triple enlace carbono-carbono (C≡C). Compuestos como el etino, propino, butino, fluoruro de berilio, entre otros, poseen hibridación sp. (Zapata, 2021)

- HIBRIDACIÓN DEL ETINO (CH≡CH)
El acetileno es una molécula lineal con una distancia de enlace carbono-carbono de 1.20 Å y una distancia de enlace carbono-hidrógeno de 1.06 Å, y con ángulos de enlace de 180°.
Para realizar la hibridación, iniciamos efectuando la configuración electrónica de los elementos que forman parte de la molécula, en este caso sería el carbono y el hidrógeno, quedando de la manera siguiente:
- C: Z=6; 1s2 2s2 2p2 electrones de valencia: 4
- H: Z= 1; 1s1 electrones de valencia: 1
Los electrones de valencia nos indican las posibilidades de enlace que presenta los elementos. El carbono posee 4 posibilidades de enlace y el hidrógeno una sola posibilidad, esto quiere decir que para este caso, el carbono es el átomo central de nuestra molécula.[11]
El siguiente paso es realizar el diagrama de orbitales para el carbono, nuestro átomo central, siguiendo las reglas de Hund, y además realizando la promoción electrónica para obtener la estabilidad en la molécula:

.svg.png.webp)
Cuando la molécula posee en su estructura algún enlace triple, estamos en presencia de tres enlaces, uno sigma y dos pi. Los enlaces pi no participan en la hibridación, lo que se ve reflejado en que dos orbitales p no interviene en la misma, por eso se coloca el spin (flecha) en forma de puntitos. Los enlaces sigma (σ), forman un solapamiento frontal de dos orbitales atómicos que suelen ser diferentes o iguales. No obstante, los enlaces pi (π), se deben al solapamiento lateral de dos orbitales atómicos p sin hibridar. El último paso es realizar la hibridación de la molécula, con base a lo efectuado anteriormente. Si dibujas la estructura de Lewis del etino, tendrás una idea de cómo realizar la hibridación. Primero dibuja 2 orbitales ovalados, que corresponden a los dos híbridos sp, los cuales se disponen formando una figura lineal. Los orbitales p que están sin hibridar, deben ser dibujados de manera perpendicular al plano de los orbitales híbridos (uno abajo y otro arriba del plano). Recuerda que estás representando la molécula CH≡CH, por lo tanto dicha hibridación debe ser simbolizada en cada átomo de carbono del etino. Finalmente, dichos híbridos debes solaparlos (unirlos) con el orbital s que presenta cada átomo de hidrógeno, que para el etino, serían 2 átomos. Cuando el solapamiento es frontal, se forman enlaces sigma, que en este caso sería tres enlaces sigma.[11]

Véase también
Referencias
- Alkyne. Encyclopædia Britannica
- Barrow, Gordon M. (1974). Química general. Reverte. ISBN 978-84-291-7041-2. Consultado el 29 de noviembre de 2019.
- Plantilla:Cite libro
- Wade, Leroy G. (2012). Química orgánica (7 edición). México: Pearson Educación. ISBN 978-607-32-0790-4.
- Muñoz Bisesti, F.; Sinche Serra, M.; Cuesta Galarza, M.; Muñoz Burgos, R. (2012). Nomenclatura de Química Orgánica (2 edición).
- Hidrogenación de Alquinos con Sodio en Amoniaco Líquido. Quimicaorganica.org
- Síntesis de Alquinos mediante Alquilación. Quimicaorganica.org
- Configuraciónelectronica.com (2020). «Usos de los alquinos».
- Mons, E.; Jansen, I.C.D.; Loboda, J.; Van Doodewaerd, BR.; Hermans, J.; Verdoes, M.; Van Boeckel, C.A.A.; Van Veelen, P.A.; Turk, B.; Turk, D.; Ovaa, H. (2019). El resto alquino como electrófilo latente en inhibidores de moléculas pequeñas covalentes irreversibles de catepsina K (en inglés). Journal of the American Chemical Society.
- Pine, S.H.; Hendrickson, J.B. (1980). Organic chemistry (en inglés) (4 edición). McGraw-Hill.
- Zapata, M. (9 de abril de 2021). «Hibridación sp.». Química en casa.com.
Enlaces externos
- Alquinos
- Nomenclatura de alquinos. Academia Minas.