Talasemia
La talasemia es un tipo de anemia del grupo de anemias hereditarias. Esta condición genética confiere resistencia a la malaria, pero causa una disminución de la síntesis de una o más de las cadenas polipeptídicas de la hemoglobina. Hay varios tipos genéticos, con cuadros clínicos que van desde anomalías hematológicas difícilmente detectables hasta anemia grave y cuadros de enfermedad terminal.
| Talasemia | ||
|---|---|---|
 Herencia mendeliana autosómica recesiva: dos mutaciones de línea germinal (una de cada uno de los padres) para desarrollar la enfermedad; igualmente transmitida por hombres y mujeres. | ||
| Especialidad | hematología | |
| Sinónimos | ||
| Anemia mediterránea. Anemia de Cooley. | ||
Nombre
Proviene del griego θάλασσα: ‘mar’, y αἷμα: ‘sangre’. Literalmente, sería ‘sangre marina’, pero en realidad el término hace referencia al Mar Mediterráneo, ya que en esta zona es más frecuente la enfermedad. Por ello, a veces se denomina también anemia mediterránea.[1]
Prevalencia
Se estima que un 5% de la población mundial es portadora de un gen mutado para la hemoglobina (siendo más frecuente el ser portador de una talasemia que cualquier otra hemoglobinopatía). Unos 300.000 niños nacen cada año con síndromes talasémicos en todo el mundo.[2] La talasemia es muy común en las zonas mediterráneas como el norte de África, el sur de España y de Italia, regiones de Sicilia, Calabria, Apulia y Cerdeña. En estas dos últimas regiones los portadores son más de 700.000 en una población total de poco menos de 7 millones.
Descripción
La talasemia consiste en un grupo de enfermedades de amplio espectro. Estas van desde simples anormalidades asintomáticas en el hemograma hasta una grave y fatal anemia. La hemoglobina del adulto, denominada Hemoglobina A está compuesta por la unión de cuatro cadenas de polipéptidos: dos cadenas alfa (α) y dos cadenas beta (β). Hay dos copias del gen que produce la hemoglobina α (HBA1 y HBA2), y cada uno codifica una α-cadena, y ambos genes están localizados en el cromosoma 16. El gen que codifica las cadenas β (HBB) está localizado en el cromosoma 11.
Es una forma hereditaria de anemia en la que se reduce la síntesis de una o más de las cuatro cadenas de la globina, por lo general las dos α y las dos β, que forman parte de la hemoglobina en los glóbulos rojos de la sangre. La función de la hemoglobina es transportar el oxígeno desde los pulmones hacia los tejidos corporales. En la anemia esta función es insuficiente para satisfacer las necesidades de los tejidos (por ejemplo, los músculos y el cerebro). La palabra talasemia procede del griego y significa mar. Este trastorno se denominó así porque es más frecuente en las personas de origen mediterráneo. Sin embargo, su distribución es mundial. Hay diferentes tipos: las formas principales son las del adulto que se denominan talasemias α o β según estén alterados los genes de la cadena α o β. Su gravedad varía según la configuración genética. Se trata de la enfermedad hereditaria de la sangre más frecuente y, a su vez, es la más frecuente causada por una anomalía en un único gen.
En la talasemia, la estructura de ambas cadenas de la hemoglobina permanecen intactas, pero está ausente la cadena α o β o existe en pequeñas cantidades, debido a anomalías en los genes que codifican estas proteínas. Esto origina un desequilibrio en la cantidad de globina en las cadenas con predominio de la α o β. Las cadenas precipitan en ausencia de otras cadenas suficientes con las que unirse y esta precipitación interfiere con la formación de los glóbulos rojos. Se producen menos glóbulos rojos de lo normal y los que son capaces de desarrollarse incluyen en su interior las cadenas de hemoglobina precipitadas, de tal modo que no pueden pasar a través de los capilares y son destruidos prematuramente. Esto produce una anemia grave y para compensarla, la médula ósea sufre hiperplasia al intentar producir suficientes glóbulos rojos, y el bazo también aumenta de tamaño. Son posibles también las deformidades graves en el cráneo y en los huesos largos.
En la α-talasemia gen HBA1 (OMIM 141800) y HBA2 (OMIM 141850), hay una deficiencia de síntesis de cadenas α. El resultado es un exceso de cadenas β que trasportan deficientemente el oxígeno, lo que conduce a bajas concentraciones de O2 (hipoxemia). Paralelamente, en la β-talasemia (OMIM 141900) hay una falta de cadenas β, y el consiguiente exceso de cadenas alfa puede formar agregados insolubles que se adhieren a la membrana de los eritrocitos, pudiendo causar la muerte de éstos y sus precursores, originando anemia de tipo hemolítico.
Causas moleculares de la enfermedad
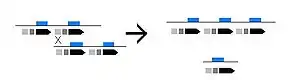
Esta enfermedad está provocada por deleciones en uno o varios genes de los que componen los grupos de la α-globina y la β-globina. Según estas deleciones involucren más o menos genes el tipo de talasemia será más o menos grave.
Estas deleciones provocan la disminución en la producción de cadenas α o β, según el lugar de la deleción; la escasez de cadenas α se intenta compensar con un aumento de la producción de cadenas β, y viceversa, lo que da lugar a la formación de hemoglobinas inestables que provocan la destrucción de los glóbulos rojos y por lo tanto anemia.
A su vez las deleciones parecen ser el resultado de entrecruzamientos desequilibrados entre los segmentos duplicados presentes en la región de la agrupación.
En el caso de las β-talasemias además de la deleción del gen de la β-globina, también pueden darse por otras causas como:
- Mutaciones en el promotor que detienen o reducen su transcripción.
- Mutaciones en los sitios de corte y empalme (splicing) que impiden la eliminación de los intrones.
- Mutaciones en el sitio aceptor de poli-A que afectan al procesamiento del mRNA.
- Mutaciones de cambio en la pauta de lectura.
Síntomas
El defecto o deleción de un gen en la talasemia β causa una anemia hemolítica que oscila entre leve y moderada sin síntoma alguno. La deleción de dos genes ocasionan anemia más grave y la presencia de síntomas: debilidad, fatiga, dificultad respiratoria. En las variantes más graves, como la talasemia beta mayor, pueden aparecer ictericia, úlceras cutáneas, cálculos biliares y agrandamiento del bazo (que en ocasiones llega a ser enorme). La actividad excesiva de la médula ósea puede causar el ensanchamiento y el agrandamiento de algunos huesos, especialmente los de la cabeza y del rostro.
Los huesos largos tienden a debilitarse y fracturarse con gran facilidad. Los niños que padecen ciertas talasemias pueden crecer con más lentitud y llegar a la pubertad más tarde de lo normal. Como la absorción del hierro puede aumentar como respuesta a la anemia sumado al requerimiento de transfusiones de sangre frecuentes (las cuales suministran más hierro), es posible que se acumulen cantidades excesivas de hierro y se depositen en la musculatura del corazón, causando insuficiencia cardíaca.
Las talasemias son más difíciles de diagnosticar que otros trastornos de la hemoglobina. El análisis de una gota de sangre por electroforesis puede ser útil pero no concluyente, en especial en el caso de talasemia alfa. Por lo tanto, el diagnóstico se basa habitualmente en patrones hereditarios y en análisis especiales de hemoglobina. Por lo general, las personas que padecen talasemia no requieren tratamiento alguno, pero aquellas con variantes graves pueden requerir un trasplante de médula ósea. La terapia con genes se encuentra en fase de investigación.
Ventaja de sufrir alfa talasemia
Como ocurre en el más conocido caso de la anemia de células falciformes, también la α-talasemia protege a los individuos que la portan frente a la malaria. La malaria o paludismo está producida por un parásito protista del género Plasmodium y es transmitida por un mosquito del género Anopheles. La protección frente a esta enfermedad por parte de los individuos que posee α-talasemia es debida a que Plasmodium solo es capaz de parasitar a los eritrocitos sanos. Sin embargo, la sangre de alguien con este tipo de anemia presenta un número elevado de eritrocitos deformes por culpa de que la hemoglobina no está bien constituida y eso es esencial pues deja al parásito indefenso en la sangre permitiendo que nuestro sistema inmunitario acabe con él.
La ventaja del heterocigoto se produce cuando un alelo que es deletéreo en su forma homocigótica, resulta, en cambio ventajoso en su forma heterocigótica. Este fenómeno es lo que se llama polimorfismo equilibrado. Significa que la selección negativa del alelo en estado homocigótico se equilibra con la selección positiva a favor del alelo en el estado heterocigótico.
Debido a esto hay una alta frecuencia de talasemias, y en general de hemoglobinopatías en los países con malaria endémica, de modo que la distribución geográfica de la malaria se correlaciona con la de talasemias.
Clasificación
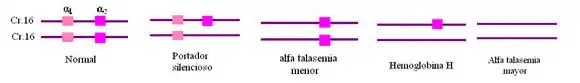
- α Talasemia rasgo (portador). Las mutaciones de la cadena α en el cromosoma 16 afecta a uno de los genes de un cromosoma causando una talasemia silenciosa (asintomática) caracterizada por algunas hemoglobinas con tres β y una α globina. Los portadores pueden tener mutaciones de la cadena α en dos cromosomas (16) afectando a un genes de cada cromosoma (o bien los dos genes de un solo cromosoma, estando normales los dos del cromosoma homólogo) causando una talasemia leve (puede ser asintomática) caracterizada por hemoglobinas con tres β y una α globina. Debido a que existen suficientes genes sin mutación en la cadena α la mayoría de las moléculas de hemoglobina tienen las respectivas dos cadenas α y dos β. La mayoría de los portadores de la α talasemia no lo saben y se descubre con análisis de ADN y biología molecular.[3]
- α Talasemia grave (Hemoglobina H). Las mutaciones de la cadena α en el cromosoma 16 afecta a tres de los genes (involucrando a ambos cromosomas homólogos) causando una talasemia grave caracterizada por la mayoría de las hemoglobinas con tres cadenas β y una α globina. Los afectados cursan con hemólisis intravascular causando anemia grave con los síntomas más intensos.
- α talasemia mayor (enfermedad de Bart). Las mutaciones de la cadena α en el cromosoma 16 afecta a los cuatro genes (involucrando a ambos cromosomas homólogos) causando un hidropesía fetal caracterizada por hemoglobinas con solamente cuatro cadenas γ (gamma) y es incompatible con la vida.[4]
- β+ Talasemia Menor (Minor). Las mutaciones de la cadena β en el cromosoma 11 afecta a uno de los genes causando una talasemia relativamente leve caracterizada por una hemoglobina con tres α y una β globina. Puede que no haya síntomas como puede que los síntomas sean intermedios entre leve y graves.[5]
- Enfermedad de la hemoglobina H La padecen aquellos individuos que solo poseen una copia funcional del gen de la α-globina. Da lugar a una anemia moderada con inclusiones en los eritrocitos producidas por la hemoglobina H, la cual está formada por cuatro cadenas de β-globina, debida a las pocas que hay del otro tipo. Las manifestaciones clínicas son desde anemia leve a moderada, a veces puede llegar a provocar esplenomegalia.
- βº Talasemia Mayor (Major) o Anemia de Cooley.[6] Las mutaciones de la cadena β en el cromosoma 11 afectan a ambos genes causando la más grave de las talasemias caracterizada por la falta total de β globina. Cuatro cadenas α se combinan en defecto de las cadenas β formando una hemoglobina inestable que tiende a precipitarse en los glóbulos rojos causando daños en la membrana celular e incrementando la fragilidad del hematíe en cuestión. Por razón de la masiva hemólisis dirigida por el bazo, los síntomas son más graves: palidez, suceptibilidad a infecciones, fragilidad ósea, ictericia, depósitos de hierro en el hígado y corazón, y puede que no vivan mucho tiempo.
Diagnóstico
Las pruebas que se hacen para saber si un individuo padece cualquiera de los tipos de talasemia son análisis de sangre, que permiten ver la forma y la cantidad de glóbulos rojos en sangre. Otra forma de diagnosticar la enfermedad es por medio de estudios genéticos. Los cuales nos dan la información exacta del tipo de talasemia y su causa.
Actualmente, el análisis prenatal que se realiza mediante el muestreo de villus coriónico y la amniocentesis permite determinar la presencia o ausencia de talasemia en el feto, de esta forma si se detecta y es una forma grave puede ser tratada precozmente y que el individuo sobreviva.
Tratamiento
- Transfusiones de sangre: es el tratamiento que se utiliza para los tipos más graves de talasemia, como son la β-talasemia mayor. Los individuos que la poseen necesitan transfusiones regularmente, cada 2 o 3 semanas, estas le ayudan a mantener la hemoglobina a niveles casi normales y a prevenir otras complicaciones, como la insuficiencia cardíaca y las deformidades óseas. Hay pacientes de otras talasemias menos graves que requieren esas transfusiones sanguíneas solo ocasionalmente o porque desarrollan una enfermedad vira u otras infecciones, que puedan provocar que la anemia se vuelva más grave.
- Suplemento de ácido fólico: en el caso de que el individuo afectado solo padezca anemia lo que se le suministra es ácido fólico, como para otros tipos de anemias.
- Uso de quelante de hierro: las transfusiones de sangre repetidas pueden resultar en la acumulación de hierro en el organismo. Esta acumulación puede ser perjudicial para el corazón, el hígado y otros órganos. Para prevenir estos daños, los individuos que se someten a transfusiones regularmente reciben un tratamiento con un tipo de medicamento llamado quelante de hierro, actualmente se utiliza la deferoxamina. Este lo que hace es fijar el hierro y de esa manera se ayuda al organismo a deshacerse del exceso de este. La cantidad de hierro que tiene un individuo en sangre se mide por análisis de sangre, el problema es que no miden con demasiada precisión los niveles de hierro en el corazón e hígado, para eso hay que recurrir a una biopsia. Por eso la mayoría de los pacientes de talasemias graves que mueren es debido a ese acúmulo de hierro.
- Trasplante de médula ósea: es tratamiento curativo. Este método es eficaz cuando el donante es perfectamente compatible desde el punto de vista genético, lo más compatibles son los miembros de la familia, como por ejemplo un hermano del individuo afectado. Con el trasplante de médula se logra curar al 85% de los individuos que consiguen un donante compatible. Sin embargo, solo el 30% de los pacientes de talasemia consiguen un miembro de la familia que esté en condiciones de ser donante. El procedimiento es arriesgado y puede llevar a la muerte del paciente. Actualmente también se está utilizando para la cura de esta anemia y de otras la sangre del cordón umbilical de un hermano recién nacido y está siendo tan eficaz como el trasplante de médula ósea. Al igual que la médula ósea, la sangre del cordón posee células indiferenciadas, lo que se llama células madre que producen todas las demás células sanguíneas. Como ejemplo de este último método está el caso del niño sevillano que sufría beta talasemia mayor y que gracias a la sangre del cordón umbilical de su hermano recién nacido se ha curado. Ese hermano para que fuese donante totalmente compatible con el niño ha sido seleccionado genéticamente, siendo el primer bebé cuyo proceso de gestación y tratamiento genético ha tenido lugar íntegramente en España.[7]
- Terapia génica: por ser la beta-talasemia una enfermedad causada por un único gen ha sido objeto de estudio de la terapia génica. Los estudios con vectores retrovirales han demostrado su inestabilidad para transportar el gen de la beta-globina humana. Los mayores avances se han logrado empleando vectores lentivirales, con los cuales se consigue estabilizar la expresión de la beta-globina. Hasta el momento, los estudios en ratones han mostrado la corrección de la beta-talasemia en casos de media gravedad y mejoras parciales y variables cuando el fenotipo era grave. Mediante terapia génica in vitro empleando eritrocitos humanos de pacientes con beta-talasemias graves se ha conseguido restaurar una eritropoyesis funcional y revertir el elevado radio de apoptosis que caracteriza la beta-talasemia. El xenotrasplante de estas células en ratones obtuvo resultados positivos. No obstante, la terapia génica sigue en fases de ensayo clínico para esta enfermedad.[8]
Notas
- Entrada sobre talasemia en MedlinePlus
- Organización Mundial de la Salud. Consejo Ejecutivo, reunión 11 de mayo de 2006. Si hombre y ya esta.
- CLASIFICACIÓN AUTOMÁTICA DE RASGOS TALASÉMICOS Y OTRAS ANEMIAS MICROCÍTICAS E HIPOCROMICAS Javier Vicente y col. Universidad Politécnica de Valencia. Grupo de Bioingeniería, Electrónica y Telemedicina y Hospital Universitario Dr. Peset. Servicio de Hematología. Valencia España
- Mauro Parra C. y col. ACTUALIZACIÓN EN EL DIAGNÓSTICO Y MANEJO DE ALTERACIONES HEMATOLÓGICAS DEL FETO Rev Chil Obstet Ginecol 2005; 70(1): 33-40
- HEMOGLOBINOPATÍAS Y TALASEMIAS J.J. Malcorra. BSCP Can Ped 2001; 25- no 2
- Yale Medical Group, the physicians of Yale University on the web.
- Márquez, Noelia. Diario de Sevilla. Un trasplante pionero libra a un niño de padecer una enfermedad congénita. Sevilla, publicado el 14.03.2009. Consultado el 27 de mayo de 2011
- Puthenveetil, Geetha (2004). «Successful correction of the human beta-thalassemia major phenotype using a lentiviral vector». Blood 104 (3445-3453).
Bibliografía
- Peter Sudbery, 2004, Genética Molecular Humana, 2ª edición, Pearson
- Nusboum, McInnes, Willard, 2004, Thompson & Thompson Genética en Medicina, 5º edición, Masson.
Enlaces externos
- Asociación Española de lucha contra las hemoglobinopatías y Talasemias
- Fundación Argentina de Talasemia
- MedlinePlus Temas de salud: Talasemias.
- Manual Merck Capítulo 154: Anemias.
- http://www.saludinfantil.com/talasemia.htm
- http://cienciaaldia.wordpress.com/2009/05/08/dia-internacional-de-la-talasemia/
- https://web.archive.org/web/20100324100156/http://www.publispain.com/revista/la-talasemia-o-anemia-mediterranea.htm
- http://www.ncbi.nlm.nih.gov/pubmed/20008179?itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum&ordinalpos=8
- http://www.comtf.es/pediatria/Bol-2001-2/Hemoglobinopat%C3%ADas%20y%20Talasemias.pdf
- http://apps.who.int/gb/ebwha/pdf_files/EB118/B118_5-sp.pdf