Bioerosión
La bioerosión es la remoción de sustratos minerales o líticos por la acción directa de organismos vivos.[1] Puede ocurrir tanto en el medio terrestre como marino. La bioerosión marina puede ser causada por moluscos, gusanos poliquetos, forónidos, esponjas, crustáceos, equinoides y peces; puede ocurrir en las costas, en los arrecifes de coral y en los barcos; sus mecanismos incluyen la perforación biótica, la perforación, y el raspado. En tierra firme, la bioerosión suele ser realizada por plantas pioneras u organismos similares a las plantas, como el liquen, y en su mayor parte es de carácter químico (por ejemplo, mediante secreciones ácidas en la piedra caliza) o mecánico (por ejemplo, mediante las raíces que crecen en las grietas) en la naturaleza.

Bioerosión en arrecifes coralinos
La bioerosión en los arrecifes coralinos es un proceso que influye directamente en sustrato arrecifal carbonatado depositado en forma de esqueletos por parte de organismos calcificadores como los corales hermatípicos o algas calcáreas.[2] Determina la producción y transporte de sedimentos que caracterizan estos ecosistemas, incluida la arena fina y blanca característica de las playas tropicales. También influye directamente en el relieve del sustrato arrecifal, así como en la capacidad de crecimiento o acreción arrecifal, que depende no solo de la cantidad de carbonato de calcio producido y depositado por los organismos calcificadores (i.e., tasa conocida como producción bruta de carbonato de calcio), si no también de cuánto carbonato es retirado por procesos de erosión.[3][4] Los organismos que erosionan son conocidos como bioerosionadores. Los cuales pueden catalogarse como internos o externos.

Por su capacidad de remover carbonato de calcio, los principales bioerosionadores internos incluyen esponjas erosionadoras como algunas especies del género Cliona, bivalvos como Lithophaga, poliquetos como Aspidosiphon sp., entre otros macrobioerosionadores; así como algunos microorganismos incluyendo cianobacterias como Plectonema terebrans, clorófitas como Ostreobium quekettii, hongos, foraminíferos, etc.[5][2] A través de su actividad, estos organismos generan sedimento extremadamente fino con diámetros de 10 a 100 micrómetros.
Entre los bioerosionadores externos se encuentran algunas especies de peces loro (Scaridae), que en arrecifes del Caribe pueden remover hasta el 70% de todo el carbonato erosionado al año. Una de las fuentes de alimento de estos peces son algas microscópicas que viven tanto en la capa superficial del coral, como en los primeros milímetros de este, por los que los peces loro muerden el coral (sobre todo corales muertos) para extraerlas. Esto, gracias a que poseen una dentadura fusionada a modo de pico, así como los músculos de la mandíbula bien desarrollados, y un molino faríngeo, para penetrar el sustrato arrecifal y extraer su alimento.[6][7] Este grupo de peces es capaz de remover en promedio hasta cerca de 4 kg de CaCO3 m-2 año-1.[8] Otro importante grupo de erosionadores son los erizos de mar como Diadema antillarum, así como especies del género Echinometra y Eucidaris. Se considera que hasta antes de la mortalidad masiva que sufrieron los erizos Diadema en la década de los 1980s[9] estos organismos podían remover hasta más de 5 kg de CaCO3 m-2 año-1,[8] mientras que los otros géneros de erizo removían hasta casi 4 kg de CaCO3 m-2 año-1.[8] En los últimos años la bioerosión ha disminuido significativamente en varios sitios debido a la reducción de las poblaciones de los diferentes organismos bioerosionadores. Sin embargo, dado que la producción de carbonato de calcio también ha disminuido, la bioerosión mantiene un rol muy importante en los procesos que ocurren en estos ecosistemas.
La bioerosión también es muy conocida en el registro fósil de conchas y suelos duros (Bromley, 1970), con rastros de esta actividad que se remontan hasta bien entrado el Precámbrico (Taylor & Wilson, 2003). La macrobioerosión, que produce perforaciones visibles a simple vista, muestra dos radiaciones evolutivas distintas. Una se produjo en el Ordovícico Medio (la revolución de la bioerosión del Ordovícico; véase Wilson & Palmer, 2006) y la otra en el Jurásico (véase Taylor & Wilson, 2003; Bromley, 2004; Wilson, 2007). La microbioerosión también tiene un largo registro fósil y sus propias radiaciones (véase Glaub & Vogel, 2004; Glaub et al., 2007).
Bioerosiones debidas a depredaciones
Artículo principal: Oichnus
Un conjunto de bioerosiones de forma circular, que usualmente atraviesa de lado a lado el sustrato perforado se engloba en el icnogénero Oichnus. Se los halla normalmente en conchas de moluscos como bivalvos y gastrópodos, aunque también en cirrípedos, serpúlidos, escafópodos y otros organismos invertebrados. Las trazas de Oichnus, corresponden mayormente a actividades de depredación en las que el depredador perfora la conchilla de la presa para alimentarse de ella. De este modo, a partir del estudio de este tipo de marcas se puede abordar la investigación de la incidencia de las interacciones bióticas, en este caso, la depredación, sobre la biodiversidad y la evolución.[10][11]
Galería
 Taladros de Trypanites en un terreno duro del Ordovícico Superior, al sudeste de Indiana; véase Wilson y Palmer (2001).
Taladros de Trypanites en un terreno duro del Ordovícico Superior, al sudeste de Indiana; véase Wilson y Palmer (2001). Perforaciones de Petroxestes en un terreno duro del Ordovícico Superior, en el sur de Ohio; véase Wilson y Palmer (2006).
Perforaciones de Petroxestes en un terreno duro del Ordovícico Superior, en el sur de Ohio; véase Wilson y Palmer (2006). Perforaciones de Gastrochaenolites en un terreno duro del Jurásico Medio, al sur de Utah; véase Wilson y Palmer (1994).
Perforaciones de Gastrochaenolites en un terreno duro del Jurásico Medio, al sur de Utah; véase Wilson y Palmer (1994).
 Sección transversal de un terreno rocoso del Jurásico; las perforaciones incluyen Gastrochaenolites (algunas con bivalvos perforadores en su lugar) y Tripanites; Mendip Hills, Inglaterra; barra de escala = 1 cm.
Sección transversal de un terreno rocoso del Jurásico; las perforaciones incluyen Gastrochaenolites (algunas con bivalvos perforadores en su lugar) y Tripanites; Mendip Hills, Inglaterra; barra de escala = 1 cm. Teredolites taladrados en un muelle moderno; acción de los bivalvos conocidos como "gusanos de barco".
Teredolites taladrados en un muelle moderno; acción de los bivalvos conocidos como "gusanos de barco". Sección transversal del suelo duro del Ordovícico con perforaciones de tripanitas rellenas de dolomita; sur de Ohio.
Sección transversal del suelo duro del Ordovícico con perforaciones de tripanitas rellenas de dolomita; sur de Ohio. Gastrochaenolitas perforadas en un coral escleractínico recristalizado, Formación Matmor (Jurásico Medio) del sur de Israel.
Gastrochaenolitas perforadas en un coral escleractínico recristalizado, Formación Matmor (Jurásico Medio) del sur de Israel.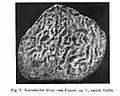 Perforaciones de Osprioneides en un estromatoporoide silúrico de Saaremaa, Estonia; véase Vinn, Wilson y Mõtus (2014).
Perforaciones de Osprioneides en un estromatoporoide silúrico de Saaremaa, Estonia; véase Vinn, Wilson y Mõtus (2014)._3_(16135152988).jpg.webp) Gnathichnus pentax traza fósil en una ostra del Cenomaniano de Hamakhtesh Hagadol, al sur de Israel.
Gnathichnus pentax traza fósil en una ostra del Cenomaniano de Hamakhtesh Hagadol, al sur de Israel.- Estructura geopétalica en perforación bivalva en el coral; concha bivalva visible; Formación Matmor (Jurásico Medio), sur de Israel.
 Taladros en un briozoario del Ordovícico Superior, Formación Bellevue, norte de Kentucky; sección transversal pulida.
Taladros en un briozoario del Ordovícico Superior, Formación Bellevue, norte de Kentucky; sección transversal pulida. Perforación de depredación en valva de Nacella magellanica.
Perforación de depredación en valva de Nacella magellanica.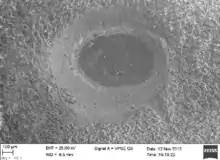 Ejemplar de la perforación de depredación Oichnus simplex incompleto en una concha de Nacella magellanica
Ejemplar de la perforación de depredación Oichnus simplex incompleto en una concha de Nacella magellanica
Véase también
- Geomorfología - El estudio científico de las formas terrestres y los procesos que las conforman.
- Biogeomorfología - Estudio de las interacciones entre los organismos y el desarrollo de las formas terrestres
- Erosión costera - La pérdida o desplazamiento de tierra a lo largo de la costa debido a la acción de las olas, corrientes, mareas. agua impulsada por el viento, hielo en el agua, u otros impactos de las tormentas
- Océano - Una masa de agua que compone gran parte de la hidrósfera de un planeta.
Referencias
- Neumann, A. C. (1966). «Observations on coastal erosion in Bermuda and measurements of the boring rate of the sponge, Cliona LAMPA 1, 2». Limnology and Oceanography. Consultado el 23 de septiembre de 2022.
- Glynn, Peter W.; Manzello, Derek P. (2015). Birkeland, Charles, ed. Bioerosion and Coral Reef Growth: A Dynamic Balance (en inglés). Springer Netherlands. pp. 67-97. ISBN 978-94-017-7249-5. doi:10.1007/978-94-017-7249-5_4. Consultado el 23 de abril de 2022.
- Perry, Chris T.; Alvarez-Filip, Lorenzo; Graham, Nicholas A. J.; Mumby, Peter J.; Wilson, Shaun K.; Kench, Paul S.; Manzello, Derek P.; Morgan, Kyle M. et al. (2018-06). «Loss of coral reef growth capacity to track future increases in sea level». Nature (en inglés) 558 (7710): 396-400. ISSN 1476-4687. doi:10.1038/s41586-018-0194-z. Consultado el 23 de abril de 2022.
- Chave, Keith E.; Smith, Stephen V.; Roy, Kenneth J. (1 de febrero de 1972). «Carbonate production by coral reefs». Marine Geology (en inglés) 12 (2): 123-140. ISSN 0025-3227. doi:10.1016/0025-3227(72)90024-2. Consultado el 23 de abril de 2022.
- Tribollet, Aline; Golubic, Stjepko (2011). Dubinsky, Zvy, ed. Reef Bioerosion: Agents and Processes (en inglés). Springer Netherlands. pp. 435-449. ISBN 978-94-007-0114-4. doi:10.1007/978-94-007-0114-4_25. Consultado el 23 de abril de 2022.
- Radkhah, Ali Reza; Eagderi, Soheil (1 de abril de 2020). «Hoey AS, Bonaldo RM (eds). 2018. Biology of parrotfishes, CRC Press, Taylor & Francis Group, Boca Raton, 420 pp. ISBN-13: 978-1-4822-2401-6». Ichthyological Research (en inglés) 67 (2): 335-337. ISSN 1616-3915. doi:10.1007/s10228-019-00727-4. Consultado el 23 de abril de 2022.
- Bruggemann, Henrich; van Oppen, Madeleine; Breeman, A.M. (1 de marzo de 1994). «Foraging by the stoplight parrotfish Sparisoma viride. I. Food selection in different, socially determined habitats». Marine Ecology Progress Series 106: 41-55. doi:10.3354/meps106041. Consultado el 23 de abril de 2022.
- Perry, Chris T.; Murphy, Gary N.; Kench, Paul S.; Edinger, Evan N.; Smithers, Scott G.; Steneck, Robert S.; Mumby, Peter J. (7 de diciembre de 2014). «Changing dynamics of Caribbean reef carbonate budgets: emergence of reef bioeroders as critical controls on present and future reef growth potential». Proceedings of the Royal Society B: Biological Sciences 281 (1796): 20142018. PMC 4213658. PMID 25320166. doi:10.1098/rspb.2014.2018. Consultado el 23 de abril de 2022.
- Lessios, H. A. (1988). «Mass Mortality of Diadema Antillarum in the Caribbean: What Have We Learned?». Annual Review of Ecology and Systematics 19: 371-393. ISSN 0066-4162. Consultado el 23 de abril de 2022.
- Archuby, Fernando M.; Gordillo, Sandra (17 de septiembre de 2018). «Drilling predation traces on recent limpets from northern Patagonia, Argentina». Palaeontologia Electronica (en inglés) 21 (3): 1-23. ISSN 1094-8074. doi:10.26879/620. Consultado el 14 de abril de 2023.
- Granville), Bromley, R. G., (Richard (11 de enero de 1981). Concepts in ichnotaxonomy illustrated by small round holes in shells. Universitat de Barcelona. OCLC 746735866. Consultado el 14 de abril de 2023.
- Bellwood, D. R. (1995). «Direct estimate of bioerosion by two parrotfish species, Chlorurus gibbus and C. sordidus, on the Great Barrier Reef, Australia». Marine Biology 121 (3): 419-429. doi:10.1007/BF00349451.
- Bromley, R. G (1970). «Borings as trace fossils and Entobia cretacea Portlock as an example». En Crimes, T.P.; Harper, J.C., eds. Trace Fossils. Geological Journal Special Issue 3. pp. 49-90.
- Bromley, R. G. (2004). «A stratigraphy of marine bioerosion». En D. McIlroy, ed. The application of ichnology to palaeoenvironmental and stratigraphic analysis. Geological Society of London, Special Publications 228. London: Geological Society. pp. 455–481. ISBN 1-86239-154-8.
- Glaub, I.; Golubic, S.; Gektidis, M.; Radtke, G.; Vogel, K. (2007). «Microborings and microbial endoliths: geological implications». En Miller III, W, ed. Trace fossils: concepts, problems, prospects. Amsterdam: Elsevier. pp. 368–381. ISBN 0-444-52949-7.
- Glaub, I.; Vogel, K. (2004). «The stratigraphic record of microborings». Fossils & Strata 51: 126-135. ISSN 0300-9491.
- Palmer, T. J. (1982). «Cambrian to Cretaceous changes in hardground communities». Lethaia 15 (4): 309-323. doi:10.1111/j.1502-3931.1982.tb01696.x.
- Taylor, P. D.; Wilson, M. A. (2003). «Palaeoecology and evolution of marine hard substrate communities». Earth-Science Reviews 62 (1–2): 1-103. Bibcode:2003ESRv...62....1T. doi:10.1016/S0012-8252(02)00131-9. Archivado desde el original el 25 de marzo de 2009.
- Vinn, O.; Wilson, M. A.; Mõtus, M.-A. (2014). «The Earliest Giant Osprioneides Borings from the Sandbian (Late Ordovician) of Estonia». PLoS ONE 9 (6: e99455): e99455. Bibcode:2014PLoSO...999455V. PMC 4047083. PMID 24901511. doi:10.1371/journal.pone.0099455.
- Wilson, M. A. (1986). «Coelobites and spatial refuges in a Lower Cretaceous cobble-dwelling hardground fauna». Palaeontology 29: 691-703. ISSN 0031-0239.
- Wilson, M. A. (2007). «Macroborings and the evolution of bioerosion». En Miller III, W, ed. Trace fossils: concepts, problems, prospects. Amsterdam: Elsevier. pp. 356–367. ISBN 0-444-52949-7.
- Wilson, M. A.; Palmer, T. J. (1994). «A carbonate hardground in the Carmel Formation (Middle Jurassic, SW Utah, USA) and its associated encrusters, borers and nestlers». Ichnos 3 (2): 79-87. doi:10.1080/10420949409386375.
- Wilson, M. A.; Palmer, T. J. (2001). «Domiciles, not predatory borings: a simpler explanation of the holes in Ordovician shells analyzed by Kaplan and Baumiller, 2000». PALAIOS 16 (5): 524-525. Bibcode:2001Palai..16..524W. doi:10.1669/0883-1351(2001)016<0524:DNPBAS>2.0.CO;2.
- Wilson, M. A.; Palmer, T. J. (2006). «Patterns and processes in the Ordovician Bioerosion Revolution». Ichnos 13 (3): 109-112. doi:10.1080/10420940600850505. Archivado desde el original el 16 de diciembre de 2008.
Otras lecturas
- Vinn, O.; Wilson, M.A. (2010). «Occurrence of giant borings of Osprioneides kampto in the lower Silurian (Sheinwoodian) stromatoporoids of Saaremaa, Estonia». Ichnos 17: 166-171. doi:10.1080/10420940.2010.502478. Consultado el 10 de junio de 2014.
- Vinn, O.; Wilson, M.A. (2010). «Early large borings from a hardground of Floian-Dapingian age (Early and Middle Ordovician) in northeastern Estonia (Baltica)». Carnets de Géologie 2010: CG2010_L04. doi:10.4267/2042/35594. Archivado desde el original el 17 de enero de 2020. Consultado el 10 de junio de 2014.
- Vinn, O.; Wilson, M.A.; Toom, U. (2015). «Bioerosion of Inorganic Hard Substrates in the Ordovician of Estonia (Baltica)». PLOS ONE 10 (7): e0134279. Bibcode:2015PLoSO..1034279V. PMC 4517899. PMID 26218582. doi:10.1371/journal.pone.0134279. Consultado el 21 de septiembre de 2015.