Carbonato de amonio
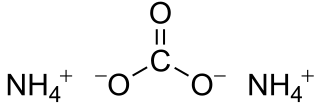
El Carbonato de amonio o Carbonato amónico es una sal con la fórmula química (NH4)2CO3. Actualmente se comercializa como mezcla de compuestos que contiene esta sal a su vez de otras del tipo amónico-carbónicas con el mismo contenido de amonia tales como el carbamato de amonio (NH2CO3NH4) y el bicarbonato de amonio (NH4)HCO3.[2]
| Carbonato de amonio | ||
|---|---|---|
  | ||
 | ||
| Nombre IUPAC | ||
| Carbonato de amonio | ||
| General | ||
| Otros nombres | Carbonato de amonio, sal diamónica, carbonato de diamonio, cuerno de ciervo | |
| Fórmula estructural | (NH4)2CO3 | |
| Fórmula molecular | C1N2H8O3 | |
| Identificadores | ||
| Número CAS | 506-87-6[1] | |
| ChEMBL | CHEMBL2105849 | |
| ChemSpider | 10048 | |
| DrugBank | 15926 | |
| PubChem | 10480 | |
| UNII | PDP691CN28 | |
| KEGG | C01337 | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco con olor amoniacal | |
| Densidad | 1500 kg/m³; 1,5 g/cm³ | |
| Masa molar | 9609 g/mol | |
| Punto de fusión | 331 K (58 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
| |
| Frases R | R22: Nocivo por ingestión | |
| Frases S |
S46: : En caso de ingestión, acúdase inmediatamente al médico y muéstresele la etiqueta o el envase | |
| Riesgos | ||
| Ingestión | Enjuáguese la boca. No provoque el vómito. Llame a un Centro de Información Toxicológica o a un médico si se encuentra mal. Consiga atención médica de emergencia. | |
| Inhalación | En grado excesivo puede causar irritación respiratoria leve. Asegúrese de que respira aire puro. Descansar. | |
| Piel |
Despójese de la ropa afectada y lave toda la zona de piel expuesta al producto con jabón suave y agua; a continuación, enjuague con agua caliente. | |
| Ojos |
Enjuague inmediatamente con abundante agua. Consiga atención médica si persiste el dolor o la irritación. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Usos
Ha sido y sigue siendo, en algunos casos, utilizado como levadura química en polvos para hornear, para leudar la masa, de manera análoga al bicarbonato de sodio. Sin embargo en general se ha dejado de emplear debido al mal olor del amoniaco gaseoso desprendido, que puede permanecer ocluido en la masa y se ha sustituido por el bicarbonato de sodio. También se emplea en el curtido de algunas pieles, la tinción de algunos tejidos, como medicamento o como componente de sales aromáticas,[3] y como aditivo para la regulación de acidez en la industria agroalimentaria bajo el código E503.[4]
Producción
El carbonato de amonio se sintetiza mediante la combinación de amoniaco y dióxido de carbono en medio acuoso refrigerado mediante la reacción:[5]
- 2NH3 + H2O + CO2 → (NH4)2CO3
Otra vía para su síntesis es mediante la combinación de carbonato cálcico con sulfato amónico:
- (NH4)2SO4 + CaCO3 → (NH4)2CO3 + CaSO4
Química
El carbonato amónico se descompone espontáneamente en bicarbonato de amonio y amoniaco:
- (NH4)2CO3 → (NH4)HCO3 + NH3 (g)
Referencias
- Número CAS
- Carbonato de amonio, o amónico. Enciclonet, 2013
- Carbonato de amonio-NJ. Health
- E-503-Carbonatos de amonio. Food-Info
- Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
