Catecol
Catecol, también conocido como pirocatecol, es un compuesto químico cuyo nombre sistemático según la IUPAC es 1,2-dihidroxibenceno u orto-dihidroxibenceno. Tiene fórmula molecular C6H4(OH)2 y es uno de los tres isómeros del bencenodiol. Es un compuesto que se encuentra en la naturaleza en forma de trazas.
| Catecol | ||
|---|---|---|
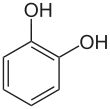 Fórmula del catecol. | ||
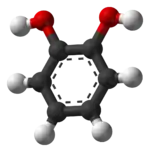 Estructura tridimensional. | ||
| General | ||
| Otros nombres |
pirocatecol 1,2-bencenodiol 2-hidroxifenol 1,2-dihidroxibenceno | |
| Fórmula estructural |
 | |
| Fórmula molecular | C6H6O2 | |
| Identificadores | ||
| Número CAS | 120-80-9[1] | |
| Número RTECS | UX1050000 | |
| ChEBI | 18135 | |
| ChEMBL | CHEMBL280998 | |
| ChemSpider | 283 | |
| DrugBank | 02232 | |
| PubChem | 289 | |
| UNII | LF3AJ089DQ | |
| KEGG | C00090 | |
|
Oc1c(O)cccc1
| ||
| Propiedades físicas | ||
| Masa molar | 110,037 g/mol | |
| Propiedades químicas | ||
| Acidez | 9.5 pKa | |
Se creía que era precursor de las catecolaminas, pero luego se demostró que su ruta de síntesis viene de la tirosina.[2]
El catecol se produce industrialmente con la hidroxilación de fenol usando peróxido de hidrógeno:[3]
- C6H5OH + H2O2 → C6H4(OH)2 + H2O
Aislamiento y síntesis
El catecol fue aislado, por primera vez, en 1839 por Edgar Hugo Emil Reinsch (1809 - 1884) al destilarlo de la preparación tanica catequina, la cual es el residuo del catecú, el jugo hervido o concentrado de la Mimosa catechu (Acacia catechu). Al calentar la catequina arriba de su punto de descomposición, una sustancia que Reinsch llamó, primeramente, Brenz-Katechusäure (ácido de catecú quemado) se sublima como una eflorescencia blanca. Esta fue una descomposición térmica producto de flavanoles en catequina. En 1841, ambos Wackenroder y Zwenger, independientemente, redescubrieron el catecol, en informe de sus descubrimientos, la Philosophical Magazine acuñó el nombre pirocatequina. Por 1852, Erdman se dio cuenta que el catecol era un benceno con dos átomos de oxígeno añadidos a él; en 1867, August Kekulé se dio cuenta que el catecol era un diol de benceno, así que para 1868, el catecol fue listado como pirocatecol. En 1879, el Journal of the Chemical Society recomendó que el catecol fuese llamado "catecol", y en el año siguiente, fue listado como tal.
El catecol se ha visto que ocurre naturalmente en forma libre en el kino de la India y en el alquitrán de haya. Su ácido sulfúrico ha sido detectado en la orina de caballos y humanos.
El catecol es producido industrialmente por la hidroxilación del fenol, utilizando peróxido de hidrógeno.
Puede ser producido por reacción de salicilaldehído con base y peróxido de hidrógeno (Oxidación de Dakin), tanto como la hidrólisis de 2 fenoles sustituidos, especialmente 2-clorofenol, con soluciones acuosas calientes que contienen hidróxidos metálicos alcalinos. Su derivado éter metil, el guaiacol, se convierte a catecol vía hidrólisis del enlace CH3-O como promovido por el ácido hidroiódico (HI).
Reacciones
Química orgánica
Como otros derivados del benceno disfuncionales, el catecol ya se condensa para formar compuestos heterocíclicos. Los ésteres cíclicos son formados sobre tratamiento con electrófilos de dicloro. Por ejemplo, utilizando tricloruro de fósforo o oxícloruro de fósforo da el cíclico clorofosfonito o clorofosfonato, respectivamente; el cloruro de sulfurilo da el sulfato; y el fosgeno (COCl2) da el carbonato:
donde X = PCl ó POCl; SO2; CO
Con iones de metal
Las soluciones básicas de catecol reaccionan con hierro(III) para dar el rojo [Fe(C6H4O2)3]3-. El cloruro de hierro da una coloración verduzca con la solución acuosa, mientras la solución alcalina, rápidamente, cambia a verde y, finalmente, a un color negro expuesto al aire. Las enzimas dioxigenasa cataliza la división de enlaces del catecol.
Química Redox
Los catecoles se convierten a la semiquinona radical. At pH = 7, esta conversión ocurre a 100 mV:
Para la redox de la semiquinona radical para el catecolato dianion, el potencial fluctua desde 530 a 43 mV como el pH varía desde 7 a 13.5:
El catecol es producido por una reducción de 2 electrones, 2 protones de 1,2-benzoquinona (E0 = +795 mV vs SHE; Em (a pH 7) = +380 mV vs SHE).
La serie redox catecolato dianion, semiquinonato monoanionico, y benzoquinona son llamados colectivamente dioxolenos. Los dioxolenos pueden funcionar como ligante para iones metálicos.
Ocurrencia natural
Pequeñas cantidades de catecol ocurren naturalmente en frutas y vegetales, a lo largo con la enzima polifenol oxidasa (también conocida como catecolasa, o catecol oxidasa). Sobre mezclar la enzima con el sustrato y exponer al oxígeno (como cuando la papa o manzana se corta y se deja afuera), el catecol sin color se oxida a pigmentos melanoides rojo-cafesosos, derivados de la benzoquinona. La enzima esta inactivada al añadir un ácido, tal como el ácido cítrico contenido en el jugo de limón. Excluir el oxígeno también previene la reacción de pardeamiento. Pero, la actividad de la enzima se incrementa en temperaturas bajas. La benzoquinona se dice que es antimicrobial, una propiedad que desacelera el podrido de frutas dañadas o otras partes de la planta.
Usos del Catecol
Aproximadamente, el 50% del catecol sintético se consume en la producción de pesticidas, el resto siendo utilizado como un precursor de la química fina tal como perfumes y farmacéuticos. Es un bloque de construcción en la síntesis orgánica. Varios saborizantes y fragancias industrialmente significativos son preparados comenzando con el catecol. El guaiacol es preparado por metilación de catecol y es entonces convertido en vanilina en una escala de cerca de 10M kg por año (1990). El monoétil eter del catecol, guetol, es convertido a etilvanilina, un componente de las reposterías de chocolate. El 3-trans-isocamfilciclohexanol, ampliamente utilizado como un reemplazo del aceite de madera de sándalo, se prepara desde el catecol vía guaiacol y camfor. El Piperonal, una esencia floral, es preparada desde el diéter metileno de catecol por condensación con glioxal y decarboxilación.
El catecol es utilizado como un desarrollador fotográfico blanco y negro, pero, excepto para algunas aplicaciones de propósito especial, su uso es largamente histórico. Se rumorea haber sido utilizado, brevemente, en el desarrollador HC-110 de Eastman Kodak y se rumorea ser un componente en el desarrollador Neofin Blau de Tetenal. Es un componente clave del Finol de Moersch Photochemie en Alemania. El desarrollo de catecol moderno fue pionero por el notable fotógrafo Sandy King. Su formulación "PyroCat" es popular entre fotógrafos de cine blanco y negro El trabajo de King desde entonces ha inspirado desarrollos del siglo XXI por otros tales como Jay De Fehr con Hypercat y desarrolladores de Obsidian Acqua, entre otros.
Nomenclatura
Aunque raramente se encuentran, el oficial "nombre preferido por la IUPAC" (PIN) del catecol es benzeno-1,2-diol. El nombre trivial pirocatecol es un nombre IUPAC retenido, de acuerdo a la 1993 Recommendations for the Nomenclature of Organic Chemistry.
Referencias
- Número CAS
- Anti-inflammatory effects of catechols in lipopolysaccharide-stimulated microglia cells: Inhibition of microglial neurotoxicity. European Journal of Pharmacology, Volumen 588, Issue 1, 24 de junio 2008, pp. 106-113
- Helmut Fiegel, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus "Phenol Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002: Weinheim. DOI: 10.1002/14356007.a19_313. Art. online: 15 de junio de 2000.
![]() Este artículo incorpora texto de una publicación sin restricciones conocidas de derecho de autor:
Este artículo incorpora texto de una publicación sin restricciones conocidas de derecho de autor: ![]() Varios autores (1910-1911). «Encyclopædia Britannica». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Encyclopædia Britannica». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Catecol.
Wikimedia Commons alberga una categoría multimedia sobre Catecol. Wikcionario tiene definiciones y otra información sobre catecol.
Wikcionario tiene definiciones y otra información sobre catecol.