Cdk1
La cinasa dependiente de ciclina 1, también conocida como Cdk1 o Cdc2 (de sus siglas en inglés "cell division control protein 2 homolog"), es una proteína muy conservada que funciona como una serina/treonina proteína cinasa, y juega un papel clave en la regulación del ciclo celular.[1] Esta proteína ha sido muy estudiada en las levaduras S. cerevisiae y S. pombe, donde es codificada por los genes cdc28 y cdc2, respectivamente.[2] En humanos, Cdk1 es codificada por el gen cdc2.[3] Junto el resto de ciclinas, Cdk1 forma un complejo que fosforila numerosos y diversos sustratos diana. La fosforilación de estas proteínas controlan la progresión del ciclo celular.
| Cinasa dependiente de ciclina 1 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||
| Identificadores | ||||
| Símbolos | cdc2 (HGNC: 1722) CDC28A, CDK1, DKFZp686L20222, MGC111195 | |||
| Identificadores externos | ||||
| Locus | Cr. 10 q21.2 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
Estructura
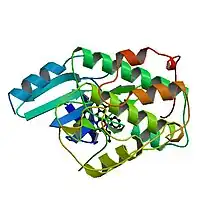
Cdk1 es una proteína pequeña (de aproximadamente unos 34 kDa) altamente conservada. El homólogo humano de Cdk1, cdc2, comparte una identidad en su secuencia de aminoácidos de aproximadamente el 60-65% con respecto a la proteína de levadura. Además, cdc2 es capaz de sustituir a su homólogo cdc28 en un mutante de levadura para ese gen.[4][5] Cdk1 se compone principalmente por un motivo proteína cinasa, que comparte con otras cinasas. Y, al igual que otras cinasas, Cdk1 contiene un surco donde encaja la molécula de ATP. Los sustratos de Cdk1 se unen cerca de la apertura del surco, donde se cataliza la unión covalente del γ-fosfato al átomo de oxígeno del grupo hidroxilo de los residuos serina/treonina del sustrato.
Además de este sitio catalítico, Cdk1, al igual que sucede con otras cinasas dependientes de ciclinas, contiene un bucle T (T-loop) el cual, en ausencia de interacción con una ciclina, impide la unión del sustrato al sitio activo de Cdk1. Cdk1 también contiene una hélice PSTAIRE, la cual, tras la unión de la ciclina, se mueve y reorganiza el sitio activo, facilitando la actividad cinasa.[6]
Función
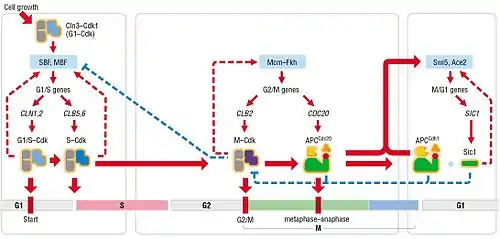
Cuando se une a sus correspondientes ciclinas, la fosforilación de Cdk1 controla la progresión del ciclo celular. La actividad de Cdk1 es mejor conocida en S. cerevisaie, razón por la cual es la actividad descrita a continuación. En esta levadura, la entrada en el ciclo celular es controlada por dos complejos reguladores, SBF (factor de unión a SCB) y MBF (factor de unión a MCB). Estos dos complejos controlan la transcripción de genes implicados en el paso G1/S, pero normalmente están inactivos. SBF es inhibido por la proteína Whi5, pero, cuando es fosforilada por el complejo Cln3-Cdk1, Whi5 es traslocada fuera del núcleo celular, permitiendo así la transcripción del regulón G1/S, el cual incluye las ciclinas Cln1 y Cln2.[7] La actividad de estas ciclinas prepara la entrada en la fase S del ciclo celular (por ejemplo, favoreciendo la duplicación de los centrómeros) y da lugar al aumento de ciclinas S (Clb5 y Clb6 en S. cerevisiae). El complejo Clb5,6-Cdk1 controla directamente el inicio del origen de replicación;[8] sin embargo, dicho complejo es inhibido por Sic1, evitando un inicio prematuro de la fase S.
La actividad de los complejos Cln1,2 y Clb5,6-Cdk1 promueve la degradación de Sic1, permitiendo así la entrada en la fase S. Finalmente, la fosforilación llevada a cabo por las ciclinas M (Clb1, Clb2, Clb3 y Clb4) acomplejadas con Cdk1 da lugar al ensamblaje del huso mitótico y al alineamiento de las cromátidas. La fosforilación de Cdk1 también conduce a la activación de ubiqitina ligasa APCCdc20, lo que permite la segregación de las cromátidas y la degradación de las ciclinas M. Esta destrucción de las ciclinas M conduce a los últimos eventos de la mitosis (desensamblaje del huso, salida de la fase M, etc).
Regulación
Dado su papel esencial en la progresión del ciclo celular, Cdk1 se encuentra fuertemente regulada. La regulación más inmediata es la que viene dada por su unión con sus respectivas ciclinas. La unión con las ciclinas altera el acceso al sitio activo de Cdk1, permitiendo su actividad. Además, las ciclinas confieren especificidad a la actividad de Cdk1. Al menos algunas ciclinas contienen una región hidrofóbica que podría interaccionar directamente con los sustratos, confiriendo así especificidad a las dianas.[9] Además, las ciclinas pueden actuar como marcadores en Cdk1 de modo que sea dirigido a diversas y particulares localizaciones subcelulares.
Por otro lado, Cdk1 también puede ser regulada por fosforilación de un residuo de tirosina conservado (Tyr15 en humanos), que está implicado en la inhibición de Cdk1. Esta fosforilación parece alterar la orientación del ATP, impidiendo que la actividad cinasa sea eficiente. Por ejemplo, en S. pombe, la síntesis incompleta de ADN podría conducir a la estabilización de esta fosforilación y así evitar la progresión de la mitosis.[10] La cinasa Wee1, conservada en todos los eucariotas, fosforila el residuo de Tyr15, mientras que fosfatasas de la familia Cdc25, contrarrestan esta actividad. El balance entre ambos parece ayudar en el control de la progresión del ciclo celular. La expresión de Wee1 es controlada por Cdr1, Cdr2 y Pom1.
Los complejos Cdk1-ciclina también son regulados por la unión directa de proteínas inhibidoras de Cdks (CKIs). Una de estas proteínas, previamente presentada, es Sic1. Sic1 es un inhibidor estequiométrico que se une directamente a los complejos Clb5,6-Cdk1. La fosforilación múltiple del complejo Cdk1-Cln1/2 sobre Sic1 parece ser la responsable de promover la ubiquitinación y posterior destrucción de Sic1, y como consecuencia, la entrada en la fase S. Sólo cuando la inhibición producida por Sic1 es superada, la actividad de Clb5,6 puede tener lugar y así comenzar la fase S.
Interacciones
La proteína Cdk1 ha demostrado ser capaz de interaccionar con:
Véase también
Referencias
- Morgan, David L. (2007). The cell cycle: principles of control. London: New Science Press. pp. 30-31. ISBN 0-19-920610-4.
- Nasmyth K (abril de 1993). «Control of the yeast cell cycle by the Cdc28 protein kinase». Curr. Opin. Cell Biol. 5 (2): 166-79. PMID 8507488.
- Lee MG, Nurse P (Jun de 1987). «Complementation used to clone a human homologue of the fission yeast cell cycle control gene cdc2». Nature 327 (6117): 31-5. PMID 3553962. doi:10.1038/327031a0.
- Ninomiya-Tsuji J, Nomoto S, Yasuda H, Reed SI, Matsumoto K (octubre de 1991). «Cloning of a human cDNA encoding a CDC2-related kinase by complementation of a budding yeast cdc28 mutation». Proc. Natl. Acad. Sci. U.S.A. 88 (20): 9006-10. PMC 52640. PMID 1717994.
- De Bondt HL, Rosenblatt J, Jancarik J, Jones HD, Morgan DO, Kim SH (junio de 1993). «Crystal structure of cyclin-dependent kinase 2». Nature 363 (6430): 595-602. PMID 8510751. doi:10.1038/363595a0.
- Jeffrey PD, Russo AA, Polyak K, Gibbs E, Hurwitz J, Massagué J, Pavletich NP (julio de 1995). «Mechanism of CDK activation revealed by the structure of a cyclinA-CDK2 complex». Nature 376 (6538): 313-20. PMID 7630397. doi:10.1038/376313a0.
- Skotheim JM, Di Talia S, Siggia ED, Cross FR. (julio de 2008). «Positive feedback of G1 cyclins ensures coherent cell cycle entry.». Nature 454 (7202): 291-6. PMID 18633409.
- Cross FR, Yuste-Rojas M, Gray S, Jacobson MD. (julio de 1999). «Specialization and targeting of B-type cyclins.». Mol Cell. 4 (1): 11-9. PMID 10445023.
- Brown NR, Noble ME, Endicott JA, Johnson LN (noviembre de 1999). «The structural basis for specificity of substrate and recruitment peptides for cyclin-dependent kinases». Nat. Cell Biol. 1 (7): 438-43. PMID 10559988. doi:10.1038/15674.
- Elledge SJ (diciembre de 1996). «Cell cycle checkpoints: preventing an identity crisis». Science 274 (5293): 1664-72. PMID 8939848.
- Pathan N, Aime-Sempe C, Kitada S, Basu A, Haldar S, Reed JC (2001). «Microtubule-targeting drugs induce bcl-2 phosphorylation and association with Pin1». Neoplasia 3 (6): 550-9. PMC 1506558. PMID 11774038. doi:10.1038/sj/neo/7900213.
- Pathan N, Aime-Sempe C, Kitada S, Haldar S, Reed JC (2001). «Microtubule-targeting drugs induce Bcl-2 phosphorylation and association with Pin1». Neoplasia 3 (1): 70-9. PMC 1505024. PMID 11326318. doi:10.1038/sj/neo/7900131.
- Shanahan F, Seghezzi W, Parry D, Mahony D, Lees E (febrero de 1999). «Cyclin E associates with BAF155 and BRG1, components of the mammalian SWI-SNF complex, and alters the ability of BRG1 to induce growth arrest». Mol. Cell. Biol. 19 (2): 1460-9. PMC 116074. PMID 9891079.
- Pines J, Hunter T (septiembre de 1989). «Isolation of a human cyclin cDNA: evidence for cyclin mRNA and protein regulation in the cell cycle and for interaction with p34cdc2». Cell 58 (5): 833-46. PMID 2570636.
- Kong M, Barnes EA, Ollendorff V, Donoghue DJ (marzo de 2000). «Cyclin F regulates the nuclear localization of cyclin B1 through a cyclin-cyclin interaction». EMBO J. 19 (6): 1378-88. PMC 305678. PMID 10716937. doi:10.1093/emboj/19.6.1378.
- Koff A, Giordano A, Desai D, Yamashita K, Harper JW, Elledge S, Nishimoto T, Morgan DO, Franza BR, Roberts JM (septiembre de 1992). «Formation and activation of a cyclin E-cdk2 complex during the G1 phase of the human cell cycle». Science 257 (5077): 1689-94. PMID 1388288.
- Hannon GJ, Casso D, Beach D (marzo de 1994). «KAP: a dual specificity phosphatase that interacts with cyclin-dependent kinases». Proc. Natl. Acad. Sci. U.S.A. 91 (5): 1731-5. PMC 43237. PMID 8127873.
- Gyuris J, Golemis E, Chertkov H, Brent R (noviembre de 1993). «Cdi1, a human G1 and S phase protein phosphatase that associates with Cdk2». Cell 75 (4): 791-803. PMID 8242750.
- He J, Xu J, Xu XX, Hall RA (julio de 2003). «Cell cycle-dependent phosphorylation of Disabled-2 by cdc2». Oncogene 22 (29): 4524-30. PMID 12881709. doi:10.1038/sj.onc.1206767.
- Reuter TY, Medhurst AL, Waisfisz Q, Zhi Y, Herterich S, Hoehn H, Gross HJ, Joenje H, Hoatlin ME, Mathew CG, Huber PA (octubre de 2003). «Yeast two-hybrid screens imply involvement of Fanconi anemia proteins in transcription regulation, cell signaling, oxidative metabolism, and cellular transport». Exp. Cell Res. 289 (2): 211-21. PMID 14499622.
- Kupfer GM, Yamashita T, Naf D, Suliman A, Asano S, D'Andrea AD (agosto de 1997). «The Fanconi anemia polypeptide, FAC, binds to the cyclin-dependent kinase, cdc2». Blood 90 (3): 1047-54. PMID 9242535.
- Zhan Q, Antinore MJ, Wang XW, Carrier F, Smith ML, Harris CC, Fornace AJ (mayo de 1999). «Association with Cdc2 and inhibition of Cdc2/Cyclin B1 kinase activity by the p53-regulated protein Gadd45». Oncogene 18 (18): 2892-900. PMID 10362260. doi:10.1038/sj.onc.1202667.
- Jin S, Antinore MJ, Lung FD, Dong X, Zhao H, Fan F, Colchagie AB, Blanck P, Roller PP, Fornace AJ, Zhan Q (junio de 2000). «The GADD45 inhibition of Cdc2 kinase correlates with GADD45-mediated growth suppression». J. Biol. Chem. 275 (22): 16602-8. PMID 10747892. doi:10.1074/jbc.M000284200.
- Yang Q, Manicone A, Coursen JD, Linke SP, Nagashima M, Forgues M, Wang XW (noviembre de 2000). «Identification of a functional domain in a GADD45-mediated G2/M checkpoint». J. Biol. Chem. 275 (47): 36892-8. PMID 10973963. doi:10.1074/jbc.M005319200.
- Vairapandi M, Balliet AG, Hoffman B, Liebermann DA (septiembre de 2002). «GADD45b and GADD45g are cdc2/cyclinB1 kinase inhibitors with a role in S and G2/M cell cycle checkpoints induced by genotoxic stress». J. Cell. Physiol. 192 (3): 327-38. PMID 12124778. doi:10.1002/jcp.10140.
- Tao W, Zhang S, Turenchalk GS, Stewart RA, St John MA, Chen W, Xu T (febrero de 1999). «Human homologue of the Drosophila melanogaster lats tumour suppressor modulates CDC2 activity». Nat. Genet. 21 (2): 177-81. PMID 9988268. doi:10.1038/5960.
- Kharbanda S, Yuan ZM, Rubin E, Weichselbaum R, Kufe D (agosto de 1994). «Activation of Src-like p56/p53lyn tyrosine kinase by ionizing radiation». J. Biol. Chem. 269 (32): 20739-43. PMID 8051175.
- Pathan NI, Geahlen RL, Harrison ML (noviembre de 1996). «The protein-tyrosine kinase Lck associates with and is phosphorylated by Cdc2». J. Biol. Chem. 271 (44): 27517-23. PMID 8910336.
- Luciani MG, Hutchins JR, Zheleva D, Hupp TR (julio de 2000). «The C-terminal regulatory domain of p53 contains a functional docking site for cyclin A». J. Mol. Biol. 300 (3): 503-18. PMID 10884347. doi:10.1006/jmbi.2000.3830.
- Ababneh M, Götz C, Montenarh M (mayo de 2001). «Downregulation of the cdc2/cyclin B protein kinase activity by binding of p53 to p34(cdc2)». Biochem. Biophys. Res. Commun. 283 (2): 507-12. PMID 11327730. doi:10.1006/bbrc.2001.4792.
- Tan F, Lu L, Cai Y, Wang J, Xie Y, Wang L, Gong Y, Xu BE, Wu J, Luo Y, Qiang B, Yuan J, Sun X, Peng X (julio de 2008). «Proteomic analysis of ubiquitinated proteins in normal hepatocyte cell line Chang liver cells». Proteomics 8 (14): 2885-96. PMID 18655026. doi:10.1002/pmic.200700887.