Dihidroxilación asimétrica de Sharpless
La dihidroxilación asimétrica de Sharpless, también conocida como bishidroxilación, llamada así en honor del químico estadounidense K. Barry Sharpless, es una reacción química enantioselectiva de alquenos con tetróxido de osmio en presencia de un ligando de quinina quiral para formar un diol vecinal.[1][2][3]

RL = sustituyente voluminoso; RM = sustituyente de tamaño mediano; RS = sustituyente más pequeño.
Normalmente se produce esta reacción usando cantidades catalíticas de tetróxido de osmio, que después de la reacción es regenerado bien con ferricianina de potasio[4][5] o N-metilmorfolina N-óxido.[6][7] Estas condiciones reducen drásticamente las cantidades necesarias de tetróxido, un compuesto altamente tóxico y oneroso. Los cuatro reactivos son comerciales y se pueden obtener bajo el nombre «AD-mix». La mezcla que contiene (DHQ)2-PHAL se denomina AD-mix-α, mientras que la mezcla que contiene (DHQD)2-PHAL se denomina AD-mix-β.[8]
Mecanismo de la reacción
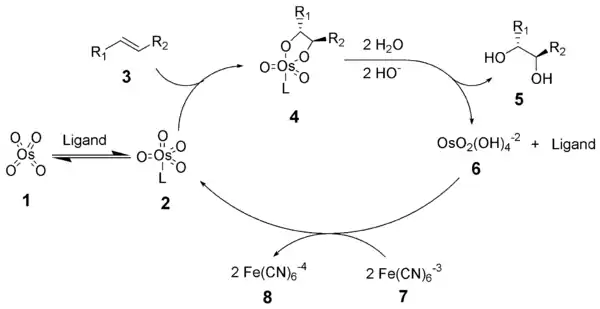
El mecanismo de la dihidroxilación asimétrica de Sharpless comienza con la formación del complejo tetróxido de osmio-ligando (2). Una cicloadición [3+2] con el alqueno (3) conduce al intermediario cíclico 4.[9][10] La posterior hidrólisis básica libera el diol (5) y el osmiato reducido (6). Finalmente, el oxidante añadido en cantidades estequiométricas regenera el complejo tetróxido de osmio-ligando (2).
Aplicaciones
La dihidroxilación clásica, en presencia de un catalizador quiral, necesita osmio.[1][2][3] La dihidroxilación asimétrica de Sharpless reduce drásticamente el coste de este procedimiento, abriendo el campo de reacciones orgánicas que incluyen osmiatos simpatéticos y biomiméticos.
Ejemplos
El primer paso en la síntesis del aza-azúcar 6 es una reacción de dihidroxilación[11] del dieno proquiral 1. Los aza-azúcares son compuestos de gran importancia farmacológica. Toda la reacción se realiza en medio acuoso y no es necesario añadir grupos protectores. El paso 2 consiste, además, en una sustitución nucleófila del derivado bromado quimioselectiva por parte del hidroxilo.
La dihidroxilación asimétrica de Sharpless es también un paso clave en la síntesis total del taxol de Kuwajima.[12][13]
Véase también
Referencias
- Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (doi 10.1021/ja00214a053)
- Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547. (Review) (doi 10.1021/cr00032a009)
- Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article Archivado el 24 de agosto de 2010 en Wayback Machine.)
- Minato, M.; Yamamoto, K.; Tsuji, J. J. Org. Chem. 1990, 55, 766-768. (doi 10.1021/jo00289a066)
- Oi, R.; Sharpless, K. B. Org. Syn., Coll. Vol. 9, p.251 (1998); Vol. 73, p.1 (1996). (Article)
- VanRheenen, V.; Kelly, R. C.; Cha, D. Y. Tetrahedron Lett. 1976, 1973-1976.
- McKee, B. H.; Gilheany, D. G.; Sharpless, K. B. Org. Syn., Coll. Vol. 9, p.383 (1998); Vol. 70, p.47 (1992). (Article Archivado el 5 de junio de 2008 en Wayback Machine.)
- Sharpless, K. B., et al. J. Org. Chem. 1992, 57, 2768-2771. (doi 10.1021/jo00036a003)
- Corey, E.J.; Noe, M. C.; Grogan, M. J. Tetrahedron Lett. 1996, 37, 4899-4902.
- DelMonte, A. J.; Haller, J.; Houk, K. N.; Sharpless, K. B.; Singleton, D. A.; Strassner, T.; Thomas, A. A. J. Am. Chem. Soc. 1997, 119, 9907-9908. (doi 10.1021/ja971650e)
- Efficient asymmetric synthesis of an azasugar in water Ulf M. Lindström, Rui Ding, Olle Hidestål Chemical Communications 2005, 1773.
- Koichiro Morihira, Ryoma Hara; Soc, Isao Kuwajima (1998). «Enantioselective Total Synthesis of Taxol». J. Am. Chem. Soc. 120 (49): 12980-12981. doi:10.1021/ja9824932.
- Hiroyuki Kusama, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Hajime Kashima, Nobuhito Nakamura, Koichiro Morihira, and Isao Kuwajima (2000). «Enantioselective Total Synthesis of (−)-Taxol». J. Am. Chem. Soc. 122 (16): 3811-3820. doi:10.1021/ja9939439.