Dimetilpropano
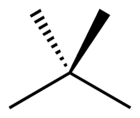
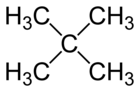
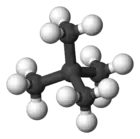
El dimetilpropano, o neopentano o 2,2-dimetilpropano, es un alcano de cadena doblemente ramificada con cinco átomos de carbono. Es un gas extremadamente inflamable a temperatura y presión ambiental, que puede condensar en un día frío, en un baño de hielo o cuando se le somete a una presión elevada, dando un líquido altamente volátil.
| Dimetilpropano[1] | ||
|---|---|---|
   | ||
| Nombre IUPAC | ||
| Dimetilpropano | ||
| General | ||
| Otros nombres |
Neopentano Tetrametilmetano 1,1,1-Trimetiletano ter-pentano | |
| Fórmula semidesarrollada | CH3-C(CH3)2-CH3 | |
| Fórmula molecular | C5H12 | |
| Identificadores | ||
| Número CAS | 463-82-1[2] | |
| ChEBI | 30358 | |
| ChemSpider | 9646 | |
| PubChem | 10041 | |
| UNII | M863R1J0BP | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 627 kg/m³; 0,627 g/cm³ | |
| Masa molar | 72,15 g/mol | |
| Punto de fusión | 255 K (−18 °C) | |
| Punto de ebullición | 283 K (10 °C) | |
| Temperatura crítica | 433,7 K (161 °C) | |
| Presión crítica | 31.6 bar atm | |
| Propiedades químicas | ||
| Solubilidad en agua | 1.73 %/vol. agua a 20 °C | |
| Termoquímica | ||
| ΔfH0gas | −168 kJ/mol | |
| S0gas, 1 bar | 217 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
4
1
0
?
| |
| Frases R | R12, R51/53 | |
| Frases S | S2, S9, S16, S33, S61 | |
| Límites de explosividad | 1.4 - 7.5 %[3] | |
| Riesgos | ||
| Riesgos principales |
Altamente inflamable (F+) Peligroso para el medio ambiente (N) | |
| Inhalación | Asfixiante | |
| Compuestos relacionados | ||
| Alcanos |
Pentano Isopentano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El dimetilpropano es el alcano más sencillo con un carbono cuaternario. Es uno de los tres isómeros del pentano, con fórmula molecular C5H12, junto al n-pentano y el isopentano.
Nomenclatura
La nomenclatura de la IUPAC le da por válido el nombre tradicional de neopentano.[4][5] Su nombre sistemático es 2,2-dimetilpropano, pero los números de los sustituyentes son innecesarios por lo que es nombrado mayormente como "dimetilpropano".
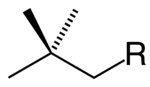
El sustituyente neopentil, a menudo simbolizado como Np, tiene la estructura Me3C-CH2-. Por ejemplo, el alcohol neopentílico sería Me3CCH2OH, o simplemente NpOH, y su nombre sistemático sería 2,2-dimetil-1-propanol.
Propiedades físicas
Puntos de fusión y ebullición
El punto de ebullición del dimetilpropano es de sólo 9.5 °C, significativamente más bajo que los de isopentano (27.7 °C) y el pentano normal de cadena lineal (36.0 °C). Por lo tanto, el neopentano es técnicamente un gas, mientras los otros dos isómeros son (apenas) líquidos.
Por otra parte, el punto de fusión del neopentano (-16.6 °C) es unos 140 grados más alto que el de isopentano (-159.9 °C) y unos 110 grados más alto que el de n-pentano (-129.8 °C). Esta anomalía ha sido atribuida a que un mejor empaquetamiento en estado sólido sería posible con la molécula tetraédrica del neopentano; pero esta explicación ha sido cuestionada al considerar que el neopentano posee una menor densidad que los otros dos isómeros. Además, su entalpía de fusión es más baja que las de n-pentano e isopentano, lo que indica que su punto de fusión más alto se debe a un efecto de entropía. En efecto, la entropía de fusión del neopentano es aproximadamente 4 veces menor que las de n-pentano e isopentano.[1][6]
Espectro de RMN
El neopentano tiene simetría Td. desplazamiento químico RMN simple δ = 0.902 cuando se disuelve en tetracloruro de carbono.[7] A este respecto, el neopentano es similar a su análogo de silano, el tetrametilsilano, cuyo desplazamiento químico simple es nulo por convenio.
La simetría de la molécula de neopentano puede romperse si algunos átomos de hidrógeno se reemplazan por átomos de deuterio. En particular, si cada grupo metilo tiene un número diferente de átomos substituidos (0, 1, 2, and 3), se obtiene una molécula quiral. La quiralidad en este caso aumenta solamente por la distribución de masas de sus núcleos, mientras la distribución de electrones es aún esencialmente aquiral.
Referencias
- James Wei (1999), Molecular Symmetry, Rotational Entropy, and Elevated Melting Points. Ind. Eng. Chem. Res., volume 38 issue 12, pp. 5019–5027 doi 10.1021/ie990588m
- Número CAS
- Matheson Gas Data Book. «Lower and Upper Explosive Limits for Flammable Gases and Vapors (LEL/UEL)» (en inglés). Matheson Gas Products. p. 443. Archivado desde el original el 30 de septiembre de 2019. Consultado el 2 de octubre de 2016.
- Table 19(a) Acyclic and monocyclic hydrocarbons. Parent hydrocarbons
- Panico, R.; & Powell, W. H. (Eds.) (1994). A Guide to IUPAC Nomenclature of Organic Compounds 1993. Oxford: Blackwell Science. ISBN 0-632-03488-2.
- Química. Ronald J. Gillespie, Aurelio Beltrán. Tomo 2. Ed. Reverté. Barcelona, 1990. ISBN 84-291-7188-6, Pág. 585
- Spectral Database for Organic Compounds, Proton NMR spectrum of neopentane (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)., accessed 19 Nov 2006.
Enlaces externos
- IUPAC Nomenclature of Organic Chemistry (Versión en línea del "Blue Book",en inglés)
