Dinorfinas
Las dinorfinas (del griego dynamis poder, potencia) son un subtipo de péptidos opiáceos derivados de la pro-dinorfina que actúan como neurotransmisores en el sistema nervioso central. Se trata de neurotransmisores peptídicas entre los cuales encontramos también otras sustancias como las endorfinas y las taquininas. Los opioides son sustancias que actúan en receptores específicos para producir efectos parecidos a los de la morfina. Estos receptores se encuentran principalmente en el sistema nervioso periférico y central y en el tracto gastrointestinal.
Estructura

- Fórmula química: C99H155N31O23
- Masa molecular: 2147.523 g/mol
- Rol principal: transmisores del sistema nervioso central
- Carga neta: 0
Tras la despolarización de la neurona que la contiene, la dinorfina puede ser hidrolizada por la convertasa 2 (PC2), una protoproteína. De este modo, se liberarán diferentes tipos de dinorfinas (A y B). Sin embargo, en ocasiones la prodinorfina no es procesada correctamente y desencadena por ello la liberación de la “gran dinorfina”, un péptido de 32 aminoácidos constituido por dinorfina A y B.
Tanto la dinorfina A como la B contienen en gran medida residuos de aminoácidos básicos como la lisina y arginina. Ambas poseen cadenas relativamente largas que acaban en grupos cargados positivamente a un pH neutro. La lisina acaba en una amina primaria y la arginina en un grupo guanidina. Los aminoácidos que las forman son los siguientes:
Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys
- Dinorfina B
Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Gln-Phe-Lys-Val-Val-Thr
Las dinorfinas son producidas por el cerebro humano. Es un potente analgésico, unas doscientas veces más eficaz que la morfina. El cerebro segrega esta sustancia como respuesta a nuestros estados emocionales. Estos péptidos están ampliamente distribuidos por todo el encéfalo y se encuentran principalmente en el hipotálamo, el puente troncoencefálico, la médula, el cerebro medio y la médula espinal. Se almacenan en vesículas grandes que requieren un estímulo intenso y prolongado para liberar su contenido. La dinorfina interacciona con receptores kappa y otros tipos de receptores y de este modo, cada tipo de dinorfina muestra una cierta preferencia y potencia ante cada receptor.[1]
Tipos
| Secuencia de aminoácidos de péptidos producidos por división de la prodinorfina | |
|---|---|
| Péptido | Secuencia de aminoácidos |
| “Big” dinorfina (DYN AB 1-32) | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-Lys-Arg-Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Gln-Phe-Lys-Val-Val-Thr |
| DYN A 1-17 | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln |
| DYN A 1-13 | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys |
| DYN A 1-8 | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile |
| Leumorfina (DYN B 1-29 ) | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Gln-Phe-Lys-Val-Val-Thr |
| Rimorfina (DYN B 1-13) | Tyr-Gly-Gly-Phe-Leu-Arg-Lys-Tyr-Pro-Lys |
Biosíntesis
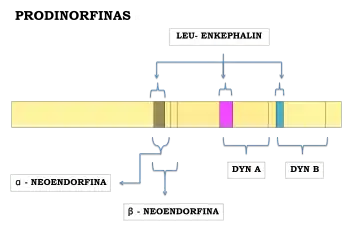
La prodinorfina o proencefalina B es un polipéptido que libera péptidos activos que contienen leu-encefalina en su estructura.
La prodinorfina está compuesta por la molécula de neoendorfina y la “big”-dinorfina conectadas por un enlace peptídico producido gracias a la acción de la prohormona convertasa PC1.
En la liberación de péptidos interviene la prohormona convertasa PC2 rompiendo el enlace entre ambas regiones. El tipo de péptido liberado dependerá de la región de prodinorfina que se fragmente. Así, podemos obtener neoendorfinas (α y β) o ‘big’-dinorfinas (dinorfina A y dinorfina B).
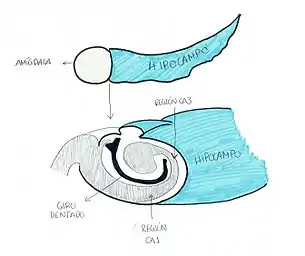
Estos péptidos se sintetizan en las células granulosas del giro dentado del hipocampo. Posteriormente, dichos péptidos son transportados a axones terminales de la región A3. Estas regiones del hipocampo se relacionan con la percepción del dolor, la modulación del comportamiento afectivo, la regulación del sistema nervioso autónomo y con funciones neuroendocrinas.
La dinorfina es el péptido más potente de los liberados por la prodinorfina. Se trata de un péptido endógeno de número variable de aminoácidos dependiendo del tipo que se trate. Esta se encuentra, normalmente, en regiones del hipocampo con una fuerte corriente sináptica excitante.
Originalmente, al gen humano que codifica para la dinorfina se le conocía como gen ‘Encefalina B’ debido a la similitud con el gen para la encefalina. Este fue aislado y sencuenciado por primera vez en 1983.[2]
Receptores K y proteínas G
El receptor κ-opioide está localizado en el cromosoma 8 y pertenece a la familia de los receptores acoplados a proteínas G (GPCR). Se trata de un receptor opioide. Su estructura se compone de 3 dominios: uno extracecular, otro transmembrana y otro intracelular. El dominio transmembrana cuenta a su vez con otros 7 dominios.
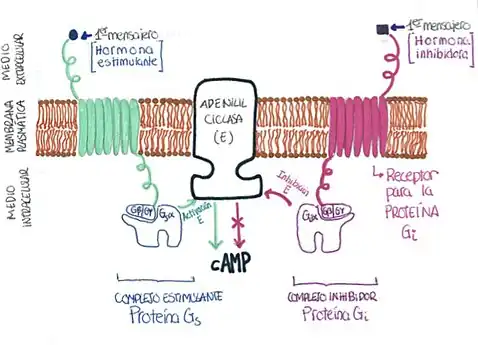
Este receptor k posee la capacidad de unirse a tres subunidades diferentes de las proteínas G: la subunidad Gs, con función estimulante, la subunidad Gi, con función inhibidora y, menos frecuentemente, interacciona con subunidades Gq. Estas proteínas G cuentan a su vez con tres regiones diferenciadas: alfa, beta y gamma. Por tanto, dependiendo del tipo de subunidad G con la que interaccionen, pueden desencadenarse diferentes respuestas.
Al dominio de la parte extracelular del receptor K se une un primer mensajero y al dominio de la parte intracelular se une una proteína G. Durante una estimulación prolongada por parte de agonistas como la dinorfina, el receptor K puede unirse a subunidades Gs, causando que la región alfa de esta subunidad se desprenda debido a un cambio en su conformación. Esta sección se unirá a una proteína transmembrana que provocará un aumento del nivel de adenosín monofosfato cíclico (cAMP) en la célula. Esta proteína transmembrana se denomina adenilil ciclasa y cuenta con dos zonas transmembranales, cada una de ellas con 7 dominios. Posee además tres dominios intracelulares a los cuales se une la región alfa de la proteína Gs. La interacción entre ambos complejos provoca la lisis de una molécula de ATP obteniendo por ello AMPc y pirofosfato. Este proceso aumentará entonces la cantidad de AMPc en la célula. Debido a esta producción de AMPc se dice que la Gs actúa como estimulante.
Por otro lado, si se une con una subunidad Gi el efecto será el contrario. El proceso inicial es el mismo: un agonista como la dinorfina se une al receptor kappa, que provoca la unión a su vez de la región alfa al extremo de la Adenilil Cilasa. Sin embargo, en lugar de estimular la producción de AMPc, inhibe su emisión provocando un descenso de la producción de cAMP y de la actividad de los canales de calcio. Sin embargo, activa los canales potásicos.
Por tanto, se puede afirmar que la interacción del receptor activado y la proteína G provoca que la región alfa modifique su conformación de una manera u otra para poder inhibir o estimular la producción de AMPc.
Además, aunque de manera menos frecuente en el caso de las dinorfinas, el receptor K puede unirse a la subunidad Gq debido a la señal transmitida por el primer mensajero. La región alfa de la proteína se desprende debido a un cambio conformacional y se adhiere a una fosfolipasa C activándola. En la membrana plasmática se encuentra a su vez un fosfatidilinositol fosfato 2, que se moverá por la misma pasando por encima de la subunidad alfa unida a la enzima. Tras su paso, el fosfatidilinositol fosfato 2 se convertirá en diacilglicerol, que permanecerá en la membrana, y en inositol 3 fosfato, que interactuará con una vesícula intracelular para abrir canales iónicos de Ca2+ y liberar así Ca2+ de otra vesícula donde se encontraba previamente encerrado. Por tanto, causa un aumento de la concentración de calcio intracelular. Esto, por ejemplo, contribuye con los procesos de contracción muscular.[3][4]
La dinorfina cuenta con la capacidad de interactuar con diferentes tipos de receptores opioides y no opioides, desencadenando por ello diversas señales. Como receptor no opioide puede unirse con receptores NMDA. Por otro lado, interacciona también con los receptores opioides mu y delta.
Receptores no opioides
El receptor NMDA es un receptor no opioide. Este receptor es una proteína con una compleja estructura formada a partir combinaciones de subunidades NR1 y NR2. Estas subunidades son capaces de interaccionar con las dinorfinas, así como con otros aminoácidos como el glutamato, el aspartato y la glicina. Es un receptor no opioide que se encuentra en la médula espinal perteneciente a la región intracelular. Su estructura en conjunto forma canales iónicos que permite la entrada de Ca2+, lo cual provoca un aumento de la concentración de este ion en el medio intracelular generando diversas respuestas secundarias. Se caracteriza también por su bloqueo al Mg2+.
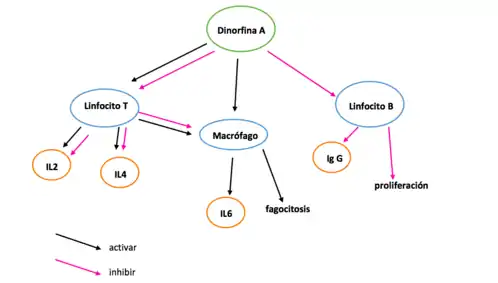
Este receptor se expresa en linfocitos T y participa en la regulación de la proliferación, la síntesis de citokina y la apoptosis de los linfocitos T.[5]
Además, la dinorfina A también disminuye el nivel de adenosín monofosfato cíclico en los esplenocitos (células blancas). En concentraciones de 10^-8 y 10^-9, la dinorfina A frena la respuesta proliferadora de linfocitos (PHA inducida) en una fracción mononuclear y purificada. Esto indica la importancia del péptido en la composición. La dinorfina A, a concentraciones de 10^-8 en células mononucleares estimuladas, activa la producción de interleucina-4 (IL4) y suprime la producción de interleucina-2 (IL2). Su efecto estimulador en la producción de IL4 por las células CD4+ depende de la presencia de monocitos. Por lo tanto, la dirección del efecto inhibitorio del receptor k en la producción de IL2 e IL4 ilustra como el efecto depende de la concentración del péptido. La dinorfina A es también responsable de la activación de los macrófagos y secreción de interleucina-6, así como la inhibición de la proliferación de linfocitos B y por consiguiente la liberación de inmunoglobulina G (Ig G).
Receptores opioides
Las dinorfinas, al igual que otros péptidos opioides como las encefalinas o las endorfinas, presentan gran afinidad hacia receptores mu, delta y kappa. En el caso de las dinorfinas es especialmente destacable el receptor kappa, también conocido como KORs. Estos, junto con las proteínas G, poseen la capacidad de inhibir o estimular la actividad de la adenilil ciclasa a través de una serie de señales en cascadas, mencionadas anteriormente.
La estimulación del receptor kappa, en ocasiones, puede estar también asociada con alucinaciones, ansiedad, estrés y cansancio. Por otro lado, los receptores delta y mu pueden causar depresiones respiratorias. Esto se debe a que la estimulación opioide en el midbrain provoca un gran descenso en la habilidad del cuerpo para lograr eliminar el dióxido de carbono de manera eficiente.
Ambos tipos de receptores se encargan, en mayor o menor medida, de regular funciones básicas como el apetito, las emociones o el dolor.
Efectos analgésicos
El cuerpo humano contiene neuronas compuestas por un cuerpo celular y dendritas, que se encargan de transmitir la información que reciben de otras neuronas al cuerpo celular; esta información es transmitida a las dendritas por medio de axones que salen del cuerpo celular. Las neuronas se comunican gracias a la liberación de neurotransmisores por los axones a nivel de las sinapsis químicas, que son reconocidos por receptores específicos en la membrana post-sináptica. Muchos receptores envían mensajes al cuerpo cuando están expuestos a estímulos: receptores de temperatura, de tacto, de cambio de pH… Cuando los estímulos son considerados como nocivos para el tejido, receptores especiales, los nociceptores, envían señales al cerebro. Estos nociceptores se encuentran por todo el cuerpo, pero principalmente en la piel, las paredes de los órganos y en otros tejidos como los músculos.[6]
Cuando sufrimos un estímulo nocivo, se envía una señal eléctrica de una neurona aferente primaria a una parte de la médula espinal, el ganglio espinal, donde la corriente eléctrica causa la liberación de neurotransmisores, que se encargan de enviar el mensaje de dolor a una segunda neurona excitatoria. Estos transmisores son generalmente glutamato y la sustancia P. El mensaje se envía entonces a diferentes zonas del cerebro donde se interpreta como dolor. Una zona que recibe el mensaje es el tálamo, que lo transmite al hipotálamo y sistema límbico que nos ayuda a aprender y evitar en el futuro lo que lo ha causado.
Los opioides inhiben la señal de dolor a lo largo de estas etapas, actuando en el cerebro, la médula espinal e incluso en la periferia. En el cerebro, tienen efectos alteradores del ánimo, causan sedación y pueden disminuir la respuesta emocional al dolor. Se encargan de bloquear el envío de la señal desde el nociceptor primario a la neurona secundaria. También actúan sobre neuronas que descienden del tronco encefálico a la médula espinal, que modulan las señales de dolor. Esas vías descendientes contienen fibras que o bien amplifican o bien inhiben la transmisión de señales doloros al cerebro; los opioides reprimen las fibras encargadas de amplificar la señal y aumentan las que la inhiben. Éstos pueden incluso llegar a actuar en la periferia para disminuir la activación de las neuronas primarias e inhibir las respuestas inmunitarias e inflamatorias a estímulos nocivos.[7]
En la hendidura sináptica (donde las neuronas primarias y secundarias se encuentran), el influjo de iones calcio Ca2+ causa la liberación de neurotransmisores en la sinapsis que se unen a receptores de la membrana post-sináptica, que sigue la cadena hasta enviar el mensaje al cerebro. Encontramos receptores específicos de opioides tanto en la membrana pre como post-sináptica; así pues, cuando un péptido opioide se une a su receptor respectivo pre-sináptico, disminuye la cantidad de iones calcio que entran en la célula, y consecuentemente la cantidad de neurotransmisores excitatorios liberados en la sinapsis. Esto resulta en una sensación de dolor menor. Para que el opioide, en este caso la dinorfina, pueda interactuar con su receptor, es muy importante que tenga la secuencia peptídica Tyr-Gly-Gly- Phe.
El tipo de analgesia causada varía en función del tipo de receptor utilizado y de su repartición en el cuerpo. Así pues, generalmente al receptor K se le asocia analgesia espinal, sedación y disforia mientras que los receptores μ y δ causan analgesia supraespinal, miosis (contracción de las pupilas), euforia e hipoventilación.[8][9]
Últimos hallazgos
Los últimos estudios apuntan a que el estrés y la adicción crónica a las drogas de abuso son factores estimulantes del complejo dinorfina/KOR. Es decir, tanto los factores de estrés como un suministro significativo de determinadas drogas de abuso (como la cocaína) inducen la sobre expresión del gen para la dinorfina, la cual se unirá al receptor K-opioide. Esta unión está relacionada con las situaciones de disforia o depresión sufridas, por ejemplo, durante una situación crítica de estrés o durante el síndrome de abstinencia. Estos hechos se basan en la evidencia de que la unión dinorfina/KOR está implicada en dicha respuesta conductual (disforia y depresión).[10]
Efectos del estrés
El estrés provoca la liberación de dinorfinas a través de la hormona liberadora de hormona adrenocorticotropa (CRF) y por consiguiente la activación de receptores KOR en varias zonas del cerebro involucradas en las emociones como el núcleo dorsal del rafe, el hipotálamo o el área tegmental ventral; esto provoca disforia e inmovilidad, efectos que pueden ser disminuidos si se bloquean los receptores KOR, para causar efectos parecidos a los antidepresivos.[8]
Referencias
- García-Allen J. (2016). «Tipos de neurotransmisores: funciones y clasificación». Consultado el 26 de octubre de 2017.
- «Isolation and structural organization of the human preproenkephalin B gene». Nature 306 (5943): 611-4. December 1983. PMID 6316163. doi:10.1038/306611a0.
- Levine, Bernice A. (2007). Neuropeptide Research Trends (en inglés). Nova Publishers. ISBN 9781600216404. Consultado el 26 de octubre de 2017.
- «III. RECEPTORES, PROTEÍNAS G Y SEGUNDOS MENSAJEROS». bibliotecadigital.ilce.edu.mx. Consultado el 20 de octubre de 2017.
- «NMDA, un receptor polifacético». www.encuentros.uma.es. Archivado desde el original el 20 de julio de 2015. Consultado el 20 de octubre de 2017.
- [Kowalski, J. (1998) Neuropeptides, 32e].
- Healthcare Triage (9 de mayo de 2016), The Science of Opioids, consultado el 26 de octubre de 2017.
- Cahill, Catherine M.; Taylor, Anna M. W.; Cook, Christopher; Ong, Edmund; Morón, Jose A.; Evans, Christopher J. (17 de noviembre de 2014). «Does the kappa opioid receptor system contribute to pain aversion?». Frontiers in Pharmacology 5. ISSN 1663-9812. PMC 4233910. PMID 25452729. doi:10.3389/fphar.2014.00253. Consultado el 26 de octubre de 2017.
- Pharmacology Corner (19 de agosto de 2011), Opioid pharmacology part 2: mu,kappa and delta receptors, consultado el 26 de octubre de 2017.
- «The 3rd meeting on the Therapeutic Potential of Kappa Opioids in Pain and Addiction was held at the Carolina Inn in Chapel Hill, NC on April 20-24, 2015». Consultado el 18 de octubre de 2017.