Distribución de Maxwell-Boltzmann
La distribución de Boltzmann o distribución de Maxwell-Boltzmann es una distribución de probabilidad de las velocidades de un gas asociada a la estadística de Maxwell-Boltzmann para dicho sistema. Fue formulada originalmente por los físicos J. C. Maxwell y L. Boltzmann.
Ante la pregunta de «¿Cuál es la distribución de velocidades en un gas a una temperatura dada?» aparece una respuesta presentada como la distribución de Maxwell-Boltzmann, la cual nos muestra cómo están distribuidas las velocidades de las moléculas en un gas ideal.
Técnicamente, el término distribución de Boltzman se reserva para la función de probabilidad de la energía de las partículas, mientras que el término distribución de Maxwell-Boltzmann se reserva para la distribución de probabilidad de la velocidad de las partículas (existe una relación matemática fija entre ambas).
Distribución de Maxwell-Boltzmann
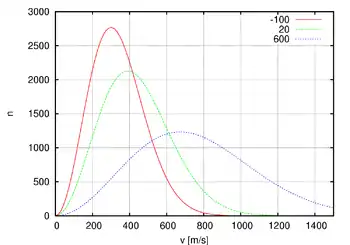
Matemáticamente, la distribución de Maxwell-Boltzmann es la distribución de una variable aleatoria escalar combinación de otras tres variables aleatorias cada una de las cuales se distribuye según una distribución normal .
Físicamente el módulo de la velocidad de una molécula es igual a la raíz de la suma de los cuadrados de las velocidades coordenadas de la partícula , y como cada una de ellas siguen distribuciones gaussianas entonces debe seguir una distribución de Maxwell-Boltzmann explícitamente:
donde m es la masa de la partícula y kT viene dada por el producto de la constante de Boltzmann y la temperatura absoluta.
Parámetros estadísticos
Es habitual obtener ciertos parámetros estadísticos de esta distribución, como son:
- La velocidad más probable, vp, que viene dado por el máximo de la función de distribución de Maxwell, también llamada en estadística, la moda. Para encontrarla solo hay que calcular:
lo que nos lleva a:
- ,
donde R es la constante de los gases, NA el número de Avogadro y m es la masa de las partículas del gas.
Por ejemplo, para el nitrógeno molecular (N2) a temperatura ambiente (300 K), esto resulta vp = 422 m/s.
- La velocidad media o valor esperado de la distribución de velocidades es:
- La velocidad cuadrática media, que es el momento de segundo orden de la velocidad:
Como puede verse, estas tres velocidades están siempre relacionadas por:
 Wikimedia Commons alberga una categoría multimedia sobre Distribución de Maxwell-Boltzmann.
Wikimedia Commons alberga una categoría multimedia sobre Distribución de Maxwell-Boltzmann.