Efecto caja
El efecto caja o efecto jaula del disolvente, en química, describe cómo las propiedades de una molécula se ven afectadas por su entorno. Introducido por primera vez por Franck y Rabinowitch [1][2] en 1934, el efecto jaula sugiere que, en lugar de actuar como una partícula individual, las moléculas disueltas se describen con mayor precisión como moléculas encapsuladas por el disolvente.[3][4] Para interactuar con otras moléculas, la partícula enjaulada debe difundirse desde su jaula de disolvente. La vida útil típica de una jaula es de 10−11s.[5]
Eficiencia iniciador
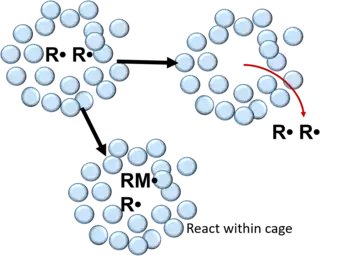
En la polimerización por radicales libres, los radicales formados por la descomposición de una molécula iniciadora están rodeados por una jaula que consiste en moléculas de disolvente y/o monómero.[4] Dentro de la jaula, los radicales libres sufren muchas colisiones que conducen a su recombinación o desactivación mutua.[3][4][6] Esto se puede describir en la siguiente reacción:
Después de la recombinación, los radicales libres pueden reaccionar con moléculas de monómero dentro de las paredes de la jaula o difundirse fuera de ella. En polímeros, la probabilidad de que un par de radicales libres escape de la recombinación en la jaula es de entre 0,01-0,1 y de entre 0,3-0,8 en líquidos.[3]
Este efecto de jaula es importante para el caso de las reacciones fotoquímicas en disolución. El par de radicales libres producidos inicialmente pueden, debido a que están atrapados por las moléculas de disolvente circundantes, hacer que se recombinen antes de que puedan separarse entre sí. Este fenómeno se conoce como recombinación primaria, en oposición a la recombinación secundaria que ocurre después de que, los radicales libres producidos, se han separado uno del otro y escapan de la jaula de disolvente, reaccionando con otros radicales libres formados en otras jaulas.[7]
Velocidad de reacción
Para que una reacción ocurra las partículas reaccionantes deben colisionar. Solo una cierta fracción de las colisiones totales causan un cambio químico; estas son llamadas colisiones exitosas.[8] Cuando tenemos un gas o un líquido diluido, la velocidad de reacción la rige la capacidad de difusión de las partículas reaccionantes, no las colisiones. En este caso, la velocidad de reacción no depende del efecto caja, sino de leyes de difusión de Fick. Cuando tenemos disoluciones de reactivos, el efecto de la solvatación que las moléculas de disolvente ejercen a las moléculas reaccionantes, aumenta el tiempo de contacto de estas últimas, permitiendo una mayor probabilidad de colisión y, por tanto, de reacción, al tenerlas encerradas dentro de la caja del disolvente. Un claro ejemplo de esto se da en las reacciones de sustitución, donde en función de la naturaleza del disolvente, la velocidad puede ser muy superior, a pesar de ser la misma reacción química. Un disolvente puede dificultar la difusión de los reactivos, o puede estabilizar intermedios de reacción o incluso estados de transición.
Este efecto jaula es el responsable de que muchas reacciones químicas tengan una clara dependencia del disolvente.
Referencias
- Rabinowitch, Franck (1934). «Some remarks about free radicals and the photochemisty of solutions». Transactions of the Faraday Society 30: 120-130. doi:10.1039/tf9343000120.
- Rabinowitch, E (1936). «The collison [sic] mechanism and the primary photochemical process in solutions». Transactions of the Faraday Society 32: 1381-1387. doi:10.1039/tf9363201381.
- Denisov, E.T. (1984). «Cage effects in a polymer matrix». Macromolecular Chemistry and Physics 8: 63-78. doi:10.1002/macp.1984.020081984106.
- Chanda, Manas (2013). Introduction to Polymer Science and Chemistry: A problem solving approach. New York: CRC Press. pp. 291, 301-303.
- Herk, L.; Feld, M.; Szwarc, M. (1961). «Studies of "Cage" Reactions». J. Am. Chem. Soc. 83 (14): 2998-3005. doi:10.1021/ja01475a005.
- Braden, Dale, A. (2001). «Solvent cage effects. I. Effect of radical mass and size on radical cage pair recombination efficiency. II. Is geminate recombination of polar radicals sensitive to solvent polarity?». Coordination Chemistry Reviews 211: 279-294. doi:10.1016/s0010-8545(00)00287-3.
- Keith J. Laidler (2013). Reaction Kinetics: Reactions in Solution. Pergamon. ISBN 978-1483123844.
- Unión Internacional de Química Pura y Aplicada. «collision theory». Compendium of Chemical Terminology. Versión en línea (en inglés).