Éter (química)
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, iguales o distintos, estando el átomo de oxígeno unido a estos. Son una clase de compuestos que contienen un grupo éter, un átomo de oxígeno conectado a dos grupos alquilo o arilo.
.png.webp)

Se puede obtener un éter de la reacción de condensación entre dos alcoholes (aunque no se suele producir directamente y se emplean pasos intermedios):
- ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
- RO- + R'X → ROR' + X-
No forman puentes de hidrógeno al no tener un hidrógeno unido al oxígeno, y debido a esto presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
El enlace entre el átomo de oxígeno y los dos carbonos se forma a partir de los correspondientes orbitales híbridos sp³. En el átomo de oxígeno quedan dos pares de electrones no enlazantes.
Los dos pares de electrones no enlazantes del oxígeno pueden interaccionar con otros átomos, actuando de esta forma los éteres como ligandos, formando complejos. Un ejemplo importante es el de los éteres corona, que no pueden interaccionar selectivamente con cationes de elementos alcalinos o, en menor medida, alcalinotérreos.
Los éteres pueden clasificarse de nuevo en dos variedades: si los grupos alquilo o arilo son iguales a ambos lados del átomo de oxígeno, se trata de un éter simple o simétrico, mientras que si son diferentes, los éteres se denominan mixtos o asimétricos.[1] Un ejemplo típico del primer grupo es el disolvente y anestésico éter dietílico. éter dietílico, comúnmente denominado simplemente "éter" (CH
3−CH
2−O−CH
2−CH
3).
Los éteres son comunes en química orgánica y aún más frecuentes en bioquímica, ya que son enlaces comunes en carbohidratos y lignina.[2]
Estructura y enlaces
Los éteres presentan enlaces C-O-C doblados. En dimetil éter, el ángulo de enlace es de 111° y las distancias C-O son de 141 pm.[3] La barrera a la rotación sobre los enlaces C-O es baja. El enlace del oxígeno en éteres, alcoholes y agua es similar. En el lenguaje de la teoría del enlace de valencia, la hibridación en el oxígeno es sp3.
El oxígeno es más electronegativo que el carbono, así los hidrógenos alfa de éteres son más ácidos que ésos de hidrocarburos simples. Sin embargo, son mucho menos ácidos que los hidrógenos alfa de los grupos carbonilo (como en cetonas o aldehídos).
Los éteres pueden ser simétricos del tipo ROR o asimétricos del tipo ROR'. Ejemplos de los primeros son el dimetil éter, el dietil éter, el dipropil éter, etc. Éteres asimétricos ilustrativos son el anisol (metoxibenceno) y el 1,2-dimetoxietano.
Éteres vinílicos y acetilénicos
Los éteres vinílicos y acetilénicos son mucho menos comunes que los éteres alquílicos o arílicos. Los viniléteres, a menudo llamados éteres de enol, son productos intermedios importantes en síntesis orgánica. Los éteres acetilénicos son especialmente raros. El di-tert-butoxiaceteno es el ejemplo más común de esta clase de compuestos poco frecuentes.
Dietil éter
El término "éter" se utiliza también para referirse solamente al éter llamado "dietiléter, dietil éter" (según la IUPAC en sus recomendaciones de 1993 "etoxietano") o éter sulfúrico, de fórmula química CH3CH2OCH2CH3. El alquimista Raymundus Lullis lo aisló y descubrió en 1275. Fue sintetizado por primera vez por Valerius Cordus en 1540. Fue utilizado por primera vez como anestésico por Crawford Williamson Long el 30 de marzo de 1842.
Éteres corona
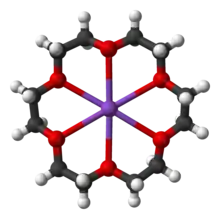
Son aquellas moléculas que tienen varios éteres en su estructura y que además forman un ciclo se denominan éteres corona. En el nombre del éter corona, el primer número hace referencia al número de átomos que conforman el ciclo, y el segundo número, al número de oxígenos en el ciclo. Otros compuestos relacionados son los criptatos, que contienen además de átomos de oxígeno, átomos de nitrógeno. A los criptatos y a los éteres corona se les suele denominar "ionóforos".
Estos compuestos tienen orientados los átomos de oxígeno hacia el interior del ciclo, y las cadenas alquílicas hacia el exterior del ciclo, pudiendo complejar cationes en su interior. La importancia de este hecho es que estos compuestos son capaces de solubilizar sales insolubles en disolventes apolares. Dependiendo del tamaño y denticidad de la corona, esta puede tener mayor o menor afinidad por un determinado catión. Por ejemplo, 12-corona-4 tiene una gran afinidad por el catión litio, 15-corona-5 por el catión sodio y el 18-corona-6 por el catión potasio.
.png.webp) Estructuras de los éteres corona más importantes: 12-corona-4, 15-corona-5, 18-corona-6, difenil-18-corona-6, y diaza-18-corona-6
Estructuras de los éteres corona más importantes: 12-corona-4, 15-corona-5, 18-corona-6, difenil-18-corona-6, y diaza-18-corona-6
En organismos biológicos, suelen servir como transporte de cationes alcalinos para que puedan atravesar las membranas celulares y de esta forma mantener las concentraciones óptimas a ambos lados. Por esta razón se pueden emplear como antibióticos, como la valinomicina, aunque ciertos éteres corona, como el 18-corona-6, son considerados como tóxicos, precisamente por su excesiva afinidad por cationes potasio y por desequilibrar su concentración en las membranas celulares.
Poliéteres
Se pueden formar polímeros que contengan el grupo funcional éter. Un ejemplo de formación de estos polímeros:
- R-OH + n(CH2)O → R-O-CH2-CH2-O-CH2-CH2-O-CH2-CH2-O-..
Los poliéteres son generalmente polímeros que contienen enlaces éter en su cadena principal. El término poliol se refiere generalmente a polioles de poliéter con uno o más grupos terminales funcionales, como un grupo hidroxilo. El término óxido u otros términos se utilizan para polímeros de masa molar elevada cuando los grupos terminales ya no afectan a las propiedades del polímero.
Los éteres de corona son poliéteres cíclicos. Algunas toxinas producidas por dinoflageladoss como la brevetoxina y la ciguatoxina son extremadamente grandes y se conocen como poliéteres cíclicos o en escalera.
Los poliéteres más conocidos son las resinas epoxi, que se emplean principalmente como adhesivos. Se preparan a partir de un epóxido y de un dialcohol.
Los epóxidos u oxiranos son éteres en donde el átomo de oxígeno es uno de los átomos de un ciclo de tres. Son pues compuestos heterocíclicos. Los ciclos de tres están muy tensionados, por lo que reaccionan fácilmente en reacciones de apertura, tanto con bases como con ácidos
Nomenclatura
- La nomenclatura de los éteres según las recomendaciones de 1993 de la IUPAC (actualmente en vigencia) especifican que estos compuestos pertenecientes al grupo funcional oxigenado deben nombrarse como alcoxialcanos, es decir, como si fueran sustituyentes. Se debe especificar al grupo funcional éter como de menor prioridad frente a la mayoría de cadenas orgánicas. Cada radical éter será acompañado por el sufijo oxi.
- Un compuesto sencillo, como por ejemplo CH3-O-C6H5 según las normas de la IUPAC se llamaría:
- metoxibenceno
- La nomenclatura tradicional o clásica (también aceptada por la IUPAC y válida para éteres simples) especifica que se deben nombrar por orden alfabético los sustituyentes o restos alquílicos de la cadena orgánica al lado izquierdo de la palabra éter. El compuesto anterior se llamaría según las normas antiguas (ya en desuso) de esta manera:
- fenil metil éter
Los éteres sencillos de cadena alifática o lineal pueden nombrarse añadiendo al final de la palabra éter el sufijo -ílico luego de los prefijos met-, et-, but-, etc., según lo indique el número de carbonos. Un ejemplo ilustrativo sería el siguiente:
Para mayores detalles, consulte Nomenclatura de Éteres y epóxidos
Nombre trivial
A menudo no se siguen las reglas de la IUPAC para los éteres simples. Los nombres triviales de los éteres simples (es decir, los que no tienen otros grupos funcionales o tienen pocos) son un compuesto de los dos sustituyentes seguido de "éter". Por ejemplo, éter etilmetílico (CH3OC2H5), difeniléter (C6H5OC6H5). Como en el caso de otros compuestos orgánicos, éteres muy comunes adquirieron nombres antes de que se formalizaran las reglas de nomenclatura. El éter dietílico se denomina simplemente éter, pero antes se llamaba aceite dulce de vitriolo. El metilfeniléter es anisol, porque originalmente se encontraba en el anís. Entre los éteres aromáticos se encuentran los furanos. Los acetales (éteres α-alcoxi R-CH(-OR)-O-R) son otra clase de éteres con propiedades características.
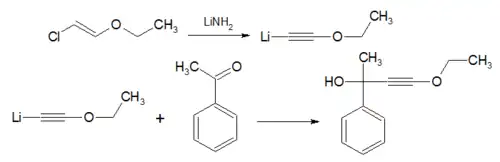
Síntesis de éteres
- La síntesis de éteres de Williamson es la síntesis de éteres más fiable y versátil. Este método implica un ataque SN2 de un ion alcóxido a un haluro de alquilo primario no impedido o tosialato. Los haluros de alquilo secundarios y los tosialatos se utilizan ocasionalmente en la síntesis de Williamson, pero hay competencia en las reacciones de eliminación, por lo que los rendimientos con frecuencia son bajos.
- El alcóxido generalmente se obtiene añadiendo Na, K o NaOH al alcohol.
- Síntesis de éteres mediante alcoximercuriación-desmercuriación. En el proceso de alcoximercuriación-desmercuriación se añade una molécula de un alcohol a un doble enlace de un alqueno. Se obtiene un éter tal como se muestra a continuación:
- Síntesis industrial: deshidratación bimolecular de alcoholes.
Deshidratación de alcoholes
La deshidratación de alcoholes produce éteres:[4]
- 2 R–OH → R–O–R + H2O a alta temperatura
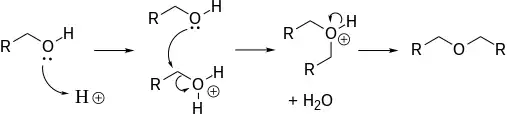
Esta reacción de sustitución nucleofílica directa requiere temperaturas elevadas (alrededor de 125 °C). La reacción está catalizada por ácidos, normalmente ácido sulfúrico. El método es eficaz para generar éteres simétricos, pero no éteres asimétricos, ya que cualquiera de los OH puede protonarse, lo que daría una mezcla de productos. El éter dietílico se produce a partir de etanol por este método. Los éteres cíclicos se generan fácilmente por este método. Las reacciones de eliminación compiten con la deshidratación del alcohol:
- R–CH2–CH2(OH) → R–CH=CH2 + H2O
La ruta de deshidratación suele requerir condiciones incompatibles con moléculas delicadas. Existen varios métodos más suaves para producir éteres.
Síntesis del éter de Williamson
Desplazamiento nucleofílico de haluro de alquilos por alcóxidos
- R–ONa + R′–X → R–O–R′ + NaX
Esta reacción se denomina Síntesis del éter de Williamson. Implica el tratamiento de un alcohol de origen con una base fuerte para formar el alcóxido, seguido de la adición de un compuesto alifático apropiado con un grupo saliente adecuado (R-X). Los grupos salientes (X) adecuados incluyen yoduro, bromuro o sulfonato. Este método no suele funcionar bien con halogenuros de arilo (por ejemplo, bromobenceno, véase la condensación de Ullmann más adelante). Asimismo, este método sólo da los mejores rendimientos para haluros primarios. Los haluros secundarios y terciarios son propensos a sufrir eliminación por E2 al exponerse al anión alcóxido básico utilizado en la reacción debido al impedimento estérico de los grandes grupos alquilo.
En una reacción relacionada, los haluros de alquilo sufren desplazamiento nucleofílico por fenóxidos. El R-X no puede utilizarse para reaccionar con el alcohol. Sin embargo, los fenoles pueden utilizarse para sustituir al alcohol manteniendo el haluro de alquilo. Como los fenoles son ácidos, reaccionan fácilmente con una base fuerte como el hidróxido de sodio para formar iones fenoxido. El ion fenóxido sustituirá entonces al grupo -X en el haluro de alquilo, formando un éter con un grupo arilo unido a él en una reacción con un mecanismo SN2.
- C6H5OH + OH− → C6H5–O− + H2O
- C6H5–O− + R–X → C6H5OR
Reacciones de los éteres
Los enlaces C-O que forman los éteres simples son fuertes. Son poco reactivos frente a todas las bases excepto las más fuertes. Aunque generalmente de baja reactividad química, son más reactivos que alcanos.
Los éteres especializados tales como epóxidos, ketales, y acetals son clases no representativas de éteres y se discuten en artículos separados. Las reacciones importantes se enumeran a continuación.[5]
Ruptura por HBr y HI
Los éteres reaccionan con HBr y HI concentrado, ya que estos reactivos son lo suficientemente ácidos para protonar al éter, y el ion bromuro y yoduro son buenos nucleófilos para la sustitución. Un éter protonado puede experimentar sustitución o eliminación, con la liberación de un alcohol.
Formación de peróxido
Cuando se almacenan en presencia de aire u oxígeno, los éteres tienden a formar explosivo peróxidos, como el hidroperóxido de éter dietílico. La reacción se acelera con la luz, los catalizadores metálicos y los aldehídos. Además de evitar las condiciones de almacenamiento susceptibles de formar peróxidos, se recomienda, cuando se utiliza un éter como disolvente, no destilarlo hasta sequedad, ya que los peróxidos que se hayan podido formar, al ser menos volátiles que el éter original, se concentrarán en las últimas gotas de líquido. La presencia de peróxido en muestras viejas de éteres puede detectarse agitándolas con una solución recién preparada de sulfato ferroso seguida de la adición de KSCN. La aparición de un color rojo sangre indica la presencia de peróxidos. Las peligrosas propiedades de los peróxidos de éter son la razón por la que el éter dietílico y otros éteres formadores de peróxidos como el tetrahidrofurano (THF) o el éter dimetílico de etilenglicol (1,2-dimetoxietano) se evitan en los procesos industriales.
Bases de Lewis
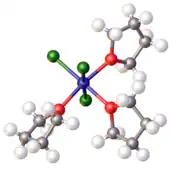
.
Los éteres sirven como bases de Lewis. Por ejemplo, el éter dietílico forma un complejo con trifluoruro de boro, es decir, eterato dietílico (BF3-OEt2). Los éteres también se coordinan con el centro de Mg en los reactivos de Grignard. El tetrahidrofurano es más básico que los éteres acíclicos. Forma complejos con muchos haluros metálicos.
Alfa-halogenación
Esta reactividad es similar a la tendencia de los éteres con átomos de hidrógeno alfa a formar peróxidos. La reacción con cloro produce alfa-cloroéteres.
Usos de los éteres
- Medio para extractar para concentrar ácido acético y otros ácidos.
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores diésel.
- Fuertes pegamentos.
- Antiinflamatorio abdominal para después del parto, exclusivamente de uso externo.
- Veneno para ratas.
Véase también
Referencias
- Unión Internacional de Química Pura y Aplicada. «éteres». Compendium of Chemical Terminology. Versión en línea (en inglés).
- Saul Patai, ed. (1967). The Ether Linkage. PATAI'S Chemistry of Functional Groups. John Wiley & Sons. ISBN 9780470771075. doi:10.1002/9780470771075.
- Vojinović, Krunoslav; Losehand, Udo; Mitzel, Norbert W. (2004). «Dichlorosilane-Dimethyl Ether Aggregation: A New Motif in Halosilane Adduct Formation». Dalton Trans. (16): 2578-2581. PMID 15303175. doi:10.1039/b405684a.
- Clayden; Greeves; Warren (2001). Organic chemistry. Oxford University Press. p. 129. ISBN 978-0-19-850346-0.
- Wilhelm Heitmann, Günther Strehlke, Dieter Mayer "Ethers, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2002. doi 10.1002/14356007.a10_023
- F.A.Cotton, S.A.Duraj, G.L.Powell, W.J.Roth (1986). «Estudios estructurales comparativos de los solvatos tetrahidrofuránicos de cloruro de metales de transición(III) de primera fila». Inorg. Chim. Acta 113: 81. doi:10.1016/S0020-1693(00)86863-2.
Enlaces externos
- EFOA
- ILPI Página web sobre éteres (en inglés).
- An Account of the Extraordinary Medicinal Fluid, called Aether, (en castellano, Relato del Extraordinario Fluido Médico llamado Éter) por M. Turner, circa 1788, en el Proyecto Gutenberg (en inglés).