Fraccionamiento de la dosis
En radioterapia, el fraccionamiento de la dosis es la división de la dosis total de radiación ionizante de un tratamiento, en sesiones o fracciones a lo largo del tiempo, que se determina por múltiples factores como: la intención del tratamiento (paliativa o radical), el volumen de tratamiento, el tipo de enfermedad oncológica y la localización tumoral.
El fraccionamiento de la dosis implica las principales variables en un curso de radioterapia como son el número de fracciones, la dosis por fracción, la dosis total administrada y el tiempo total de tratamiento.
El fraccionamiento de la dosis en radioterapia es una forma de optimizar el efecto de la radiación sobre el tumor y los tejidos sanos, junto con la dosis total administrada y el intervalo de tiempo entre sesiones. Permite disminuir los efectos tóxicos de la radiación ionizante en los tejidos normales, aumentando el efecto antitumoral en los tejidos cancerosos por:[1]
- Reparación de las lesiones radioinducidas entre cada fracción en el tejido normal.
- Mínima reparación en el tejido tumoral entre cada fracción.
La dosis de radioterapia se mide en Gray[2] (Gy) o centigray (cGy), que corresponde a la dosis absorbida de radiaciones ionizantes por volumen de tejido (normal o tumoral).
Introducción histórica
En las primeras décadas del siglo XX, los fraccionamientos de la irradiación utilizados en la radioterapia del cáncer estuvieron basados en nociones empíricas.
Los primeros tratamientos con rayos X consistían en esquemas fraccionados: Emil Herman Grubbé trató a una mujer con cáncer de mama en 18 fracciones diarias de 1 hora,[3] y Leopold Freund a un niño con nevus piloso mediante 10 sesiones diarias de 2 horas;[4] ambos en 1897.
Debido a que los equipos generadores de rayos X de la época no producían altas tasas de dosis, la observación del paciente a lo largo del tiempo era imprescindible para establecer la respuesta al tratamiento. Henri Coutard observó que los pacientes con cáncer de cabeza y cuello tratados con rayos X con dosis múltiples tenían menos efectos secundarios graves que los que se trataban con dosis única.[5]
Las investigaciones en radiobiología permitieron un mayor conocimiento de los mecanismos de respuesta celular a la radiación y una mayor relación entre principios radiobiológicos y observaciones clínicas.[6]
Los mecanismos biológicos y efectos producidos en los tumores malignos y tejidos normales relacionados con el tiempo total de irradiación (OTT, overall treatment time), la regeneración tumoral y la dosis por fracción fueron establecidos en 1989 por Fowler.[7]
El impacto del fraccionamiento en radioterapia en el control tumoral y la diminución de los efectos secundarios radioinducidos es tan importante como las mejoras tecnológicas aportadas como la radioterapia de intensidad modulada (IMRT) y la radioterapia guiada por imagen (IGRT).
Tipos de fraccionamiento
Existen múltiples formas de fraccionamiento en radioterapia, el fraccionamiento normal y el resto de fraccionamientos que se denominan fraccionamientos alterados.
Fraccionamiento convencional
El fraccionamiento convencional, también llamado estándar o normal, consiste en la administración de 180-200 cGy al día, en una sola fracción, cinco días a la semana y de lunes a viernes. Con el fraccionamiento estándar se pueden alcanzar dosis de 70 Gy en siete semanas en un tratamiento radical o 50 Gy en cinco semanas en una radioterapia adyuvante.
El fraccionamiento estándar es el más utilizado en la clínica por obtener el mejor índice terapéutico en la mayoría de los tumores.
El fraccionamiento convencional fue ampliamente utilizado en la escuela francesa por Baclese[8] en Paris. La prolongada duración de la radioterapia durante varias semanas permite el desarrollo de la proliferación celular de los tejidos normales de respuesta aguda y reduce la toxicidad radioinducida a niveles aceptables.
Hiperfraccionamiento
El hiperfraccionamiento es la administración de fracciones menores de 1,8 Gy, varias veces al día, generalmente dos veces al día, entre 115-120 cGy, cinco días a la semana, separadas unas de otras al menos 6 horas, sin variar la duración total de tratamiento. El intervalo mínimo entre fracciones debe ser igual o superior a 6 horas debido a que este es el tiempo necesario para el desarrollo de la reparación del daño subletal radioinducido en los tejidos normales de respuesta lenta.[9]
Con el hiperfraccionamiento se puede alcanzar una dosis total mayor, hasta 80 Gy, aumentando el control tumoral, con una frecuencia de efectos secundarios agudos algo mayor que el fraccionamiento estándar pero reversibles y disminuyendo los efectos tóxicos tardíos.[10]
El hiperfraccionamiento se ha empleado en la década de 1990 en tumores de cabeza y cuello,[11] pero ha sido prácticamente abandonado en la práctica clínica por la irrupción de la radioterapia de intensidad modulada (IMRT), la radioquimioterapia concomitante y por el problema de accesibilidad y adherencia al tratamiento del paciente a los servicios de radioterapia para este tipo de fraccionamiento.
Fraccionamiento acelerado
El fraccionamiento acelerado es la administración de fracciones de radiación normales o convencionales, dos veces al día, para alcanzar la misma dosis total. Con el fraccionamiento acelerado se acorta el tiempo total de tratamiento para aumentar el control tumoral en aquellos tumores que son de rápido crecimiento.
El fraccionamiento acelerado tiene la desventaja de que los efectos secundarios agudos y crónicos son de mayor grado o intensidad.
El fraccionamiento acelerado y el hiperfraccionamiento se han combinado en múltiples ensayos clínicos con el objetivo de reducir el tiempo total de tratamiento y aumentar el control tumoral.
Los metaanálisis realizados sobre estos fraccionamientos alterados mejoran la supervivencia en los pacientes con cáncer de cabeza y cuello. La comparación de los diferentes tipos de radioterapia con fraccionamientos alterados indica que el hiperfraccionamiento proporciona el mayor beneficio.[12]
Otra forma de combinación de hiperfraccionamiento y fraccionamiento acelerado es el hiperfraccionamiento acelerado continuo (CHART, continuous hyperfractionated accelerated radiotherapy) en la que la radioterapia se administra en tres sesiones al día de 1,5 Gy, separadas al menos 6 horas, de forma continua durante un periodo de 12 días, incluido el fin de semana. Se ha realizado en cáncer de pulmón en la década de 1990 con mejoría en la supervivencia comparado con el fraccionamiento estándar, pero con mayor toxicidad aguda (esofagitis severa).[13] Este fraccionamiento ha sido abandonado por los mejores resultados obtenidos con la radioquimioterapia con fraccionamiento normal.
Hipofraccionamiento
El hipofraccionamiento es la administración de sesiones de radiación de mayor dosis que el fraccionamiento normal (dosis por fracción mayor de 2 Gy) que se utiliza en determinados tumores por sus características radiobiológicas como el melanoma.
El hipofraccionamiento es muy utilizado en la radioterapia paliativa donde el objetivo es aliviar de forma rápida los síntomas que provoca el tumor, con baja probabilidad de efectos tóxicos agudos, aunque aumenta la probabilidad de efectos secundarios tardíos, que no suelen aparecer por la evolución de la enfermedad de este grupo de pacientes. Los fraccionamientos en radioterapia paliativa más utilizados son: 1) la dosis única de 8 Gy, 2) cinco sesiones de 4 Gy y 3) diez sesiones de 3 Gy.[14]
Los hipofraccionamientos moderados se han implantado en la radioterapia de tumores muy frecuentes como el cáncer de mama[15] y el cáncer de próstata[16] porque acortan la duración total de la radioterapia sin aumentar la toxicidad de forma significativa.
La escuela inglesa introdujo el hipofraccionamiento de 3,6 Gy/día, cinco veces a la semana hasta administrar 54 Gy. El acortamiento del tiempo total de tratamiento a 3 semanas está basado en la hipótesis del mayor control tumoral en las neoplasias con alto grado de proliferación.
Split-course
Es una variedad de fraccionamiento alterado donde existe una pausa determinada de una a tres semanas de las sesiones de radioterapia, a mitad de un curso de tratamiento con la intención de que el paciente se recupere de los efectos secundarios.[17] El split-course apenas se utiliza en radioterapia en el siglo XXI por el alto riesgo de crecimiento tumoral acelerado durante los días de pausa de la radiación.
Boost concomitante
El boost, refuerzo o sobreimpresión concomitante es una variación de hiperfraccionamiento acelerado, en la que se administra una segunda dosis de radiación a la porción del volumen que contiene el tumor, durante el curso de la radioterapia fraccionada convencional, dentro de la misma sesión de radioterapia,[18] o al menos seis horas después cuando se realiza con radioterapia conformada en tres dimensiones.
El boost integrado simultáneo (SIB, simultaneous integrated boost) permite la administración simultánea de diferentes niveles de dosis de radiación a diferentes volúmenes de tratamiento dentro de una única sesión de radioterapia.[19] El SIB es una forma de fraccionamiento acelerado que se ha implantado con el avance tecnológico de la IMRT y cumple los objetivos de acortar la duración total de un curso de radioterapia (OTT, overall treatment time) y aumentar la dosis al volumen tumoral.
Hipofraccionamiento extremo
El hipofraccionamiento extremo es la administración de dosis altas de radiación por sesión, en pocas fracciones de un curso de tratamiento, también llamado radioterapia ablativa. El ejemplo de hipofraccionamiento extremo es la radiocirugía cerebral[20] en la que se administra una única sesión que oscila entre los 12 y los 24 Gy en un volumen relativamente pequeño y la radioterapia estereotáctica extracerebral o SBRT (Stereotactic Body Radiation Therapy).[21]
Bases radiobiológicas del fraccionamiento
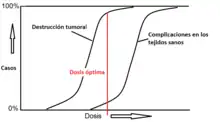
El objetivo fundamental de la radioterapia en el cáncer es administrar la dosis de radiación necesaria para conseguir erradicar o controlar el tumor y que esta dosis de radiación no afecte a los tejidos sanos, para provocar la menor cantidad posible de efectos secundarios o tóxicos.
El fraccionamiento de la dosis de radiación produce una serie de fenómenos en las células normales diferentes de las células tumorales, que tradicionalmente se han llamado las "R" de la radioterapia.[22]
- Reparación: Los tejidos irradiados tanto tumorales como normales, tienen la capacidad de reparar la mayoría de las lesiones subletales, pero esta capacidad de reparación es mayor en los tejidos normales incluidos dentro del volumen de irradiación entre cada fracción. El fraccionamiento permite dañar al tumor con menos efectos tóxicos sobre el tejido normal.
- Redistribución de las células dentro del ciclo celular al ser destruidas principalmente por la radiación las células en fases sensibles del ciclo como en fase G2 y mitosis, quedando en el tejido las células más resistentes. La redistribución de las células permite una sincronización celular, avanzando a fase G2 y mitosis parte del resto de células tumorales supervivientes, reclutando células en fases quiescentes que entrarán en el ciclo celular por la pérdida previa de células que estaban en división celular.
- Reoxigenación: La destrucción de células tumorales cercanas a los capilares sanguíneos que están oxigenadas, permite la reoxigenación de las células tumorales más alejadas de los capilares, lo que aumenta la radiosensibilidad en la siguiente fracción de radiación.
- Repoblación celular: Ocurre tanto en células tumorales como en células sanas. Debido a que la repoblación tumoral depende de la fracción de crecimiento, el tiempo de duplicación, el volumen tumoral y la oxigenación. El tiempo que transcurre entre dos fracciones de radioterapia es fundamental para permitir la reparación del tejido sano y evitar la repoblación tumoral acelerada.
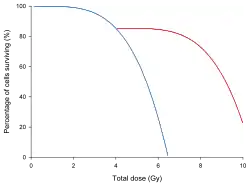
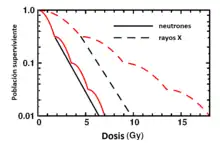 Proporción de supervivencia de una población de células de mamífero sometidas a una dosis de radiación única (línea continua) o fraccionada (línea discontinua)
Proporción de supervivencia de una población de células de mamífero sometidas a una dosis de radiación única (línea continua) o fraccionada (línea discontinua)
Los efectos del fraccionamiento de la dosis de radiación puede demostrarse en estudios radiobiológicos sobre cultivos celulares, tanto de células normales como cancerosos, sometidos a una radiación de sesión única, comparado con radiación fraccionada, estableciéndose curvas de supervivencia celular.
Los experimentos en radiobiología han descubierto que a medida que aumenta la dosis de radiación absorbida, disminuye el número de células que sobreviven. También han descubierto que si la radiación se fracciona en dosis más pequeñas, con uno o más períodos de descanso entre ellos, mueren menos células. Esto se debe a los mecanismos de reparación del ADN[23] y otras biomoléculas como las proteínas. Estos mecanismos pueden sobreexpresarse en las células cancerosas, por lo que se debe tener precaución al usar los resultados de una línea celular cancerosa para hacer predicciones de células sanas si se sabe que la línea celular cancerosa es resistente a fármacos citotóxicos como el cisplatino. Los procesos de autorreparación del ADN en algunos organismos son excepcionalmente buenos; por ejemplo, la bacteria Deinococcus radiodurans puede tolerar una dosis de 15 000 Gy (1,5 MRad).[24]
Modelo lineal cuadrático
El modelo lineal cuadrático en radioterapia es el modelo radiobiológico clásico que está basado en los siguientes principios radiobiológicos:
La radiación ionizante provoca lesiones en el ADN por acción directa y sobre todo por acción indirecta mediante los radicales libres que se producen por la ionización del agua en presencia de oxígeno. Estos daños en el ADN producen alteraciones cromosómicas que impiden la división celular y conducen a la muerte celular.
La muerte celular por radiación tiene por tanto dos componentes:
- El componente alfa (α), que corresponde a la muerte celular por acción directa, que es un daño celular que se produce de una sola vez o un solo golpe y que no es posible reparar (lesión letal).
- El componente beta (β) corresponde a la muerte celular por acción indirecta o que la muerte celular se produce por las sucesivas acumulaciones de lesiones subletales, hasta el punto en que ya no es posible reparar.
La relación de los dos componentes de la muerte celular se determina con el cociente alfa/beta (α/β) que corresponde a la dosis de radiación donde la muerte celular está definida por ambos componentes en la misma proporción, sin que predomine un componente sobre otro.
El componente directo (α) y el componente indirecto (β) varían en función de la dosis (D) según la siguiente igualdad: αD = βD2 Siendo D la dosis, α el componente que varía de manera lineal con la dosis y β el componente cuadrático, si se duplica la dosis, el efecto lineal se duplica, mientras que el efecto cuadrático aumenta cuatro veces más.
Según el cociente α/β, propio de cara tejido, tanto normal como tumoral, se pueden clasificar de una forma simple como tejidos con cocientes α/β altos y tejidos con cociente α/β bajos,[25] que tienen las siguientes características
Tejidos con cocientes α/β altos
- Son muy sensibles a la radiación
- Con dosis bajas se produce la muerte celular por acción directa.
- Son los responsables de los efectos secundarios agudos.
- Los tejidos con alta tasa de recambio celular y baja capacidad de reparación celular tienen cocientes α/β altos.
- La mayoría de los tumores malignos tienen cocientes α/β altos, aproximadamente de 10 Gy, excepto algunos como el melanoma y el cáncer de próstata.
- Con dosis más altas de radiación predomina la muerte celular por acumulación de daño subletal.
Tejidos con cocientes α/β bajos
- Son más resistentes a la radiación.
- Necesitan dosis más altas de radiación para conseguir la muerte celular por acumulación de daños subletales por acción indirecta de la radiación.
- Son los responsables de los efectos secundarios tardíos.
- Son tejidos con baja tasa de división celular y mejor capacidad de reparación de daño subletal.
- Cocientes α/β bajos son aproximadamente de 3 Gy.
Referencias
- Felipe A. Calvo, Oncología Radioterápica (2010). «4.7». Fraccionamiento de la dosis en radioterapia. Arán. p. 76. ISBN 978-84-92977-05-5.
- Centro Español de Metrología (2019). «El Sistema Internacional de Unidades». Oficina Internacional de Pesas y Medidas.
- Richard F. Mould (2018). «Emil Herman Grubbé (1875–1960) with special reference to priority for X-ray cancer therapy». NOWOTWORY Journal of Oncology. doi:10.5603/NJO.2018.0046.
- H D Kogelnik (1997). «Inauguration of radiotherapy as a new scientific speciality by Leopold Freund 100 years ago». Radiother Oncol. doi:10.1016/s0167-8140(96)01887-7.
- Jens Nielsen (2010). «Roentgen Treatment in Cancer of the Larynx». Acta Radiologica. doi:10.3109/00016924209135613.
- G H Fletcher (1983). «Keynote address: the scientific basis of the present and future practice of clinical radiotherapy». Int J Radiat Oncol Biol Phys. doi:10.1016/0360-3016(83)90399-1.
- John F. Fowler (1989). «The linear-quadratic formula and progress in fractionated radiotherapy». Br J Radiol. doi:10.1259/0007-1285-62-740-679.
- Jacques Bernier (2004). «Radiation oncology: a century of achievements». Nature reviews cancer.
- H D Thames Jr (1983). «Accelerated fractionation vs hyperfractionation: rationales for several treatments per day». Int J Radiat Oncol Biol Phys. doi:10.1016/0360-3016(83)90089-5.
- Supriya Mallick (2016). «Altered fractionation radiotherapy in head and neck squamous cell carcinoma». J Egypt Natl Canc Inst. doi:10.1016/j.jnci.2016.02.004.
- Bo Zhu (2019). «Accelerated Hyperfractionated Radiotherapy versus Conventional Fractionation Radiotherapy for Head and Neck Cancer: A Meta-Analysis of Randomized Controlled Trials». Journal of Oncology. doi:10.1155/2019/7634746.
- Cochrane Systematic Review (2010). «Radioterapia hiperfraccionada o acelerada para el cáncer de cabeza y cuello». Cochrane Library. doi:10.1002/14651858.CD002026.pub2.
- M Saunders (1997). «Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. CHART Steering Committee». Lancet. doi:10.1016/s0140-6736(97)06305-8.
- Ashok Kumar (2019). «Radiation for Palliation: Role of Palliative Radiotherapy in Allevieating Pain/Symptoms in a Prospective Observational Study at Two Tertiary Care Centers». Indian J Palliat Care. doi:10.4103/IJPC.IJPC_35_19.
- Joanne S Haviland (2013). «The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised controlled trials». The Lancet Oncology. doi:10.1016/S1470-2045(13)70386-3.
- Patrick A Kupelian (2005). «Hypofractionated intensity-modulated radiotherapy (70 gy at 2.5 Gy per fraction) for localized prostate cancer: long-term outcomes». Int J Radiat Oncol Biol Phys. doi:10.1016/j.ijrobp.2005.05.054.
- Lars R. Holsti (1967). «Split-Course Radiotherapy of Cancer». Acta Radiologica. doi:10.3109/02841856709138592.
- R Knee (1985). «Concomitant boost radiotherapy for advanced squamous cell carcinoma of the head and neck». Radiother Oncol. doi:10.1016/s0167-8140(85)80055-4.
- G Studer (2006). «IMRT using simultaneously integrated boost (SIB) in head and neck cancer patients». Radiat Oncol. doi:10.1186/1748-717X-1-7.
- Hany Soliman (2016). «Stereotactic radiosurgery (SRS) in the modern management of patients with brain metastases». Oncotarget. doi:10.18632/oncotarget.7131.
- Lijun Ma (2017). «Emerging technologies in stereotactic body radiotherapy». Chin Clin Oncol. doi:10.21037/cco.2017.06.19.
- Rajamanickam Baskar (2012). «Cancer and radiation therapy: current advances and future directions». Int J Med Sci. doi:10.7150/ijms.3635.
- Nimrat Chatterjee (2018). «Mechanisms of DNA damage, repair and mutagenesis». Environ Mol Mutagen. PMID 28485537. doi:10.1002/em.22087.
- Bakermans, Corien (2015). «Microbial Evolution under Extreme Conditions». Polyextremophiles. Walter de Gruyter. p. 154. ISBN 9783110340716.
- Vicente Pedraza Muriel (2012). «Dose fractionation in cancer radiotherapy». An R Acad Nac Med (Madr). PMID 24298859.