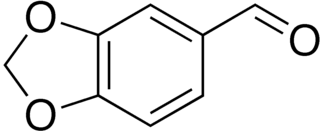
Piperonal
El piperonal, también conocido como heliotropina, es un compuesto orgánico que se encuentra comúnmente en fragancias y sabores. La molécula está relacionada estructuralmente con el benzaldehído y la vainillina. Existe como un sólido de color blanco o incoloro. Tiene un olor floral comúnmente descrito como similar al de la vainillina y la cereza. Se utiliza como aromatizante y en perfumes.
| Piperonal | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| 1,3-Benzodioxol-5-carbaldehido | ||
| Identificadores | ||
| Número CAS | 120-57-0 30024-74-9, 659726-32-6 | |
| Código ATC | No adjudicado | |
| PubChem | 8438 | |
| ChemSpider | 13859497 | |
| ChEBI | 8240 | |
| Datos químicos | ||
| Fórmula | C8H6O3 | |
|
C1OC2=C(O1)C=C(C=C2)C=O
| ||
|
InChI=SATCULPHIDQDRE-UHFFFAOYSA-N
| ||
| Sinónimos |
Ver lista (1) Piperonil aldehído
(2) 120-57-0 (3) Geliotropina | |
| Datos físicos | ||
| Densidad | 1.337 g/cm³ | |
| P. de fusión | 35-37 °C (0 °F) | |
| P. de ebullición | 262-264 °C (-181 °F) | |
| Datos clínicos | ||
| Nombre comercial | Francia: Para Repulsif; Reino Unido: Rappell. | |
| Uso en lactancia | No existen datos o estudios actualmente. | |
| Cat. embarazo | No existen datos o estudios actualmente. (EUA) | |
| Estado legal | (Precursor químico en la elaboración de drogas ilegales) (MEX) | |
| Vías de adm. |
Vías de administración | |
Usos
El piperonal tiene su uso como sinergista de insecticidas y como ingrediente de perfumes y fragancias. Está clasificado entre los insecticidas repelentes como un pesticida. Un repelente para piojos que contiene piperonal está disponible en el mercado.[1]
Química
El piperonal se prepara por oxidación del isosafrol, que se produce naturalmente. También se prepara en una secuencia de múltiples etapas a partir del catecol o 1,2-metilendioxibenceno por condensación con ácido glioxílico.
Industrial
El piperonal es un aldehído. Los aldehídos a menudo participan en reacciones de condensación o auto-polimerización. Estas reacciones son exotérmicas y frecuentemente son catalizadas por ácidos. Los aldehídos se oxidan fácilmente para dar ácidos carboxílicos. Los gases inflamables y / o tóxicos son generados por la combinación de aldehídos con compuestos diazo, azo, ditiocarbamatos, nitruros y agentes reductores fuertes. Los aldehídos pueden reaccionar con el aire para dar ácidos peroxo primero, y en última instancia ácidos carboxílicos. Estas reacciones de autooxidación se activan por la luz, son catalizadas por sales de metales de transición, y son autocatalíticas (catalizadas por los productos de la reacción). La adición de estabilizadores (antioxidantes) a los envíos de aldehídos retrasa su autooxidación. El piperonal es sensible a la luz y puede reaccionar con materiales oxidantes.[2]
Farmacología
La reducción da alcohol de piperonilo y la oxidación da el ácido piperico. El piperonal se puede utilizar en la síntesis de Tenamfetamina (3,4-metilendioxianfetamina o MDA) a través del nitroestireno sustituido vía una reacción de condensación. Este intermediario puede ser reducido por un agente reductor fuerte tal como hidruro de litio y aluminio (LiAlH4) para formar MDA.
Metabolismo
En los mamíferos los compuestos de metilenodioxifenilo, el piperonal es un miembro de esta clase, experimentan degradación en gran parte a través de la oxidación del grupo metileno en dióxido de carbono. El piperonal se convierte en alcohol de piperonilo el cual es metabolizado a un conjugado glucósido.[3]
Toxicidad
El piperonal es moderadamente tóxico. La probable dosis letal oral (en humanos) es de 0.5-5 g/kg; Unos 450 gramos para persona de 70 kg.[4] Es moderadamente tóxico por ingestión y por vía intraperitoneal. Puede causar depresión del sistema nervioso central. Es irritante de la piel humana.[5] La exposición ocupacional al piperonal puede producirse por inhalación y contacto dérmico con este compuesto en los lugares de trabajo donde se produce o es utilizado. Puesto que este compuesto se usa en la industria de perfumes y fragancias, la población general puede estar expuesta al piperonal a través de del uso de productos de consumo que contienen este compuesto. El piperonal se utiliza también como un saborizante y la exposición puede producirse a través de la ingestión de alimentos que contienen este compuesto.[6]
Referencias
- C. Sweetman, Sean (2009). Martindale: The Complete Drug Reference (36ª edición). United Kingdom: The Pharmaceutical Press. p. 2034. ISBN 978-0-85369-840-1.
- Cameo Chemicals. «Piperonal» (en inglés). Consultado el 30 de diciembre de 2012.
- Menzie, C. M. (l974). «Metabolism of Pesticides, An Update.». Wildlife (Washington, DC: U.S. Department of the Interior, Fish, Wild-life Service, Special Scientific Report) (184): 257-257.
- Gosselin, R.E.; H.C. Hodge, R.P. Smith, and M.N. Gleason (1976). Clinical Toxicology of Commercial Products: 169.
- Lewis, R.J. (1996). Sax's Dangerous Properties of Industrial Materials. (Nueva York). 1-3: 2716.
- NIOSH, National Occupational Exposure Survey (1983). Probable Routes of Human Exposure of Piperonal (en inglés).