Hemo A
Un hemo A (o heme A) es un hemo, es decir un complejo de coordinación formado por un ligando tetradentado macrocíclico llamado porfirina, que se encuentra quelando a un átomo de hierro. El hemo A es una biomolécula y se produce naturalmente en muchos organismos.
| Hemo A | ||
|---|---|---|
 | ||
 | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 18535-39-2[1] | |
| ChEBI | 24479 | |
| ChemSpider | 21106444 | |
| PubChem | 5288529 | |
|
C/C(C)=C\CCC(\C)=C\CCC(\C)=C\CCC(O)c1c2/C=C\3C(\C)=C(\C=C)/C=4/C=C8/C(/C)=C(/CCC(O)=O)\C7=C\C5C(\CCC(O)=O)=C(\C=O)/C6=C/c(c1C)n2[Fe-2]([N+]/3=4)(N56)N78
| ||
|
InChI=1S/C49H59N4O6.Fe/c1-9-34-31(6)39-25-45-49(46(55)18-12-17-30(5)16-11-15-29(4)14-10-13-28(2)3)33(8)40(52-45)24-44-37(27-54)36(20-22-48(58)59)43(53-44)26-42-35(19-21-47(56)57)32(7)38(51-42)23-41(34)50-39;/h9,13,15,17,23-27,43,46,55H,1,10-12,14,16,18-22H2,2-8H3,(H4-,50,51,52,53,56,57,58,59);/q-1;+2/p-2/b29-15+,30-17+,42-26-;
Key: RRRJRRNGYOECDS-ZHOBENDVSA-L | ||
| Propiedades físicas | ||
| Masa molar | 852 837 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Relación con otros hemos
El hemo A difiere del hemo B en que la cadena lateral metilo en la posición 8 del anillo se oxida para formar un grupo formilo y en la posición 2, el grupo vinilo tiene añadido un grupo hidroxietilfarnesilo, una cadena isoprenoide. El hemo A es similar al hemo O, en cuanto a que ambos poseen este grupo farnesilo en la posición 2, pero el hemo O no posee el grupo formilo en la posición 8, sino que aún contiene el grupo metilo. La primera estructura correcta del hemo A, la cual estuvo basada en mediciones de espectros de infrarrojo y RMN de la forma reducida (la que posee Fe(II)), fue publicada en 1975.[2]
Historia
El hemo A fue primeramente aislado por el bioquímico alemán Otto Warburg en 1951 quien además demostró que se trataba de un componente de la proteína integral de membrana citocromo c oxidasa.[3]
Estereoquímica
La pregunta final en cuanto a la exacta configuración geométrica del primer carbon en la posición 3 del anillo I, es decir el carbono unido al grupo hidroxilo, ha sido recientemente contestada en una publicación donde se le asigna la configuración quiral S.[4]
Al igual que el hemo B, el hemo A a menudo se encuentra unido a la apoproteína por medio de un enlace de coordinación entre el hierro del hemo y una cadena lateral de aminoácido altamente conservada. En la citocromo c oxidasa, una importante proteína respiratoria, este quinto ligando para el grupo hemo A en el centro de reacción del oxígeno es un grupo histidilo.[5] Este es un ligando común para muchas hemoproteínas, incluyendo la hemoglobina y la mioglobina.
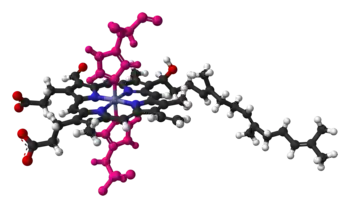
Grupo hemo en la citocromo c oxidasa, unido mediante dos residuos de histidina (se muestran en rosa)[6]
Un ejemplo de metaloproteína que contiene el grupo heme A es la citocromo c oxidasa. Esta proteína altamente compleja contiene hemo A en dos sitios diferentes, cada uno con una función diferente. El hierro del heme A del citocromo A se encuentra hexacoordinado, esto es, que se encuentra unido con otros seis átomos. El hierro del grupo heme A del citocromo a3, algunas veces se encuentra unido a otros cinco átomos, dejando el sexto sitio disponible para unirse a una molécula de oxígeno diatómico.[6] Adicionalmente esta enzima une 3 átomos de cobre, magnesio, cinc, y varios iones de sodio y magnesio. Los dos grupos hemo A de la citocromo c oxidasa se piensa que intercambian electrones entre ellos, con los átomos de cobre y con la proteína citocromo c que se encuentra estrechamente asociada.
Se piensa que la citocromo c oxidasa es la responsable de conservar la energía provista por la reducción del oxígeno diatómico, bombeando protones dentro del espacio interno mitocondrial. En este proceso tanto el grupo formilo como el grupo hidroxietilfarnesilo del grupo hemo A, tendrían un importante papel, tal como ha publicado el influyente grupo de S. Yoshikawa.[7]
Véase también
- Hemo
- Hemo B
- Hemo C
- Hemo O
- Hemoproteína
- Citocromo c oxidasa (Complejo IV de la respiración celular)
Referencias
- Número CAS
- Caughey, W.S. et al. (1975). «Heme A of Cytochrome c Oxidase». Journal of Biological Chemistry 250: 7602-7622.
- Warburg, O and Gewitz H S. (1951). «Cytohämin aus Herzmuskel». Zeitschrift für Physiologische Chemie 288: 1-4. doi:10.1515/bchm2.1951.288.1.1.
- Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T.; Aoyama; Yao; Muramoto; Shinzawa-Itoh; Yoshikawa; Tsukihara (2005). «Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution». Acta Crystallographica D 61 (10): 1373-1377. doi:10.1107/S0907444905023358.
- Tsukihara T, Shimokata K, Katayama Y, Shimada H, Muramoto K, Aoyama H, Mochizuki M, Shinzawa-Itoh K, Yamashita E, Yao M, Ishimura Y, Yoshikawa S.; Shimokata; Katayama; Shimada; Muramoto; Aoyama; Mochizuki; Shinzawa-Itoh; Yamashita; Yao; Ishimura; Yoshikawa (2003). «The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process». PNAS 100 (26): 15304-15309. PMC 307562. PMID 14673090. doi:10.1073/pnas.2635097100.
- Yoshikawa, S.; Shinzawa-Itoh, K.; Nakashima, R.; Yaono, R.; Yamashita, E.; Inoue, N.; Yao, M.; Fei, M. J. et al. (1998). «Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase». Science 280 (5370): 1723-1729. PMID 9624044. doi:10.1126/science.280.5370.1723.
- Shimokata K, Katayama Y, Murayama H, Suematsu M, Tsukihara T, Muramoto K, Aoyama H, Yoshikawa S, Shimada H.; Katayama; Murayama; Suematsu; Tsukihara; Muramoto; Aoyama; Yoshikawa et al. (2007). «The proton pumping pathway of bovine heart cytochrome c oxidase». PNAS 104 (10): 4200-4205. PMC 1820732. PMID 17360500. doi:10.1073/pnas.0611627104.