Isótopo estable
Un isótopo estable es un nucleido que no es radiactivo (a diferencia de los radionucleidos), por lo que no experimenta de forma espontánea decaimiento radiactivo.
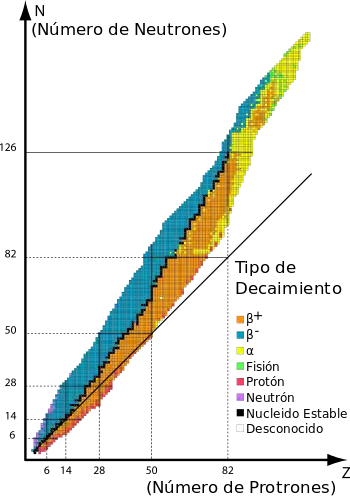
Los nucleidos en color naranja y en color azul son inestables, con los cuadrados negros entre estas regiones representando isótopos estables. La línea continua que pasa por debajo de muchos de los nucleidos representa la posición teórica en el gráfico de nucleidos para la que el número de protones es el mismo que el número de neutrones. El gráfico muestra que los elementos con más de 20 protones deben de tener más neutrones que protones para ser estables.
Un elemento químico tiene uno o varios isótopos, de los cuales todos, algunos, o ninguno, pueden ser isótopos estables. Los isótopos que no son estables (radioisótopos), a diferencia de los estables, se desintegran para dar lugar a otros nucleidos emitiendo partículas o radiación electromagnética.
Condiciones de estabilidad
Se conocen unos 2500 nucleidos, de los cuales son estables menos de 300. La representación del número de neutrones (N) frente al número de protones (número atómico, Z) indicándose los isótopos estables se denomina carta de Segrè (diseñada por el físico Emilio Segrè).
Por ejemplo, el tecnecio no tiene ningún isótopo estable, mientras que el estaño tiene diez isótopos estables.
La región de estabilidad definida por esta gráfica es estrecha, cumpliéndose que para números de masa (A) pequeños el número de protones y de neutrones es similar, mientras que conforme aumenta A, la relación N/Z también aumenta (hasta un valor de aproximadamente 1,6).
Los nucleidos que están a la derecha de esta franja de estabilidad tienen demasiados protones para los neutrones que poseen, por lo que los núcleos se rompen por repulsión.
Los nucleidos que están a la izquierda tienen demasiados neutrones para los protones que poseen, produciéndose entonces un proceso de decaimiento que convierte neutrones en protones.
Se verifica que para Z=43, Z=61 o Z≥83 no hay ningún nucleido estable.
La fuerza nuclear fuerte es la encargada de mantener unido el núcleo atómico, a pesar de que la fuerza electromagnética haga que los elementos con el mismo signo de carga eléctrica (los protones, que tienen todos una carga positiva) se repelan. Sin embargo, la fuerza nuclear fuerte tiene un radio de acción muy pequeño, lo que explica que no se encuentren núcleos estables para Z≥83, ya que, al aumentar el número de protones, aumenta el tamaño del núcleo, por lo que la fuerza nuclear fuerte se ve sobrepasada por la fuerza electromagnética, que logra llegar a expulsar algún protón.
Empleo
Los isótopos estables se emplean en:
- Control de calidad de los alimentos: Para trazar la procedencia y composición de alimentos
- Ecología: Para estudiar la dieta de especies silvestres
- Paleoclimatología: Para realizar mediciones de gases atrapados en hielo
Definición de estabilidad, y nucleidos naturales
La mayor parte de los nucleidos presentes en la naturaleza son estables (actualmente 254; véase la lista al final de este artículo). También son conocidos alrededor de otros 34 nucleidos más que son radiactivos con una vida media (también conocida) lo suficientemente larga como para estar también presentes en la naturaleza (hasta completar un total de 288 nucleidos "naturales"). Si la vida media de un nucleido es comparable o mayor que la edad de la Tierra (4 500 millones de años), una cantidad significativa habrá sobrevivido desde la formación del Sistema Solar, por lo que se denomina nucleido primordial, contribuyendo de ese modo a la composición isotópica natural de cada elemento químico. Radioisótopos presentes primordialmente se detectan fácilmente con vidas medias del orden de 700 millones de años (como por ejemplo el 235U), aunque algunos isótopos primordiales se han detectado con vidas medias tan cortas en términos relativos como 80 millones de años (por ejemplo, el 244Pu). Sin embargo, este es el límite actual de detección (el nucleido con la siguiente vida media más corta (niobio-92 con una vida media de 34,7 millones de años, aún no ha sido detectado en la naturaleza).
Muchos radioisótopos de origen natural (unos 51, para un total de alrededor de 339) presentan vidas medias inferiores a 80 millones de años, pero son generados en la actualidad como productos de los procesos de desintegración de nucleidos primordiales (por ejemplo, el radio a partir del uranio) o de reacciones energéticas en curso, como los nucleidos cosmogénicos producidos por el bombardeo de rayos cósmicos sobre los elementos presentes en la Tierra (por ejemplo, el carbono-14 generado a partir del nitrógeno).
Algunos isótopos que se clasifican como estables (es decir, en los que no se ha observado ningún tipo de radiactividad) se predice que tienen vidas medias muy largas (a veces, tan elevadas como 1018 años o más). Si la vida media predicha cae en un rango experimentalmente accesible, tales isótopos pueden pasar de la lista de isótopo estables a la categoría radiactivos, una vez que se observa su actividad. Por ejemplo, el bismuto-209 y el tungsteno-180 fueron previamente consideradas como estables, pero en (2003) se detectó que presentaban actividad en partículas alfa. Sin embargo, los nucleidos no cambian su condición de primordiales cuando eventualmente se detecta que son radiactivos.
Se cree que los isótopos más estables presentes en la Tierra se formaron en procesos de nucleosíntesis, ya sea en el Big Bang, o en generaciones de estrellas que precedieron a la formación del Sistema Solar. Sin embargo, algunos isótopos estables también muestran variaciones de abundancia en la tierra como resultado de la desintegración de nucleidos radiactivos de larga vida. Estos subproductos del decaimiento radiactivo se denominan isótopos radiogénicos, con el fin de distinguirlos del grupo mucho mayor de isótopos 'no radiogénicos'.
La denominada isla de estabilidad revela un buen número de átomos de larga vida o incluso estables que son más pesados (y con más protones) que el plomo.
Isótopos por elemento
De los elementos químicos conocidos, 80 tienen al menos un nucleido estable. Estos comprenden los primeros 82 elementos desde el hidrógeno al plomo, con dos excepciones, el tecnecio (elemento 43) y prometio (elemento 61), que no tienen ningún isótopo estable. Con fecha de diciembre de 2011, había un total de 254 nucleidos "estables" conocidos. En esta definición, que un nucleido es "estable" significa que nunca se ha observado su decaimiento radiactivo en el contexto natural. Por lo tanto, estos elementos tienen vidas medias demasiado largas como para ser medidas por cualquier medio, sea directo o indirecto.
Los isótopos estables son:
- 1 elemento (estaño) tiene 10 isótopos estables
- 1 elemento (xenón) tiene 8 isótopos estables
- 4 elementos tienen 7 isótopos estables cada uno
- 8 elementos tienen 6 isótopos estables cada uno
- 10 elementos tienen 5 isótopos estables cada uno
- 9 elementos tienen 4 isótopos estables cada uno
- 5 elementos tienen 3 isótopos estables cada uno
- 16 elementos tienen 2 isótopos estables cada uno
- 26 elementos tienen 1 solo isótopo estable cada uno
Estos últimos 26 por lo tanto son denominados elementos monoisotópicos.[1] El número de isótopos estables para los elementos que tienen al menos un isótopo estable representa una media de 254/80 = 3,2, es decir, una media de aproximadamente tres isótopos estables por cada elemento estable.
"Números mágicos" y dotaciones pares e impares de protones y de neutrones
La estabilidad de los isótopos se ve afectada por la relación entre el número de protones de neutrones de cada núcleo, y también por la presencia de ciertos "números mágicos" de neutrones o protones que representan contornos cerrados y completos desde el punto de vista cuántico. Estas capas cuánticas corresponden a un conjunto de niveles de energía dentro del modelo de capas del núcleo completas; como la capa completa de 50 protones para el estaño, que confiere una estabilidad inusual a este nucleido. Como en el caso del estaño, si el número atómico Z de un elemento coincide con un número mágico, entonces su número de isótopos estables tiende a aumentar.
Al igual que en el caso de los electrones, que tienen el estado de energía más bajo cuando se producen en pares en un determinado orbitales, los nucleones (tanto protones como neutrones) muestran un estado de energía más baja cuando su número es par en lugar de impar. Esta estabilidad tiende a impedir la desintegración beta (en dos etapas) de muchos nucleidos par-par en otro nucleido par-par de la misma masa, pero de menor energía (y por supuesto con dos protones más y dos neutrones menos), porque un procedimiento de descomposición de un solo paso tendría que pasar a través de un nucleido impar, con un pico de energía más alto. Esto lleva a un mayor número de nucleidos par-par estables, hasta tres para algunos números de masa, y hasta siete para algunos números atómicos (protones).
Por el contrario, de los 254 isótopos estables conocidos, solo cinco tienen un número impar de protones y un número impar de neutrones: hidrógeno-2 (deuterio), litio-6, boro-10, nitrógeno-14, y tántalo-180m. Además, solo cuatro nucleidos radiactivos impar-impar de origen natural tienen una vida media de más de mil millones de años: potasio-40, vanadio-50, lantano-138, y lutecio-176. Los nucleidos primordiales impar-impar son raros porque los núcleos impar-impar son muy inestables con respecto a la desintegración beta, debido a que los subproductos de desintegración resultantes son par-par, y por lo tanto están más fuertemente ligados debido a efectos de pareado nuclear.[2]
Sin embargo, otro efecto de la inestabilidad de un número impar de cualquiera de los tipos de nucleones, es que los elementos impares tienden a tener menos isótopos estables. De los 26 elementos monoisotópicos (es decir, que solo tienen un único isótopo estable), todos menos uno tienen un número atómico impar (la única excepción a ambas reglas es el berilio). Todos estos elementos también tienen un número par de neutrones, con la única excepción que es de nuevo el berilio.
Isómeros nucleares, incluyendo uno "metaestable"
El recuento de los 254 nucleidos estables conocidos incluye el tantalio-180m, ya que a pesar del proceso de desintegración y la inestabilidad que implican de forma automática su condición de "metaestable", estos fenómenos aún no se han podido observar. Todos los isótopos "estables" (estables por observación, no en teoría) son los estados fundamentales de los núcleos, con la excepción de tantalio-180m, que es un isómero nuclear o estado excitado. El estado fundamental de este núcleo en particular (el Ta-180) es radiactivo, con una vida media relativamente corta de 8 horas. En contraste, la descomposición del isómero nuclear excitado es extremadamente improbable debido a las reglas de selección de spin-paridad. Se ha informado mediante observación directa de manera experimental que la vida media del 180mTa por radiación gamma debe ser superior a 1015 años. Tampoco se han observado nunca otros modos posibles de desintegración del 180mTa (decaimiento beta, captura de electrones y desintegración alfa).
Desintegración aún no observada
Se espera que una cierta mejora continua de la sensibilidad de los experimentos permitirá descubrir la presencia de signos de radiactividad muy leves (inestabilidad) de algunos isótopos que son considerados estables en la actualidad. Un ejemplo de un descubrimiento reciente: no fue hasta el año 2003 cuando se demostró que el bismuto-209 (el único isótopo de origen natural del bismuto) es muy ligeramente radiactivo.[3] Antes de este descubrimiento, había predicciones teóricas de física nuclear según las que el bismuto-209 debería decaer muy lentamente por la emisión de partículas alfa. Estos cálculos fueron confirmados por las observaciones experimentales realizadas en el año 2003.
Cuadro resumen de los números de cada clase de nucleidos
Esta es una tabla resumen de la lista de nucleidos. Téngase en cuenta que los números no son exactos y pueden variar ligeramente en el futuro, debido a que se efectúen nuevas detecciones de radiactividad en más nucleidos, o a que determinadas vidas medias se determinen con mayor precisión.
| Tipo de nucleidos por clase de estabilidad | Número de nucleidos de cada clase | Total acumulado de nucleidos en todas las clases | Notas |
|---|---|---|---|
| Teóricamente estables a todos los modos de decaimiento, aunque con posibilidad de decaimiento protónico.[cita requerida] | 90 | 90 | Incluye los primeros 40 elementos. Decaimiento de protones todavía no observado. |
| Energéticamente inestables para uno o más modos de decaimiento conocidos,[cita requerida] pero con decaimiento todavía no observado. Considerados estables hasta que se confirme su radiactividad. | 164 | 254 | Fisión espontánea posible para nucleidos "estables" > niobio-93. Otros mecanismos posibles para nucleidos más pesados. El total son los nucleidos estables observados. |
| Nucleidos primordiales radiactivos. | 34 | 288 | Incluidos Bi, U, Th, Pu. |
| Nucleidos no primordiales radiactivos, pero presentes naturalmente en la Tierra. | ~ 51 | ~ 339 | Nucleidos cosmogénicos producidos por los rayos cósmicos; o subproductos de elementos radiactivos primordiales como el francio, etc. |
Isótopos estables en la Tabla Periódica
A continuación figura una Tabla Periódica con el número de isótopos estables de cada elemento:
| H 2 |
He 2 | ||||||||||||||||
| Li 2 |
Be 1 |
B 2 |
C 2 |
N 2 |
O 3 |
F 1 |
Ne 3 | ||||||||||
| Na 1 |
Mg 3 |
Al 1 |
Si 3 |
P 1 |
S 4 |
Cl 2 |
Ar 3 | ||||||||||
| K 2 |
Ca 5 |
Sc 1 |
Ti 5 |
V 1 |
Cr 4 |
Mn 1 |
Fe 4 |
Co 1 |
Ni 5 |
Cu 2 |
Zn 5 |
Ga 2 |
Ge 4 |
As 1 |
Se 5 |
Br 2 |
Kr 6 |
| Rb 1 |
Sr 4 |
Y 1 |
Zr 4 |
Nb 1 |
Mo 6 |
Tc | Ru 7 |
Rh 1 |
Pd 6 |
Ag 2 |
Cd 6 |
In 1 |
Sn 10 |
Sb 2 |
Te 6 |
I 1 |
Xe 8 |
| Cs 1 |
Ba 6 |
* |
Hf 5 |
Ta 2 |
W 4 |
Re 1 |
Os 6 |
Ir 2 |
Pt 5 |
Au 1 |
Hg 7 |
Tl 2 |
Pb 4 |
Bi | Po | At | Rn |
| Fr | Ra | ** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 1 |
Ce 4 |
Pr 1 |
Nd 5 |
Pm | Sm 5 |
Eu 1 |
Gd 6 |
Tb 1 |
Dy 7 |
Ho 1 |
Er 6 |
Tm 1 |
Yb 7 |
Lu 1 | ||
| ** |
Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
Lista de isótopos estables
- Hidrógeno-1 (protio)
- Hidrógeno-2 (deuterio)
- Helio-3
- Hidrógeno-4
- Sin número de masa 5
- Litio-6
- Litio-7
- Sin número de masa 8
- Berilio-9
- Boro-10
- Boro-11
- Carbono-12
- Carbono-13
- Nitrógeno-14
- Nitrógeno-15
- Oxígeno-16
- Oxígeno-17
- Oxígeno-18
- Flúor-19
- Neón-20
- Neón-21
- Neón-22
- Sodio-23
- Magnesio-24
- Magnesio-25
- Magnesio-26
- Aluminio-27
- Silicio-28
- Silicio-29
- Silicio-30
- Fósforo-31
- Azufre-32
- Azufre-33
- Azufre-34
- Azufre-36
- Cloro-35
- Cloro-37
- Argón-36 (2E)
- Argón-38
- Argón-40
- Potasio-39
- Potasio-41
- Calcio-40 (2E)
- Calcio-42
- Calcio-43
- Calcio-44
- Calcio-46 (2B)
- Escandio-45
- Titanio-46
- Titanio-47
- Titanio-48
- Titanio-49
- Titanio-50
- Vanadio-51
- Cromo-50 (2E)
- Cromo-52
- Cromo-53
- Cromo-54
- Manganeso-55
- Hierro-54 (2E)
- Hierro-56
- Hierro-57
- Hierro-58
- Cobalto-59
- Níquel-58 (2E)
- Níquel-60
- Níquel-61
- Níquel-62
- Níquel-64
- Cobre-63
- Cobre-65
- Zinc-64 (2E)
- Zinc-66
- Zinc-67
- Zinc-68
- Zinc-70 (2B)
- Galio-69
- Galio-71
- Germanio-70
- Germanio-72
- Germanio-73
- Germanio-74
- Arsénico-75
- Selenio-74 (2E)
- Selenio-76
- Selenio-77
- Selenio-78
- Selenio-80 (2B)
- Bromo-79
- Bromo-81
- Kriptón-78 (2E)
- Kriptón-80
- Kriptón-82
- Kriptón-83
- Kriptón-84
- Kriptón-86 (2B)
- Rubidio-85
- Estroncio-84 (2E)
- Estroncio-86
- Estroncio-87
- Estroncio-88
- Itrio-89
- Circonio-90
- Circonio-91
- Circonio-92
- Circonio-94 (2B)
- Niobio-93 (SF)
- Molibdeno-92 (2E)
- Molibdeno-94 (SF)
- Molibdeno-95 (SF)
- Molibdeno-96 (SF)
- Molibdeno-97 (SF)
- Molibdeno-98 (2B)
- Tecnecio - No hay isótopos estables
- Rutenio-96 (2E)
- Rutenio-98 (SF)
- Rutenio-99 (SF)
- Rutenio-100 (SF)
- Rutenio-101 (SF)
- Rutenio-102 (SF)
- Rutenio-104 (2B)
- Rodio-103 (SF)
- Paladio-102 (2E)
- Paladio-104 (SF)
- Paladio-105 (SF)
- Paladio-106 (SF)
- Paladio-108 (SF)
- Paladio-110 (2B)
- Plata-107 (SF)
- Plata-109 (SF)
- Cadmio-106 (2E)
- Cadmio-108 (2E)
- Cadmio-110 (SF)
- Cadmio-111 (SF)
- Cadmio-112 (SF)
- Cadmio-114 (2B)
- Indio-113 (SF)
- Estaño-112 (2E)
- Estaño-114 (SF)
- Estaño-115 (SF)
- Estaño-116 (SF)
- Estaño-117 (SF)
- Estaño-118 (SF)
- Estaño-119 (SF)
- Estaño-120 (SF)
- Estaño-122 (2B)
- Estaño-124 (2B)
- Antimonio-121 (SF)
- Antimonio-123 (SF)
- Telurio-120 (2E)
- Telurio-122 (SF)
- Telurio-123 (E)
- Telurio-124 (SF)
- Telurio-125 (SF)
- Telurio-126 (SF)
- Yodo-127 (SF)
- Xenón-124 (2E)
- Xenón-126 (2E)
- Xenón-128 (SF)
- Xenón-129 (SF)
- Xenón-130 (SF)
- Xenón-131 (SF)
- Xenón-132 (SF)
- Xenón-134 (2B)
- Cesio-133 (SF)
- Bario-132 (2E)
- Bario-134 (SF)
- Bario-135 (SF)
- Bario-136 (SF)
- Bario-137 (SF)
- Bario-138 (SF)
- Lantano-139 (SF)
- Cerio-136 (2E)
- Cerio-138 (2E)
- Cerio-140 (SF)
- Cerio-142 (A, 2B)
- Praseodimio-141 (SF)
- Neodimio-142 (SF)
- Neodimio-143 (A)
- Neodimio-145 (A)
- Neodimio-146 (A, 2B)
- Neodimio-148 (A, 2B)
- Prometio - No hay isótopos estables
- Samario-144 (2E)
- Sin número de masa 147
- Samario-149 (A)
- Samario-150 (A)
- Samario-152 (A)
- Samario-154 (2B)
- Sin número de masa 151
- Europio-153 (A)
- Gadolinio-154 (A)
- Gadolinio-155 (A)
- Gadolinio-156 (SF)
- Gadolinio-157 (SF)
- Gadolinio-158 (SF)
- Gadolinio-160 (2B)
- Terbio-159 (SF)
- Disprosio-156 (A, 2E)
- Disprosio-158 (A, 2E)
- Disprosio-160 (A)
- Disprosio-161 (A)
- Disprosio-162 (A)
- Disprosio-163 (SF)
- Disprosio-164 (SF)
- Holmio-165 (A)
- Erbio-162 (A, 2E)
- Erbio-164 (A, 2E)
- Erbio-166 (A)
- Erbio-167 (A)
- Erbio-168 (A)
- Erbio-170 (A, 2B)
- Tulio-169 (A)
- Iterbio-168 (A, 2E)
- Iterbio-170 (A)
- Iterbio-171 (A)
- Iterbio-172 (A)
- Iterbio-173 (A)
- Iterbio-174 (A)
- Iterbio-176 (A, 2B)
- Lutecio-175 (A)
- Hafnio-176 (A)
- Hafnio-177 (A)
- Hafnio-178 (A)
- Hafnio-179 (A)
- Hafnio-180 (A)
- Tantalio-180m (A, B, E, IT) *
- Tantalio-181 (A)
- Wolframio-182 (A)
- Wolframio-183 (A)
- Wolframio-184 (A)
- Wolframio-186 (A, 2B)
- Renio-185 (A)
- Osmio-184 (A, 2E)
- Osmio-187 (A)
- Osmio-188 (A)
- Osmio-189 (A)
- Osmio-190 (A)
- Osmio-192 (A, 2B)
- Iridio-191 (A)
- Iridio-193 (A)
- Platino-192 (A)
- Platino-194 (A)
- Platino-195 (A)
- Platino-196 (A)
- Platino-198 (A, 2B)
- Oro-197 (A)
- Mercurio-196 (A, 2E)
- Mercurio-198 (A)
- Mercurio-199 (A)
- Mercurio-200 (A)
- Mercurio-201 (A)
- Mercurio-202 (A)
- Mercurio-204 (A, 2B)
- Talio-203 (A)
- Talio-205 (A)
- Plomo-204 (A)
- Plomo-206 (A)
- Plomo-207 (A)
- Plomo-208 (A)
- Bismuto ** y por encima de - Sin isótopos estables
A para la desintegración alfa, B para la desintegración beta, 2B para el decaimiento beta doble, E para la captura de electrones, 2E para la captura de electrones doble, IT para la transición isomérica, SF para la fisión espontánea.
* El tantalio-180m es un "isótopo metaestable" lo que significa que es un isómero nuclear excitado de tántalo-180 (ver: Isótopos de tántalo). Sin embargo, la vida media de este isómero nuclear es tan larga que nunca se ha observado su descomposición, y por lo tanto se comporta como un nucleido primordial "observacionalmente no radiactivo", como un isótopo menor de tantalio. Este es el único caso de un isómero nuclear que tiene una vida media tan larga que nunca se ha observado su decaimiento, por lo que se incluye en esta lista.
** El bismuto-209 se había considerado estable durante mucho tiempo, debido a su inusualmente larga vida media de más de 1,9 1019 años, lo que es más de mil millones de veces la edad del universo .
Véase también
- Geoquímica de isotopos
- Lista de elementos por estabilidad de isótopos
- Lista de nucleidos (901 nucleidos en orden de estabilidad, todos con vidas medias > una hora)
- Elemento mononucleico
- Tabla periódica
- Nucleido primordial
- Radionucleido
- Proporción de isótopos estables
- Tabla de nucleidos
Referencias
- Sonzogni, Alejandro. «Interactive Chart of Nuclides». National Nuclear Data Center: Brook haven National Laboratory. Archivado desde el original el 21 de julio de 2011. Consultado el 6 de junio de 2008.
- Various (2002). Lide, David R., ed. Handbook of Chemistry & Physics (88th edición). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Archivado desde el original el 24 de julio de 2017. Consultado el 23 de mayo de 2008.
- «WWW Table of Radioactive Isotopes». (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
Lecturas relacionadas
- Various (2002). Lide, David R., ed. Handbook of Chemistry & Physics (88th edición). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Archivado desde el original el 24 de julio de 2017. Consultado el 23 de mayo de 2008.
Enlaces externos
- El Livechart de nucleidos - OIEA
- AlphaDelta: Isótopos Estables calculadora fraccionamiento
- Centro de Desarrollo de Isótopos Nacional Información de referencia de isótopos, y la coordinación y gestión de la producción de isótopos, la disponibilidad y la distribución
- isótopos Desarrollo y Producción de Investigación y Aplicaciones (IDPRA) Departamento de EE. UU. programa Energía para la producción de isótopos y la investigación de la producción y el desarrollo
- Isosciences Archivado el 18 de enero de 2021 en Wayback Machine. El uso y desarrollo de las etiquetas de isótopos estables en moléculas sintéticas y biológicas