Curio
El curio es un elemento sintético de la tabla periódica cuyo símbolo es Cm y su número atómico es 96. Se produce bombardeando plutonio con partículas alfa. Es un actínido. El curio no existe en el ambiente terrestre, pero puede producirse en forma artificial. Sus propiedades químicas se parecen tanto a las de las tierras raras típicas que, si no fuera por su radiactividad, podría confundirse fácilmente con uno de estos elementos. Entre los isótopos conocidos del curio figuran los de número de masa 238 a 250. El isótopo 244Cm es de particular interés a causa de su uso potencial como una fuente compacta de fuerza termoeléctrica, al utilizarse el calor generado por decaimiento nuclear para generar fuerza eléctrica.
| Americio ← Curio → Berkelio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Curio, Cm, 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| , período, bloque | , 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 247 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f7 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 25, 9, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 581 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 13.510 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1613 K (1340 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3383 K (3110 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal compacta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del curio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El curio es un metal duro, denso y plateado con un punto de fusión y ebullición relativamente altos para un actínido. Mientras que es paramagnético a condiciones ambientales estándar, se convierte en antiferromagnético al enfriarse, y también se observan otras transiciones magnéticas en muchos compuestos de curio. En los compuestos, el curio suele presentar valencia +3 y a veces +4, y la valencia +3 es predominante en las soluciones. El curio se oxida fácilmente, y sus óxidos son una forma dominante de este elemento. Forma complejos fuertemente fluorescentes con varios compuestos orgánicos, pero no hay pruebas de su incorporación en bacterias y arqueas. Cuando se introduce en el cuerpo humano, el curio se acumula en los huesos, los pulmones y el hígado, donde favorece el cáncer.
El curio metálico puede producirse por reducción del trifluoruro de curio, con vapor de bario. El metal tiene un lustre plateado, el cual se pierde al contacto con el aire, y una densidad relativa de 13.5. El punto de fusión es de 1340 (+/-) 40 °C (2444 +/- 72 °F). El metal se disuelve con facilidad en ácidos minerales comunes, con formación de ion tripositivo.
Se han preparado varios compuestos sólidos del curio y sus estructuras se han determinado por difracción de rayos X. Estos incluyen CmF4, CmF3, CmCl3, CmBr3, CmI3, Cm2O3, CmO2. En los lantánidos hay análogos isoestructurales de los compuestos de curio.
Historia

El curio fue sintetizado por primera vez en la Universidad de California, Berkeley, también por Glenn T. Seaborg, Ralph A. James y Albert Ghiorso en 1944. Se eligió el nombre curio en honor a Marie Curie y su marido Pierre, famosos por descubrir el radio y por otros importantes trabajos sobre radiactividad.
Características
Físicas
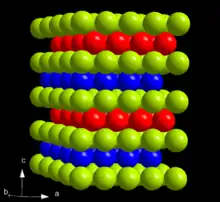

El curio es un elemento radioactivo sintético, es un metal duro y denso con una apariencia blanca plateada y propiedades físicas y químicas que se asemejan a las del gadolinio. Su punto de fusión es 1344 °C el cual es significativamente más elevado que el de los elementos transuránicos previos neptunio (637 °C), plutonio (639 °C) y americio (1173 °C). Por comparación, el gadolinio se funde a 1312 °C. El punto de ebullición del curio es 3556 °C. Con una densidad de 13.52 g/cm3, el curio es significativamente más liviano que el neptunio (20.45 g/cm3) y el plutonio (19.8 g/cm3), pero es más pesado que muchos de los otros metales. Entre las dos formas cristalinas del curio, la α-Cm es más estable en condiciones ambientales. Posee simetría hexagonal, grupo espacial P63/mmc, parámetros de red a = 365 pm y c = 1182 pm, y cuatro unidades de fórmula en cada celda unitaria.[1] El cristal consiste de un doble red hexagonal compacta con la secuencia de capa ABAC y por lo tanto es isotípico con el α-lantano. A presiones por encima de 23 GPa, a temperatura ambiente, el α-Cm se transforma en β-Cm, que posee una simetría cúbica de cara centrada, grupo espacial Fm3m y la constante de red a = 493 pm.[1] Si se lo comprime a una presión de 43 GPa, el curio adopta una estructura ortorómbica γ-Cm similar a la del α-uranio, sin que se observen otras transiciones hasta 52 GPa. Estas tres fases del curio también son denominadas Cm I, II y III.[2][3]
El curio tiene propiedades magnéticas peculiares. Mientras que su elemento vecino el americio no presenta desviación de paramagnetismo Curie-Weiss en todo el rango de temperaturas, el α-Cm se transforma a un estado antiferromagnético al enfriarlo a 65–52 K,[4][5] y posee una transición β-Cm ferrimagnética a unos 205 K. En cambio, los pnictógenos de curio presentan transiciones ferromagnéticas al enfrialos: 244CmN y 244CmAs a 109 K, 248CmP a 73 K y 248CmSb a 162 K. El análogo lantánido del curio, el gadolinio, como también sus pnictógenos, también exhiben transiciones magnéticas al enfriarlos, pero la naturaleza de la transición es algo diferente: el Gd y el GdN se tornan ferromagnéticos, mientras que el GdP, GdAs y GdSb presentan arreglos antiferromagnéticos.[6]
De acuerdo a los registros magnéticos, la resistividad eléctrica del curio aumenta con la temperatura – aproximadamente se duplica entre 4 y 60 K – y luego permanece casi constante hasta la temperatura ambiente. Existe un aumento significativo en resistividad a lo largo del tiempo (unos 10 µΩ·cm/h) a causa de daño auto infligido en la red cristalina por la radiación alfa. Lo cual hace incierto el valor absoluto de la resistividad absoluta del curio (alrededor de 125 µΩ·cm. La resistividad del curio es similar a la del gadolinio y a la de los actínidos plutonio y neptunio, pero significativamente más elevada que la del americio, uranio, polonio y torio.[7][8]
Bajo luz ultravioleta, los iones de curio(III) presentan una fluorescencia intensa y estable de color amarillo-anaranjado con un máximo en el rango de 590 a 640 nm dependiendo del entorno.[9] La fluorescencia proviene de las transiciones entre el primer estado exitado 6D7/2 y el estado base 8S7/2. El análisis de esta fluorescencia permite monitorear las interacciones entre iones Cm(III) en complejos orgánicos e inorgánicos.[10]
Químicas

Los iones de curio en solución toman un estado de oxidación de +3, que es el estado de oxidación más estable del curio.[11] El estado de oxidación +4 se observa principalmente en unas pocas fases sólidas, tales como CmO2 y CmF4. [12][13] El curio(IV) acuoso solo se ha observado en presencia de oxidantes fuertes tales como el persulfato de potasio, y es fácilmente reducible a curio(III) mediante radiólisis y aún la propia agua. [14] El comportamiento químico del curio es diferente de los actínidos torio y uranio, y es similar al del americio y numerosos lantánidos. En solución acuosa, el ion Cm3+ es entre incoloro a verde claro,[15] y el ion Cm4+ es amarillo claro.[16] La absorción óptica de los iones Cm3+ contiene tres picos bien definidos en 375.4, 381.2 y 396.5 nanómetros y su magnitud es directamente dependiente de la concentración de iones.[17] El estado de oxidación +6 solo ha sido identificado una vez en solución en 1978, como el ion (CmO2+
2): en esta oportunidad se lo obtuvo a partir del decaimiento beta de americio-242 en el ion americio(V) 242
AmO+
2. [18] A veces no es posible obtener Cm(VI) a partir de la oxidación de Cm(III) y Cm(IV) puede deberse al elevado potencial de oxidación de Cm4+/Cm3+ y la inestabilidad del Cm(V).[14]
Los iones de curio son ácidos de Lewis fuertes y por lo tanto forman complejos muy estables con bases fuertes.[19] La unión es principalmente iónica, con una pequeña componente covalente. [20] El curio en sus complejos suele presentar un entorno de coordinación de 9 pliegues, dentro de una geometría prismática trigonal.[21]
Usos
Radionucleidos
El curio es uno de los elementos aislables más radioactivos. Sus dos isótopos más comunes 242Cm y 244Cm son emisores alfa tan fuertes 6 MeV); que tienen vidas medias relativamente cortas de 162.8 días y 18.1 años, y producen 120 W/g y 3 W/g de potencia térmica, respectivamente.[22][23][24] Por ello, el curio puede ser utilizado en su forma común de óxido en generadores termoeléctricos radioactivos que se suelen usar en naves espaciales. Este uso se ha desarrollado para el isótopo 244Cm, mientras que el 242Cm fue descartado a causa de su alto costo de alrededor de 2000 USD/g. El 243Cm con una vida media de unos ~30 años y un buen nivel de producción de energía de ~1.6 W/g lo cual lo torna aceptable como combustible, pero produce una cantidad significativa de radiación gama y beta peligrosas a partir de sus productos de decaimiento radioactivos. Si bien como emisor α, el 244Cm requiere de un blindaje de protección a las radiaciones delgado, posee un elevado ritmo de fisión espontánea, y por lo tanto los ritmos de radiación de neutrones y gama son relativamente altos. Si lo compara con un generador termoeléctrico competidor que utiliza el isótopo 238Pu, el 244Cm emita 500 veces más neutrones, y su mayor emisión gama requiere un blindaje que es 20 veces más grueso unos 5 cm de plomo para una fuente de 1 kW, comparado con 2,5 mm para el caso del 238Pu. Por lo tanto, este uso del curio en la actualidad no es considerado práctico.[25]
Un uso más prometedor del 242Cm es para producir 238Pu, un radioisótopo más apropiado para generadores termoeléctricos tales comom los usados en marcapasos cardíacos. Las rutas alternativas al 238Pu utilizan la reacción (n,γ) del 237Np, o el bombardeo mediante el bombardeo con deuterones de uranio, que siempre produce 236Pu como un producto secundario no deseado dado que este último decae a 232U con una fuerte emisión gama.[26] El curio es también un material que se utiliza para ´producir elementos transuránicos y elementos superpesados superiores. Por lo tanto, el bombardeo de 248Cm con neón (22Ne), magnesio (26Mg), o calcio (48Ca) producen ciertos isótopos de seaborgio (265Sg), hasio (269Hs y 270Hs), y livermorio (292Lv, 293Lv, y posiblemente 294Lv).[27] El californio fue descubierto cuando un blanco del tamaño de un microgramo de curio-242 fue irradiado con partículas alfa de 35 MeV usando el ciclotrón de Berkeley de 60 pulgadas (152,4 cm):
- 242
96Cm + 4
2He → 245
98Cf + n
Apenas unos 5,000 átomos de californio fueron producidos en este experimento.[28]
Los isótopos de curio con masa impar 243Cm, 245Cm, y 247Cm son todo sumamente físiles y pueden ser utilizados para generar energía adicional en un reactor nuclear con espectro térmico; mientras que todos los isótopos de Cm son fisionables en reactores con espectros de neutrones rápidos. Esta es una de las motivaciones para la separación de actínidos menores y transmutación en el ciclo de combustible nuclear, ayudando a reducir la radiotoxicidad por largo tiempo del combustible nuclear agotado.

Espectrómetro de rayos X
El uso más práctico del 244Cm—aunque limitado en volumen total—es como fuente de partículas α en el espectrómetro de rayos X mediante partículas alfas (APXS). Estos instrumentos fueron instalados en las sondas espaciales Sojourner, Mars, Mars 96, Mars Exploration Rovers y sonda Philae,[29] y también en el Mars Science Laboratory para analizar la composición y estructura de las rocas de la superficie del planeta Marte.[30] El APXS también fue utilizado en las sondas lunares Surveyor 5–7 pero con una fuente de 242Cm.[31][32][33]
Un esquema superador de APXS está equipado con una cabeza sensora que contiene seis fuentes de curio con una actividad de decaimiento radioactivo de varias decenas de milicuries (aproximadamente un gigabecquerel). Las fuentes son colimadas en la muestra, y el espectro de energía de las partículas alfa y protones dispersados desde la muestra son analizados (el análisis de protones se implementa solo en algunos espectrómetros). Estos espectros contienen información cuantitativa de todos los principales elementos en las muestras excepto hidrógeno, helio y litio.[34]
Referencias
- Milman, V.; Winkler, B.; Pickard, C. J. (2003). «Crystal structures of curium compounds: an ab initio study». Journal of Nuclear Materials 322 (2–3): 165. Bibcode:2003JNuM..322..165M. doi:10.1016/S0022-3115(03)00321-0.
- Young, D. A. Phase diagrams of the elements, University of California Press, 1991, ISBN 0-520-07483-1, p. 227
- Haire, R.; Peterson, J.; Benedict, U.; Dufour, C.; Itie, J. (1985). «X-ray diffraction of curium-248 metal under pressures of up to 52 GPa». Journal of the Less Common Metals 109 (1): 71. doi:10.1016/0022-5088(85)90108-0.
- Kanellakopulos, B.; Blaise, A.; Fournier, J. M.; Müller, W. (1975). «The magnetic susceptibility of Americium and curium metal». Solid State Communications 17 (6): 713. Bibcode:1975SSCom..17..713K. doi:10.1016/0038-1098(75)90392-0.
- Fournier, J.; Blaise, A.; Muller, W.; Spirlet, J.-C. (1977). «Curium: A new magnetic element». Physica B+C. 86–88: 30. Bibcode:1977PhyBC..86...30F. doi:10.1016/0378-4363(77)90214-5.
- Nave, S. E.; Huray, P. G.; Peterson, J. R. and Damien, D. A. Magnetic susceptibility of curium pnictides, Oak Ridge National Laboratory
- Schenkel, R. (1977). "The electrical resistivity of 244Cm metal". Solid State Communications. 23 (6): 389.
- Schenkel, R. (1977). «The electrical resistivity of 244Cm metal». Solid State Communications 23 (6): 389. Bibcode:1977SSCom..23..389S. doi:10.1016/0038-1098(77)90239-3.
- Denecke, Melissa A.; Rossberg, André; Panak, Petra J.; Weigl, Michael; Schimmelpfennig, Bernd; Geist, Andreas (2005). «Characterization and Comparison of Cm(III) and Eu(III) Complexed with 2,6-Di(5,6-dipropyl-1,2,4-triazin-3-yl)pyridine Using EXAFS, TRFLS, and Quantum-Chemical Methods». Inorganic Chemistry 44 (23): 8418-8425. PMID 16270980. doi:10.1021/ic0511726.
- Bünzli, J.-C. G. and Choppin, G. R. Lanthanide probes in life, chemical, and earth sciences: theory and practice, Elsevier, Amsterdam, 1989 ISBN 0-444-88199-9
- Penneman, p. 24
- Keenan, Thomas K. (1961). «First Observation of Aqueous Tetravalent Curium». Journal of the American Chemical Society 83 (17): 3719. doi:10.1021/ja01478a039.
- Asprey, L. B.; Ellinger, F. H.; Fried, S.; Zachariasen, W. H. (1955). "Evidence for Quadrivalent Curium: X-Ray Data on Curium Oxides1". Journal of the American Chemical Society. 77 (6): 1707.
- Gregg J., Lumetta; Thompson, Major C.; Penneman, Robert A.; Eller, P. Gary (2006). «Curium». En Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean, eds. The Chemistry of the Actinide and Transactinide Elements 3 (3rd edición). Dordrecht, the Netherlands: Springer. pp. 1397-1443. ISBN 978-1-4020-3555-5. doi:10.1007/1-4020-3598-5_9. Archivado desde el original el 17 de enero de 2018. Consultado el 1 de junio de 2022.
- Greenwood, p. 1265
- Holleman, p. 1956
- Penneman, pp. 25–26
- Domanov, V. P.; Lobanov, Yu. V. (October 2011). "Formation of volatile curium(VI) trioxide CmO3". Radiochemistry. SP MAIK Nauka/Interperiodica. 53 (5): 453–6.
- Jensen, Mark P.; Bond, Andrew H. (2002). com/articles/Comparison_of_Covalency_in_the_Complexes_of_Trivalent_Actinide_and_Lanthanide_Cations/3640428 «Comparison of Covalency in the Complexes of Trivalent Actinide and Lanthanide Cations». Journal of the American Chemical Society 124 (33): 9870-9877. PMID 12175247. doi:10.1021/ja0178620.
- Seaborg, Glenn T. (1993). «Overview of the Actinide and Lanthanide (the f) Elements». Radiochimica Acta 61 (3-4): 115-122. S2CID 99634366. doi:10.1524/ract.1993.61.34.115.
- Greenwood, p. 1267
- Hammond C. R. "The elements" in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- Binder, Harry H.: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, pp. 174–178.
- Gmelin Handbook of Inorganic Chemistry, System No. 71, Volume 7a, transuranics, Part A2, p. 289
- Basic elements of static RTGs Archivado el 15 de febrero de 2013 en Wayback Machine., G.L. Kulcinski, NEEP 602 Course Notes (Spring 2000), Nuclear Power in Space, University of Wisconsin Fusion Technology Institute (see last page)
- Kronenberg, Andreas, Plutonium-Batterien Archivado el 26 de diciembre de 2013 en Wayback Machine. (en alemán) «Archived copy». Archivado desde el original el 21 de febrero de 2011. Consultado el 28 de abril de 2011.
- Holleman, pp. 1980–1981.
- Seaborg, Glenn T. (1996). Adloff, J. P., ed. One Hundred Years after the Discovery of Radioactivity. Oldenbourg Wissenschaftsverlag. p. 82. ISBN 978-3-486-64252-0.
- «Der Rosetta Lander Philae». Bernd-leitenberger.de. 1 de julio de 2003. Consultado el 25 de marzo de 2011.
- Rieder, R.; Wanke, H.; Economou, T. (September 1996). «An Alpha Proton X-Ray Spectrometer for Mars-96 and Mars Pathfinder». Bulletin of the American Astronomical Society 28: 1062. Bibcode:1996DPS....28.0221R.
- Human Health Fact Sheet on Curium Archivado el 18 de febrero de 2006 en Wayback Machine., Los Alamos National Laboratory
- Leitenberger, Bernd Die Surveyor Raumsonden (in German)
- Nicks, Oran (1985). «Ch. 9. Essentials for Surveyor». SP-480 Far Travelers: The Exploring Machines. NASA.
- Alpha Particle X-Ray Spectrometer (APXS), Cornell University