Isatina
La Isatina es un derivado del indol. El compuesto fue obtenido por primera vez por Erdman[2] and Laurent[3] en 1841 como producto de la oxidación del índigo por acción del ácido nítrico y ácidos crómicos. El compuesto se encuentra en muchas plantas, tales como Isatis tinctoria, Calanthe discolor y Couroupita guianensis.[4]
| Isatina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1H-indol-2,3-diona | ||
| General | ||
| Fórmula estructural | C8H5NO2 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 91-56-5[1] | |
| Número RTECS | NL7873000 | |
| ChEBI | 27539 | |
| ChEMBL | CHEMBL326294 | |
| ChemSpider | 6787 | |
| DrugBank | 02095 | |
| PubChem | 7054 | |
| UNII | 82X95S7M06 | |
| KEGG | C11129 | |
| Propiedades físicas | ||
| Apariencia | Sólido rojo anaranjado | |
| Masa molar | 147,1308 g/mol | |
| Punto de fusión | 200 °C (473 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La bases de Schiff de la isatina son investigadas por sus propiedades farmacéuticas.[5]
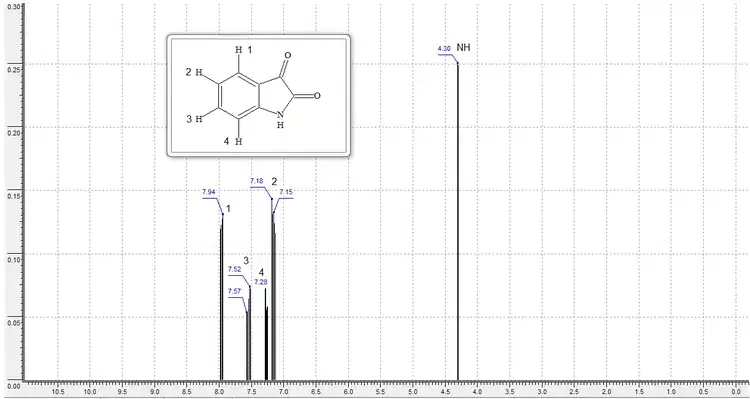
La isatina forma un pigmento azul si se le mezcla con ácido sulfúrico y benceno crudo. Por muchos años se creyó que la formación de la indofenina se debía a la reacción de la isatina con benceno, pero Victor Meyer pudo aislar la sustancia responsable, la cual resultó ser tiofeno.[6] A continuación se muestra el espectro calculado de RMN-H1 a 300MHz[7]
Abundancia en la naturaleza
En la naturaleza, la isatina se encuentra en plantas del género Isatis, en Calanthe discolor, y en Couroupita guianensis. También se ha encontrado como componente de la glándula parótida de los sapos del género Bufo y en humanos como metabolito de la adrenalina. Las isatinas sustituidas se encuentran en plantas, como los alcaloides melosatínicos (metoxifenil isatinas) obtenidas de las plantas Melochia tomentosa. Los hongos Streptomyces albus producen 6-(3’-metilbuten-2’-il)isatina mientras que la (3’-metilbuten-2’-il)isatina se ha aislado del hongo Chaetomium globosum. La isatina se ha encontrado también en el alquitrán de hulla.[8]
Se ha observado que la isatina se genera de forma endógena en el cuerpo humano y podría actuar como inhibidor endógeno de la MAO-B, lo que podría estar relacionado con la enfermedad de Parkinson debido a su efecto sobre la neurotransmisión dopaminérgica.[9] Además podría funcionar sinérgicamente con fármacos antoparkinsonianos.[10][11]
Síntesis
La isatina se encuentra disponible comercialmente. Puede ser preparada por varios métodos:
- Por ciclización partiendo de hidrato de cloral, anilina e hidroxilamina en presencia de ácido sulfúrico:.[12][13] Este método se denomina Síntesis de isatina por isonitrosoacetanilida de Sandmeyer y fue descubierta por Traugott Sandmeyer in 1919.
- Por condensación con difeniltiourea y cianuro de potasio en presencia de carbonato de plomo de acuerdo a lo que se denomina Síntesis de Isatina con difenilurea de Sandmeyer (Sandmeyer 1903).[14]
- A partir de su indol correspondiente por una mezcla de cloruro de indio III (InCl3) e IBX en una solución acetonitrilo-agua a 80 °C.[15]
Referencias
- Número CAS
- Otto Linné Erdmann (1840). «Untersuchungen über den Indigo». Journal für Praktische Chemie 19 (1): 321-362. doi:10.1002/prac.18400190161.
- Auguste Laurent (1840). «Recherches sur l'indigo». Ann. Chim. Phys. 3 (3): 393-434.
- The Chemistry of Isatins: a Review from 1975 to 1999. Joaquim F. M. da Silva*, Simon J. Garden and Angelo C. Pinto. J. Braz. Chem. Soc. (2001), 12(3):273-324.
- Synthesis of 3,3´-[methylenebis(3,1-phenylenenitrilo)]bis[1,3-dihydro]-2H-indol-2-one as a novel bis-Schiff base A. A. Jarrahpour, D. Khalili Molbank 2005, M437 Online Article Archivado el 12 de mayo de 2008 en Wayback Machine.
- Ward C. Sumpter (1944). «The Chemistry of Isatin». Chemical Reviews 34 (3): 393-434. doi:10.1021/cr60109a003.
- Bárbara V. Silva*; Pierre M. Esteves; Angelo C. Pinto (2011). «Chlorination of isatins with trichloroisocyanuric acid». Journal of the Brazilian Chemical Society 22 (2). doi:10.1590/S0103-50532011000200010.
- Joaquim F. M. da Silva, Simon J. Garden and Angelo C. Pinto. "The Chemistry of Isatins: a Review from 1975 to 1999" J. Braz. Chem. Soc. (2001) 12(3): 273-324 http://www.scielo.br/pdf/jbchs/v12n3/5590.pdf
- Justo, Lorenzo Antonio; Durán, Rafael; Alfonso, Miguel; Fajardo, Daniel; Faro, Lilian Rosana F. (2016-10). «Effects and mechanism of action of isatin, a MAO inhibitor, on in vivo striatal dopamine release». Neurochemistry International (en inglés) 99: 147-157. doi:10.1016/j.neuint.2016.06.012. Consultado el 22 de octubre de 2019.
- Faro, Lilian R. F.; Justo Cousiño, Lorenzo A.; Alfonso, Miguel; Durán, Rafael (2020-07). «Possible synergies between isatin, an endogenous MAO inhibitor, and antiparkinsonian agents on the dopamine release from striatum of freely moving rats». Neuropharmacology 171: 108083. ISSN 1873-7064. PMID 32304702. doi:10.1016/j.neuropharm.2020.108083. Consultado el 14 de noviembre de 2021.
- Justo-Cousiño, Lorenzo A.; Faro, Lilian; Durán, Rafael (9 de abril de 2021). «Isatina, un compuesto endógeno a considerar en la Enfermedad de Parkinson». Revista Peruana de Investigación en Salud 5 (2): 140-141. ISSN 2616-6097. doi:10.35839/repis.5.2.928. Consultado el 14 de noviembre de 2021.
- C. S. Marvel and G. S. Hiers (1941). "Isatin". Org. Synth.; Coll. Vol. 1: 327.
- Sandmeyer, T.: Über Isonitrosoacetanilide und deren Kondensation zu Isatinen, in: Helv. Chim. Acta 1919, 2 (1), 234–242; doi 10.1002/hlca.19190020125.
- Isatin synthesis @ drugfuture.com
- Yadav, J. S.; Reddy, B.; Reddy, Ch.; Krishna, A. (2007). «Indium(III) Chloride/2-Iodoxybenzoic Acid: A Novel Reagent System for the Conversion of Indoles to Isatins». Synthesis 2007 (5): 693-696. doi:10.1055/s-2007-965930.
Η