Metabolismo de las proteínas
Los términos metabolismo de las proteínas o metabolismo proteico hacen referencia a los diversos procesos bioquímicos responsables de la síntesis de proteínas y de aminoácidos, por medio del anabolismo proteico, y la degradación de proteínas (y otras grandes moléculas) por medio del catabolismo proteico.
Los pasos de la síntesis de proteínas incluyen transcripción, traducción y modificaciones postraduccionales. Durante la transcripción, la ARN polimerasa transcribe una región codificante del ADN en una célula produciendo una secuencia de ARN, específicamente ARN mensajero (ARNm). Esta secuencia de ARNm contiene codones: segmentos largos de 3 nucleótidos que codifican un aminoácido específico. Los ribosomas traducen los codones a sus respectivos aminoácidos.[1] En los seres humanos, los aminoácidos no esenciales se sintetizan a partir de intermediarios en las principales vías metabólicas, como el ciclo del ácido cítrico.[2] Los aminoácidos esenciales deben consumirse y se fabrican en otros organismos. Los aminoácidos se unen mediante enlaces peptídicos formando una cadena polipeptídica. Esta cadena polipeptídica luego pasa por modificaciones postraduccionales y, a veces, se une con otras cadenas polipeptídicas para formar una proteína completamente funcional.
Mecanismo general
Las proteínas incorporadas con la dieta, son primeramente escindidas hasta sus aminoácidos constituyentes por medio de diversas enzimas digestivas y el ácido clorhídrico presentes en el tracto gastrointestinal.[3] Estos aminoácidos, posteriormente son convertidos en α-cetoácidos los cuales pueden ser reciclados en el organismo para la producción de energía, glucosa o grasas o para la resíntesis de aminoácidos. Esta degradación de aminoácidos a α-cetoácidos se lleva a cabo en el hígado, por medio de un proceso conocido como transaminación.[4]
Síntesis de proteínas
La biosíntesis de proteínas se sustenta en cinco procesos:
- Síntesis de aminoácidos
- Síntesis de ARN
- Transcripción (genética)
- Traducción (genética)
- Plegamiento de proteínas
Las proteínas están hechas de aminoácidos. En humanos, algunos aminoácidos se pueden sintetizar usando intermediarios ya existentes. Estos aminoácidos se conocen como aminoácidos no esenciales. Los aminoácidos esenciales requieren intermediarios que no están presentes en el cuerpo humano. Estos intermediarios deben ser ingeridos, principalmente al comer otros organismos.[5]
Síntesis de polipéptidos
Transcripción
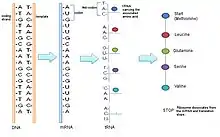
En la transcripción, la ARN polimerasa lee una cadena de ADN y produce una cadena de ARNm que puede traducirse más. Para iniciar la transcripción, el segmento de ADN que se va a transcribir debe ser accesible (es decir, no puede estar muy apretado). Una vez que se puede acceder al segmento de ADN, la ARN polimerasa puede comenzar a transcribir la hebra de ADN codificante emparejando nucleótidos de ARN con la hebra de ADN molde. Durante la fase de transcripción inicial, la ARN polimerasa busca una región promotora en la hebra molde de ADN. Una vez que la ARN polimerasa se une a esta región, comienza a "leer" la cadena de ADN molde en la dirección de 3' a 5'.[6] La ARN polimerasa une bases de ARN complementarias a la hebra de ADN molde (se usará uracilo en lugar de timina). Las nuevas bases de nucleótidos se unen entre sí de forma covalente.[7] Las nuevas bases finalmente se disocian de las bases de ADN pero permanecen unidas entre sí, formando una nueva hebra de ARNm. Esta hebra de ARNm se sintetiza en la dirección 5' a 3'.[8] Una vez que el ARN alcanza una secuencia terminadora, se disocia de la hebra molde de ADN y también termina la secuencia de ARNm.
La transcripción se regula en la célula a través de factores de transcripción. Los factores de transcripción son proteínas que se unen a secuencias reguladoras en la cadena de ADN, como regiones promotoras o regiones operadoras. Las proteínas unidas a estas regiones pueden detener directamente o permitir que la ARN polimerasa lea la cadena de ADN o pueden indicar a otras proteínas que detengan o permitan la lectura de la ARN polimerasa.[9]
Traducción
Durante la traducción, los ribosomas convierten una secuencia de ARNm (ARN mensajero) en una secuencia de aminoácidos. Cada segmento de ARNm de 3 pares de bases es un codón que corresponde a un aminoácido o señal de parada.[10] Los aminoácidos pueden tener múltiples codones que les corresponden. Los ribosomas no unen directamente los aminoácidos a los codones de ARNm. También deben utilizar ARNt (ARN de transferencia). Los ARN de transferencia pueden unirse a aminoácidos y contener un anticodón que puede unirse por hidrógeno a un codón de ARNm.[11] El proceso de unir un aminoácido a un tRNA se conoce como carga de tRNA. Aquí, la enzima aminoacil-tRNA-sintetasa cataliza dos reacciones. En el primero, une una molécula de AMP (escindida de ATP) al aminoácido. La segunda reacción escinde el aminoacil-AMP y produce la energía para unir el aminoácido a la molécula de ARNt.[12]
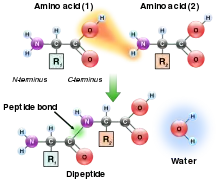
Los ribosomas tienen dos subunidades, una grande y otra pequeña. Estas subunidades rodean la cadena de ARNm. La subunidad más grande contiene tres sitios de unión: A (aminoacilo), P (peptidilo) y E (salida). Después de la iniciación de la traducción (que es diferente en procariotas y eucariotas), el ribosoma entra en el período de elongación que sigue un ciclo repetitivo. Primero, un ARNt con el aminoácido correcto ingresa al sitio A. El ribosoma transfiere el péptido del tRNA en el sitio P al nuevo aminoácido en el tRNA en el sitio A. El ARNt del sitio P se desplazará al sitio E donde será expulsado. Esto ocurre continuamente hasta que el ribosoma alcanza un codón de parada o recibe una señal para detenerse.[11] Se forma un enlace peptídico entre el aminoácido unido al tRNA en el sitio P y el aminoácido unido a un tRNA en el sitio A. La formación de un enlace peptídico requiere un aporte de energía. Las dos moléculas que reaccionan son el grupo amino alfa de un aminoácido y el grupo carboxilo alfa de los otros aminoácidos. Un subproducto de esta formación de enlaces es la liberación de agua (el grupo amino dona un protón mientras que el grupo carboxilo dona un hidroxilo).[13]
La traducción puede ser regulada a la baja por los miARN (microARN). Estas hebras de ARN pueden escindir las hebras de ARNm a las que son complementarias y, por lo tanto, detendrán la traducción.[14] La traducción también se puede regular a través de proteínas auxiliares. Por ejemplo, una proteína llamada factor de iniciación eucariota-2 (eIF-2) puede unirse a la subunidad más pequeña del ribosoma, iniciando la traducción. Cuando se fosforila elF-2, no puede unirse al ribosoma y se detiene la traducción.[15]
Modificaciones postraduccionales

Una vez que se sintetiza la cadena peptídica, aún debe modificarse. Las modificaciones postraduccionales pueden ocurrir antes o después del plegamiento de la proteína. Los métodos biológicos comunes para modificar las cadenas peptídicas después de la traducción incluyen la metilación, la fosforilación y la formación de enlaces disulfuro. La metilación ocurre con la arginina o la lisina e implica agregar un grupo metilo a un nitrógeno (reemplazando un hidrógeno). Los grupos R de estos aminoácidos se pueden metilar varias veces siempre que los enlaces con el nitrógeno no superen las 4. La metilación reduce la capacidad de estos aminoácidos para formar enlaces de hidrógeno, por lo que la arginina y la lisina que están metiladas tienen propiedades diferentes a las de sus contrapartes estándar. La fosforilación ocurre en serina, treonina y tirosina e implica reemplazar un hidrógeno en el grupo alcohol en el extremo del grupo R con un grupo fosfato. Esto agrega una carga negativa en los grupos R y, por lo tanto, cambiará el comportamiento de los aminoácidos en comparación con sus contrapartes estándar. La formación de enlaces disulfuro es la creación de puentes disulfuro (enlaces covalentes) entre dos aminoácidos de cisteína en una cadena que agrega estabilidad a la estructura plegada.[16]
Plegamiento de proteínas
Una cadena polipeptídica en la célula no tiene que permanecer lineal; puede ramificarse o plegarse sobre sí mismo. Las cadenas polipeptídicas se pliegan de una manera particular dependiendo de la solución en la que se encuentren. El hecho de que todos los aminoácidos contengan grupos R con diferentes propiedades es la principal razón por la que las proteínas se pliegan. En un ambiente hidrofílico como el citosol, los aminoácidos hidrofóbicos se concentrarán en el núcleo de la proteína, mientras que los aminoácidos hidrofílicos estarán en el exterior. Esto es entrópicamente favorable ya que las moléculas de agua pueden moverse mucho más libremente alrededor de los aminoácidos hidrofílicos que los aminoácidos hidrofóbicos. En un ambiente hidrofóbico, los aminoácidos hidrofílicos se concentrarán en el núcleo de la proteína, mientras que los aminoácidos hidrofóbicos estarán en el exterior. Dado que las nuevas interacciones entre los aminoácidos hidrofílicos son más fuertes que las interacciones hidrofóbicas-hidrofílicas, esto es entálpicamente favorable.[17] Una vez que una cadena polipeptídica está completamente plegada, se denomina proteína. A menudo, muchas subunidades se combinarán para formar una proteína totalmente funcional, aunque existen proteínas fisiológicas que contienen una sola cadena polipeptídica. Las proteínas también pueden incorporar otras moléculas como el grupo hemo en la hemoglobina, una proteína responsable de transportar oxígeno en la sangre.[18]
Degradación de proteínas
El catabolismo proteico es el proceso por el cual las proteínas son degradadas hasta liberar sus aminoácidos constituyentes. Este proceso se denomina también como proteólisis. La proteólisis puede continuar en la degradación de aminoácidos.
Catabolismo de proteínas a través de enzimas.
Proteasas
Originalmente se pensó que solo interrumpían las reacciones enzimáticas, las proteasas (también conocidas como peptidasas) en realidad ayudan a catabolizar las proteínas a través de la escisión y crean nuevas proteínas que no estaban presentes antes. Las proteasas también ayudan a regular las vías metabólicas. Una forma en que hacen esto es escindiendo enzimas en vías que no necesitan estar en funcionamiento (es decir, gluconeogénesis cuando las concentraciones de glucosa en sangre son altas). Esto ayuda a conservar la mayor cantidad de energía posible y evitar ciclos fútiles. Los ciclos fútiles ocurren cuando las vías catabólica y anabólica están en efecto al mismo tiempo y con la misma velocidad para la misma reacción. Dado que los intermediarios que se crean se consumen, el cuerpo no obtiene ganancias netas. La energía se pierde a través de ciclos fútiles. Las proteasas evitan que ocurra este ciclo alterando la velocidad de una de las vías, o escindiendo una enzima clave, pueden detener una de las vías. Las proteasas también son inespecíficas cuando se unen al sustrato, lo que permite una gran cantidad de diversidad dentro de las células y otras proteínas, ya que se pueden escindir mucho más fácilmente de una manera energéticamente eficiente.[19]
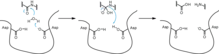
Debido a que muchas proteasas son inespecíficas, están muy reguladas en la célula. Sin regulación, las proteasas destruirán muchas proteínas esenciales para los procesos fisiológicos. Una forma en que el cuerpo regula las proteasas es a través de los inhibidores de proteasas. Los inhibidores de proteasa pueden ser otras proteínas, péptidos pequeños o moléculas. Hay dos tipos de inhibidores de la proteasa: reversibles e irreversibles. Los inhibidores de proteasa reversibles forman interacciones no covalentes con la proteasa que limitan su funcionalidad. Pueden ser inhibidores competitivos, inhibidores poco competitivos e inhibidores no competitivos. Los inhibidores competitivos compiten con el péptido para unirse al sitio activo de la proteasa. Los inhibidores no competitivos se unen a la proteasa mientras el péptido está unido, pero no permiten que la proteasa escinda el enlace peptídico. Los inhibidores no competitivos pueden hacer ambas cosas. Los inhibidores irreversibles de la proteasa modifican covalentemente el sitio activo de la proteasa para que no pueda escindir los péptidos.[20]
Catabolismo de proteínas a través de cambios ambientales.
pH
Las proteínas celulares se mantienen en un pH relativamente constante para evitar cambios en el estado de protonación de los aminoácidos.[21] Si el pH cae, algunos aminoácidos en la cadena polipeptídica pueden protonarse si el pka de sus grupos R es mayor que el nuevo pH. La protonación puede cambiar la carga que tienen estos grupos R. Si el pH aumenta, algunos aminoácidos de la cadena pueden desprotonarse (si el pka del grupo R es inferior al nuevo pH). Esto también cambia la carga del grupo R. Dado que muchos aminoácidos interactúan con otros aminoácidos en función de la atracción electrostática, cambiar la carga puede romper estas interacciones. La pérdida de estas interacciones altera la estructura de las proteínas, pero lo que es más importante, altera la función de las proteínas, lo que puede ser beneficioso o perjudicial. Un cambio significativo en el pH puede incluso interrumpir muchas interacciones que los aminoácidos producen y desnaturalizan (desdoblan) la proteína.[22]
La temperatura
A medida que aumenta la temperatura en el ambiente, las moléculas se mueven más rápido. Los enlaces de hidrógeno y las interacciones hidrofóbicas son importantes fuerzas estabilizadoras en las proteínas. Si la temperatura aumenta y las moléculas que contienen estas interacciones se mueven demasiado rápido, las interacciones se ven comprometidas o incluso se rompen. A altas temperaturas, estas interacciones no pueden formarse y se desnaturaliza una proteína funcional.[23] Sin embargo, se basa en dos factores; el tipo de proteína utilizada y la cantidad de calor aplicada. La cantidad de calor aplicada determina si este cambio en la proteína es permanente o si se puede transformar de nuevo a su forma original.[24]
Referencias
- «ATDBio - Transcription, Translation and Replication». atdbio.com. Consultado el 5 de mayo de 2022.
- Internet Archive, Jeremy M. (Jeremy Mark); Tymoczko, John L.; Stryer, Lubert; Stryer, Lubert Biochemistry; National Center for Biotechnology Information (U.S.) (2002). Biochemistry [electronic resource]. New York : W.H. Freeman ; [Bethesda, MD] NCBI. ISBN 978-0-7167-3051-4. Consultado el 5 de mayo de 2022.
- Mehta, S. Digestion of Dietary Proteins
- Mehta, S. Metabolism of amino acids- bimolecular ping pong mechanism of transamination.
- Voet, Judith G.; Pratt, Charlotte W. (2013). Fundamentals of biochemistry : life at the molecular level (Fourth edition edición). Wiley. ISBN 978-0-470-54784-7. OCLC 738349533. Consultado el 5 de mayo de 2022.
- Brown, T. A. (2002). Genomes (2nd ed edición). Bios. ISBN 1-85996-228-9. OCLC 50331286. Consultado el 30 de mayo de 2022.
- «Chemistry for Biologists». RSB. Consultado el 30 de mayo de 2022.
- Griffiths, Anthony J. F. (2000). An introduction to genetic analysis (7th ed edición). W.H. Freeman. ISBN 0-7167-3520-2. OCLC 42049331. Consultado el 30 de mayo de 2022.
- Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). Molecular biology of the cell (4th ed edición). Garland Science. ISBN 0-8153-3218-1. OCLC 48122761. Consultado el 30 de mayo de 2022.
- «National Human Genome Research Institute Home | NHGRI». www.genome.gov. Consultado el 30 de mayo de 2022.
- Cooper, Geoffrey M. (1997). The cell : a molecular approach. ASM Press. ISBN 0-87893-119-8. OCLC 35151219. Consultado el 30 de mayo de 2022.
- Jakubowski, Hieronim (17 de noviembre de 2011). «Quality control in tRNA charging». Wiley Interdisciplinary Reviews: RNA 3 (3): 295-310. ISSN 1757-7004. doi:10.1002/wrna.122. Consultado el 30 de mayo de 2022.
- Tymoczko, John L.; Stryer, Lubert; Stryer, Lubert (2002). Biochemistry (5th ed edición). W.H. Freeman. ISBN 0-7167-3051-0. OCLC 48055706. Consultado el 30 de mayo de 2022.
- «microRNA (micRNA/miRNA)». SpringerReference (Springer-Verlag). Consultado el 30 de mayo de 2022.
- Kimball, Scot R (1999-01). «Eukaryotic initiation factor eIF2». The International Journal of Biochemistry & Cell Biology (en inglés) 31 (1): 25-29. doi:10.1016/S1357-2725(98)00128-9. Consultado el 30 de mayo de 2022.
- Mander, Lewis N.; Liu, Hung-wen (2010). Comprehensive natural products II : chemistry and biology. ISBN 978-0-08-045382-8. OCLC 656362146. Consultado el 30 de mayo de 2022.
- Lodish, Harvey F. (2000). Molecular cell biology (4th ed edición). W.H. Freeman. ISBN 0-7167-3136-3. OCLC 41266312. Consultado el 30 de mayo de 2022.
- PubChem. «Protoheme». pubchem.ncbi.nlm.nih.gov (en inglés). Consultado el 30 de mayo de 2022.
- López-Otín, Carlos; Bond, Judith S. (2008-11). «Proteases: Multifunctional Enzymes in Life and Disease». Journal of Biological Chemistry 283 (45): 30433-30437. ISSN 0021-9258. PMC 2576539. PMID 18650443. doi:10.1074/jbc.r800035200. Consultado el 30 de mayo de 2022.
- Geretti, Anna Maria; National Center for Biotechnology Information (2006). Antiretroviral resistance in clinical practice. Mediscript Ltd. ISBN 0-9551669-0-X. OCLC 77517389. Consultado el 30 de mayo de 2022.
- Boyle, John (2005-01). «Lehninger principles of biochemistry (4th ed.): Nelson, D., and Cox, M.». Biochemistry and Molecular Biology Education 33 (1): 74-75. ISSN 1470-8175. doi:10.1002/bmb.2005.494033010419. Consultado el 30 de mayo de 2022.
- Boyle, John (2005-01). «Lehninger principles of biochemistry (4th ed.): Nelson, D., and Cox, M.». Biochemistry and Molecular Biology Education (en inglés) 33 (1): 74-75. doi:10.1002/bmb.2005.494033010419. Consultado el 30 de mayo de 2022.
- «Denaturation Protein». chemistry.elmhurst.edu. Consultado el 30 de mayo de 2022.
- Djikaev, Y. S.; Ruckenstein, Eli (2008). «Temperature effects on the nucleation mechanism of protein folding and on the barrierless thermal denaturation of a native protein». Physical Chemistry Chemical Physics 10 (41): 6281. ISSN 1463-9076. doi:10.1039/b807399f. Consultado el 30 de mayo de 2022.