Azeótropo
Un azeótropo o aceótropo (también denominado mezcla azeotrópica o aceotrópica) es una mezcla líquida de composición definida (única) entre dos o más compuestos químicos que hierve a temperatura constante y que se comporta como si estuviese formada por un solo componente, por lo que al hervir, su fase de vapor tendrá la misma composición que su fase líquida.
Un azeótropo puede hervir a una temperatura superior, intermedia o inferior a la de los constituyentes de la mezcla, permaneciendo el líquido con la misma composición inicial, al igual que el vapor, por lo que no es posible separarlos por destilación simple o por extracción líquido-vapor utilizando líquidos iónicos como el cloruro de 1-butil-3-metilimidazolio.
El azeótropo que hierve a una temperatura máxima se llama azeótropo de ebullición máxima y el que lo hace a una temperatura mínima se llama azeótropo de ebullición mínima. Los sistemas azeotrópicos de ebullición mínima son más frecuentes que los de ebullición máxima.
Un ejemplo es la mezcla de etanol y agua,[1] que forma un azeótropo para una concentración del 95,6 % en peso de alcohol, que hierve a una temperatura de 78,2 °C a una presión de 0,1 MPa. Con una destilación fraccionada se obtiene un alcohol con esta concentración, pero para conseguir un compuesto más puro se necesita utilizar recursos especiales como una destilación azeotrópica.
Tipos
Los azeótropos constituidos por 2 componentes son llamados azeótropos binarios, por tres azeótropos ternarios, etc.
Azeótropos positivos y negativos
Cada azeótropo tiene una temperatura de ebullición característica. Cuando la temperatura de ebullición es menor que las temperaturas de ebullición de cualquiera de sus componentes se denomina azeótropo positivo, mezcla de ebullición mínima o azeótropo de presión máxima, debido a cómo el comportamiento de esta mezcla se desvía de la ley de Raoult. Cuando la ebullición del azeótropo se da a una temperatura mayor que la de cada uno de sus componentes, se denomina azeótropo negativo, mezcla de ebullición máxima o azeótropo de presión mínima, debido igualmente a cómo el comportamiento de esta mezcla se desvía de la ley de Raoult.
Un ejemplo conocido de azeótropo positivo es la mezcla de un 95.63 % (en masa) de etanol en agua, que a presión atmosférica (1 atm, o 101.3 kPa) hierve a 78.2 °C, mientras que el etanol y el agua hierven, a esa presión, a 78.4 °C y 100 °C, respectivamente. 78.2 °C es la mínima temperatura a la que una mezcla de etanol en agua puede hervir, a presión atmosférica.[2]
Un ejemplo de mezcla azeotrópica negativa es el ácido clorhídrico a una concentración de 20.2 % (en masa) de cloruro de hidrógeno en agua, que hierve, a presión atmosférica, a una temperatura de 110 °C, cuando el cloruro de hidrógeno y el agua hierven a −84 °C y 100 °C, a esa misma presión.
Azeótropos homogéneos y heterogéneos
Si los compuestos presentes en la mezcla no son completamente miscibles, es posible encontrar un azeótropo sobre el rango en que no son miscibles. Este tipo de azeótropo se llama heterogéneo o heteoroazeótropo, debido a la presencia de dos fases líquidas, además de la fase vapor. Por el contrario, si el azeótropo se encuentra fuera de una zona de inmiscibilidad (como los ejemplos anteriores de etanol en agua y de cloruro de hidrógeno en agua), se trata de un azeótropo homogéneo.
Los heteroazeótropos son siempre mezclas de mínima ebullición
Destilación de mezclas azeotrópicas
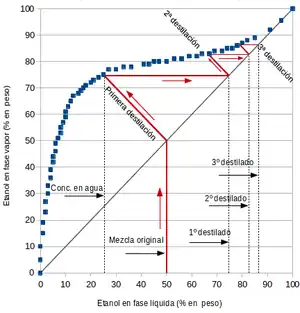
Si dos solventes forman un azeótropo positivo, la destilación de una mezcla de estos compuestos con cualquier composición, producirá un destilado con una composición más cercana a la del azeótropo. Retomando el ejemplo etanol+agua, si se someta a una destilación simple una mezcla al 50 % de etanol evaporando un 50 % de la mezcla se obtendrán dos productos: agua más pura en fondo (~25 % etanol), y un destilado con una concentración mayor en etanol (~74 %). Si esa mezcla vuelve a destilarse se obtendrá un 2º destilado, con una concentración de etanol de aproximadamente 82 %. Una 3ª destilación arrojará dará un destilado de un ~87 % de etanol. Como se aprecia en la figura, sucesivas destilaciones aproximan el destilado a una composición del azeótropo (95 % de etanol), pero nunca a etanol puro. También es posible partir de una mezcla con una composición de etanol mayor que la del azeótropo, lo que volverá a producir un destilado más cercano en composición al azeótropo, y un fondo esta vez más rico en etanol en lugar de agua.[3][4] En teoría, infinitas destilaciones dan como resultado una mezcla de composición azeotrópica. En la práctica esto no es posible, ya que en este ejemplo hemos supuesto que en cada destilación evaporamos solo la mitad por lo tanto, a infinito número de destilaciones, se tiene una cantidad infinitamente pequeña de destilado.
En tanto, si dos componentes forman un azeótropo negativo, no será el destilado sino el residuo el que se acerque en composición al azeótropo. Retomando el ejemplo de cloruro de hidrógeno+agua, conteniendo menos de un 20.2 % de cloruro de hidrógeno, una primera destilación simple deja como residuo una mezcla más concentrada en ácido clorhídrico. Si por el contrario, la solución contiene más que un 20.2 % de cloruro de hidrógeno el residuo tendrá menos ácido que el original, acercándose a su composición azeotrópica.[5]
Ejemplos
- Ácido nítrico (68,4 %) / agua, hierve a 122 °C.
- Ácido perclórico (28,4 %) / agua, hierve a 203 °C (azeótropo negativo).
- Ácido fluorhídrico (35,6 %) / agua, hierve a 111,35 °C (azeótropo negativo).
- Etanol (95 %) / agua, hierve a 78,2 °C.
- Ácido sulfúrico (98,3 %) / agua, hierve a 336 °C.
- Acetona / metanol / cloroformo forma un azeótropo intermedio.
- Cloruro de hidrógeno (20 %) / agua
Véase también
Referencias
- National Institute of Standards and Technology. «Standard Reference Material 1828: Ethanol-Water Solutions». Archivado desde el original el 8 de junio de 2011.
- Rousseau, Ronald W.; R. Fair, James (1987). Handbook of separation process technology. Wiley-IEEE. pp. 261–262. ISBN 047189558X.
- Morrison, Robert Thornton; Boyd, Robert Neilson, Organic Chemistry, 2nd ed., Allyn and Bacon, 1972, p 508
- http://www.chemguide.co.uk/physical/phaseeqia/nonideal.html
- Merck Index of Chemicals and Drugs, 9th ed., monograph 4667