Mojabilidad
La mojabilidad[n. 1] es la capacidad que tiene un líquido de extenderse y dejar una traza sobre un sólido. Depende de las interacciones intermoleculares entre las moléculas superficiales de ambas sustancias. Se puede determinar a partir del ángulo que el líquido forma en la superficie de contacto con el sólido, denominado ángulo de contacto; a menor ángulo de contacto, mayor mojabilidad.[1]

La mojabilidad está relacionada con otros efectos, como la capilaridad. Independientemente del valor de la mojabilidad, cualquier líquido sobre una superficie sólida forma un casquete esférico.[cita requerida] Algunas sustancias disueltas en el agua pueden modificar su tensión superficial y por tanto su mojabilidad.[1]
Descripción del fenómeno
La mojabilidad depende de las fuerzas intermoleculares de los materiales en contacto; las fuerzas adhesivas entre el líquido y el sólido provocan que el líquido se extienda por la superficie, mientras que las cohesivas del líquido hacen que este se abulte y tienda a evitarla.
El ángulo de contacto es el ángulo que forma el líquido respecto a la superficie de contacto con el sólido, y está determinado por la resultante de las fuerzas adhesivas y cohesivas. Como la tendencia de una gota a expandirse en una superficie plana aumenta con la disminución del ángulo de contacto, este ángulo proporciona una medida de la inversa de la mojabilidad.[2]
| Tabla donde se exponen los diferentes ángulos de contacto y sus correspondientes interacciones sólido/líquido y líquido/líquido.[3] | |||
| Ángulo de contacto | Grado de mojabilidad |
Fuerzas intermoleculares: | |
|---|---|---|---|
| S/L interacciones |
L/L interacciones | ||
| = 0 | Perfecta | fuerte | débil |
| 0 < < 90° | Alta | fuerte | fuerte |
| débil | débil | ||
| 90° ≤ < 180° | Baja | débil | fuerte |
| = 180° | Nula | débil | fuerte |
Un ángulo de contacto pequeño (< 90°) indica que la mojabilidad es muy alta, y el fluido se extenderá sobre la superficie; ángulos de contacto grandes (> 90°) significan que la mojabilidad es baja y el fluido disminuirá el contacto con la superficie, formando una gota compacta.
En el caso del agua, una superficie en la cual la mojabilidad sea alta se denomina hidrofílica, y en caso contrario hidrofóbica. Las superficies superhidrofóbicas presentan ángulos de contacto mayores a 150°, produciéndose un escaso contacto entre la gota líquida y la superficie. Este fenómeno se denomina efecto lotus. Para líquidos distintos al agua, se utiliza el término liófilo para designar a la condición de ángulo de contacto pequeño, y liófobo para ángulos de contacto grandes. De modo similar, se utilizan los términos onmifóbico y onmifílico para líquidos polares y apolares, respectivamente.
Tipos de superficie
Existen dos tipos principales de superficies sólidas con las que los líquidos pueden interactuar. Tradicionalmente se han dividido en superficies sólidas de alta y de baja energía. Sólidos como los metales, los vidrios y las cerámicas, se conocen como «sólidos duros» porque sus enlaces químicos son muy fuertes. Por tanto, es necesaria una gran cantidad de energía para romper dichos sólidos; se les denomina superficies de «alta energía». La mayoría de los líquidos moleculares presentan mojabilidad completa al estar en contacto con este tipo de superficies.
Por otro lado, entre las superficies de «baja energía» se encuentran los cristales moleculares débiles, como los fluorocarbonos y los hidrocarbonos, en los que las moléculas se encuentran unidas esencialmente por las interacciones entre las mismas, ya sea mediante puentes de hidrógeno o fuerzas de van der Waals. En este caso, la mojabilidad dependerá del tipo de líquido escogido, pudiendo ser parcial o completa.[4][5]
Mojabilidad en superficies de baja energía
Las superficies de baja energía interaccionan con los líquidos principalmente a través de las fuerzas de dispersión (fuerzas de van der Waals). Zisman observó que:[6][7]
- El coseno del ángulo de contacto () aumenta linealmente a medida que la tensión superficial del líquido () disminuye. Determinó estos valores para varios líquidos orgánicos.
La mojabilidad es mayor cuanto menor sea , y por tanto cuanto menor sea . Se define la tensión superficial crítica () como la tensión superficial necesaria para que la mojabilidad sea perfecta (). Este término es un parámetro importante porque depende solamente de las características del sólido.
Conociendo la tensión superficial crítica de un sólido, es posible predecir la mojabilidad que tendrá una superficie:[2]
- La mojabilidad de una superficie está determinada por los grupos químicos de la parte externa del sólido.
- Las diferencias en la mojabilidad entre superficies que poseen estructuras similares se deben al distinto empaquetamiento de los átomos. Por ejemplo, el empaquetamiento de una superficie que posea cadenas ramificadas será peor que una que posea cadenas lineales.
La mojabilidad de una superficie puede ser modelada mediante el efecto piroeléctrico.[8]
Superficies sólidas ideales
Se dice que una superficie sólida es ideal cuando es plana, rígida, perfectamente lisa, químicamente homogénea, y no posee histéresis del ángulo de contacto. La ausencia de histéresis implica que los ángulos de contacto de avance y retroceso son iguales. En otras palabras, solamente existe un ángulo de contacto termodinámicamente estable. Cualquier gota que sufra una perturbación en una superficie de este tipo recuperará su forma original.[3][6]
Minimización de la energía (tres fases)


En equilibrio termodinámico, la fuerza neta por unidad de longitud que actúa a lo largo del límite en el que las tres fases están en contacto debe ser nula. Las componentes de la fuerza neta en la dirección de cada una de las interfases vienen dadas por:
donde , y son los ángulos de contacto y es la energía superficial entre las dos fases indicadas. Estas relaciones también pueden expresarse mediante el denominado triángulo de Neumann. Al ser un triángulo se cumple la restricción geométrica , y al aplicar la ley del seno y la ley del coseno se deducen las relaciones que describen la dependencia entre los ángulos de contacto y las energías superficiales.[9]
En el triángulo de Neumann los lados representan las energías superficiales, y por tanto se deben cumplir las desigualdades triangulares : esto quiere decir que cualquiera de las tensiones superficiales no puede exceder la suma de las otras dos. Si se ponen en contacto tres fluidos con energías superficiales tales que no cumplen las desigualdades anteriores, no existirá ninguna configuración de equilibrio.
Relación de Young
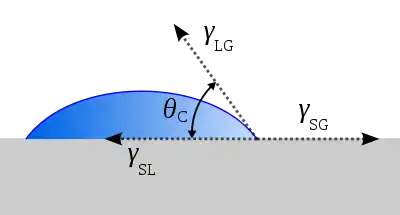
Si la fase se reemplaza por una superficie sólida rígida, entonces se cumple , y la segunda ecuación de la fuerza neta se simplifica a la ecuación de Young.[10]
Esta ecuación relaciona las tensiones superficiales entre las tres fases: sólido, líquido y vapor. A partir de las tres energías superficiales, predice el ángulo de contacto de una gota de líquido en una superficie sólida. La ecuación también se puede aplicar si la fase vapor es otro líquido, con la condición de que sea inmiscible con la gota del primer líquido.
En la definición de ySL y ySV, ninguna de las cuales podemos medir de forma conveniente y fiable, existe la dificultad de que cualquier tensión de tracción existente en la superficie de un sólido rara vez será un sistema en equilibrio. Las superficies de los sólidos rara vez están libres de tensiones.
Otro enfoque evita especificar el campo de la fuerza intermolecular entre sólido y líquido y en su lugar recurre a la termodinámica. Dupré fue el que introdujo el trabajo reversible de adhesión de líquido y sólido, WA, y su relación con γSV y γSL.
WA= γSV + γLV - γSL
Siendo WA la energía de adhesión por unidad de área de superficies sólido-líquido en el medio V (vapor).
Esta ecuación es simplemente la expresión termodinámica del hecho de que el trabajo reversible de separar las fases líquida y sólida debe ser igual al cambio en la energía libre del sistema.
Combinando la ecuación de Young y la de Dupre:
WA = γLV (cos θ +1)
El ángulo de humectancia puede ser usado además para determinar la energía superficial, siempre que otra energía superficial sea conocida. La ecuación puede ser reescrita de la forma Young-Dupre:
Si θ = 0° entonces cos θ=1: WA = 2γLV =Wc líquido (sólido mojado completamente)
Si θ = 90° entonces cos θ=0: WA = γLV = WA < Wc (sólido mojado parcialmente)
Si θ = 180° entonces cos θ=-1: WA = 0 liquid (sólido idealmente hidrofóbico)
Siendo Wc =2γLV, el trabajo necesario para separar en dos partes una columna de área unitaria de un mismo líquido.
Superficies sólidas no ideales
.jpg.webp)
Al contrario que las superficies ideales, las reales no son perfectamente rígidas, lisas, u homogéneas químicamente. Estas desviaciones de lo ideal producen un fenómeno denominado histéresis del ángulo de contacto, el cual se define como la diferencia entre los ángulos de contacto de avance () y de retroceso ():[12]
En términos más simples, la histéresis del ángulo de contacto es esencialmente el desplazamiento de una línea de contacto, ya sea por expansión o retracción de la gota. Este fenómeno ocurre debido a que en un sólido no ideal existen diferentes ángulos de contactos termodinámicamente estables: el ángulo de contacto de avance es el ángulo estable más elevado, mientras que el de retroceso es el ángulo estable más pequeño posible. Estos estados se conocen como estados termodinámicos metaestables.[6]
Este movimiento del límite de una de las fases se denomina mojabilidad dinámica. Cuando una línea de contacto avanza, cubriendo más superficie con líquido, el ángulo de contacto se incrementa y generalmente está relacionado con la velocidad de la línea de contacto.[13] Si la velocidad de una línea de contacto aumenta sin límite, el ángulo de contacto también aumenta, y a medida que se aproxima a 180°, la fase vapor queda constreñida en una fina capa entre el líquido y el sólido. Se trata de un efecto cinético de no-equilibrio que tiene lugar cuando la línea de contacto se mueve a una velocidad tan elevada que nunca podrá obtenerse mojabilidad completa.
Un ejemplo de desviación de lo ideal sucede cuando la superficie en cuestión posee una textura rugosa. Las superficies rugosas pueden clasificarse en homogéneas y heterogéneas. Se dice que el régimen es homogéneo donde el líquido rellena los surcos de la superficie, y heterogéneo donde la superficie es una composición de dos tipos de parches. El ejemplo más común de superficie heterogénea es la compuesta por aire y sólido. Este tipo de superficies influyen de distinta manera en los ángulos de contacto. Los modelos de Cassie-Baxter y de Wenzel son los dos principales que intentan describir la mojabilidad de las superficies texturadas. Sin embargo, sus ecuaciones solamente pueden aplicarse cuando el tamaño de la gota es suficientemente grande comparado con las rugosidades de la superficie.[14]
Véase también
Notas
- También recibe los nombres de bañarme, humectabilidad, mojado, poder mojante o poder humectante.
Referencias
- Lévy, Élie (1993). Diccionario de física. AKAL. p. 537. ISBN 9788446001447. Consultado el 5 de abril de 2010.
- Sharfrin, E. (1960). «Constitutive relations in the wetting of low energy surfaces and the theory of the retraction method of preparing monolayers». The Journal of Physical Chemistry 64 (5): 519-524. doi:10.1021/j100834a002.
- Eustathopoulos, N.; Nicholas, M.G. and Drevet B. (1999). Wettability at high temperatures. Pergamon. ISBN 0080421466.
- Schrader, M.E; Loeb, G.I. (1992). Modern Approaches to Wettability. Theory and Applications. Nueva York: Plenum Press. ISBN 0306439859.
- Gennes, P.G. de (1985). «Wetting: statics and dynamics». Reviews of Modern Physics 57 (3): 827-863. doi:10.1103/RevModPhys.57.827.
- Johnson, Rulon E. (1993) in Wettability Ed. Berg, John. C. New York, NY: Marcel Dekker, Inc.
- Zhu, Ruzeng; Cui, Shuwen y Wang, Xiaosong (2010). «Theoretical foundation of Zisman's empirical equation for wetting of liquids on solid surfaces». European Journal of Physics (en inglés) 31 (2): 251. doi:10.1088/0143-0807/31/2/001.
- Ferraro, Pietro (2008). «Wettability patterning of lithium niobate substrate by modulating pyroelectric effect to form microarray of sessile droplets». Applied Physics Letters 92: 213107. doi:10.1063/1.2936851.
- Rowlinson, J.S.; Widom, B. (1982). Molecular Theory of Capillarity. Oxford, UK: Clarendon Press. ISBN 019855642X.
- Young, T. (1805). «An Essay on the Cohesion of Fluids». Philosophical Transactions of the Royal Society 95: 65-87. doi:10.1098/rstl.1805.0005.
- T. S. Chow (1998). «Wetting of rough surfaces». Journal of Physics: Condensed Matter 10 (27): L445. doi:10.1088/0953-8984/10/27/001.
- Robert J. Good (1992). «Contact angle, wetting, and adhesion: a critical review». J. Adhesion Sci. Technol. 6 (12): 1269-1302. doi:10.1163/156856192X00629.
- De Gennes, P. G. (1994). Soft Interfaces. Cambridge, UK: Cambridge University Press. ISBN 0521564174.
- Abraham Marmur (2003). «Wetting of Hydrophobic Rough Surfaces: To be heterogeneous or not to be». Langmuir 19: 8343-8348. doi:10.1021/la0344682.
Bibliografía
- Zuluaga, Elizabeth (2001). Humectabilidad. Universidad Nacional de Colombia.
- Pierre-Gilles de Gennes, Françoise Brochard-Wyart, David Quéré (2004). Capillarity and wetting phenomena: drops, bubbles, pearls, waves (en inglés). Springer. ISBN 9780387005928.
- V. M. Starov, Manuel García Velarde, Clayton John Radke (2007). Wetting and spreading dynamics (en inglés). CRC Press. ISBN 9781574445404.
- Berg, John C. (1993). Wettability (en inglés). CRC Press. ISBN 9780824790462.