Nitración
La nitración es un proceso químico general para la introducción de un grupo nitro en un compuesto químico mediante una reacción química.
Ejemplos de nitraciones simples son la conversión de glicerina en nitroglicerina con ácido nítrico y sulfúrico, la de la cianhidrina de acetona con ácido nítrico en anhídrido acético para obtener nitrato de acetocianhidrina[1] y la conversión de α-bromobutirato de etilo en α-nitrobutirato de etilo con nitrito sódico.[2]
Nitración aromática
La nitración aromática sucede con compuestos aromáticos gracias a un mecanismo de sustitución electrófila aromática que incluye el ataque de un anillo bencénico rico en electrones por parte del ion nitronio.
El benceno resulta nitrado gracias al reflujo de ácido sulfúrico concentrado y ácido nítrico concentrado a 50 °C.
- 2H2SO4 + HNO3 → 2HSO41- + NO2+ + H3O+
- C6H6 + NO2+ → C6H5NO2 + H+
- H+ + H3O+ + 2HSO41- → H2O + 2H2SO4
El ácido sulfúrico es regenerado y por tanto actúa como catalizador.
Mecanismo de reacción
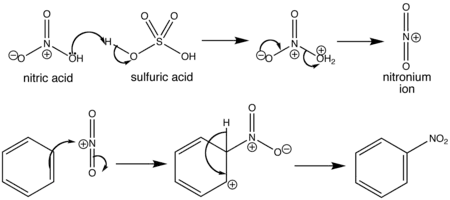
El benceno reacciona con ácido nítrico concentrado y caliente dando nitrobenceno. La reacción presenta dos inconvenientes: es lenta y además el ácido nítrico concentrado y caliente puede oxidar cualquier compuesto orgánico mediante una reacción explosiva. Un procedimiento más seguro consiste en emplear una mezcla de ácido nítrico y ácido sulfúrico. El ácido sulfúrico actúa como catalizador, permitiendo que la reacción se lleve a cabo más rápidamente y a menores temperaturas.
El ácido sulfúrico reacciona con el ácido nítrico generando el ion nitronio (NO2+), que es el electrófilo de la reacción de sustitución electrofílica aromática.
El ion nitronio reacciona con el benceno formando el complejo sigma que pierde un protón que es atrapado por el ion bisulfato para dar lugar al nitrobenceno.
Alcance
La selectividad es siempre un desafío en las nitraciones. La nitración con fluorenona es selectiva y produce un compuesto trinitro[3] o tetranitro[4] ajustando las condiciones de reacción sólo ligeramente. Otro ejemplo de trinitración puede hallarse en la síntesis del floroglucinol.
Otros reactivos de nitración incluyen el tetrafluoroborato de nitronio, que es una sal de nitronio auténtica. Este compuesto puede ser preparado a partir de fluoruro de hidrógeno, ácido nítrico y trifluoruro de boro.[5] Los compuestos aromáticos nitrados son intermediarios importantes para las anilinas mediante la acción de un agente reductor.
Una mayor dilucidación de la selectividad puede hallarse examinando los sustituyentes de anillos y el efecto que tienen en la tasa de reacción de esta sustitución electrófila aromática. Los grupos de desactivación tales como otros grupos nitro tienen un efecto de retirada del par de electrones que desactiva la reacción (creando dificultad en la formación de productos polinitrados) y dirige el electrofílico ion nitronio a atacar la posición meta aromática.
Los sustitutos desactivadores meta-directores incluyen el tionil, grupos ciano, cetonas, pueden ser ésteres o derivados carboxílicos. La nitración puede ser activada mediante grupos de activación tales como aminas, hidroxilo, metilo, también amidas y éteres resultantes en para y orto isómeros.
Referencias
- Jeremiah P. Freeman e Inella G. Shepard. «4-Nitro-morpholine». Organic Syntheses, Coll. Vol. 5, p.839 (1973); Vol. 43, p.83 (1963)
- Nathan Kornblum y Robert K. Blackwood. «ethyl α-nitrobutyrate». Organic Syntheses, Coll. Vol. 4, p.454 (1963); Vol. 37, p.44 (1957)
- E. O. Woolfolk y Milton Orchin. «2,4,7-Trinitrofluorenone» Archivado el 23 de enero de 2007 en Wayback Machine.. Organic Syntheses, Coll. Vol. 3, p.837; Vol. 28, p.91
- Melvin S. Newman y H. Boden. «2,4,5,7-tetranitrofluorenone» Archivado el 23 de enero de 2007 en Wayback Machine.. Organic Syntheses, Coll. Vol. 5, p.1029; Vol. 42, p.95
- George A. Olah y Stephen J. Kuhn. «Benzonitrile, 2-methyl-3,5-dinitro-» Archivado el 22 de marzo de 2007 en Wayback Machine.. Organic Syntheses Volumen Anual 47, p. 56