Nonacarbonilo de dihierro
El nonacarbonilo de dihierro es un compuesto inorgánico con la fórmula molecular Fe2(CO)9 que descompone a temperaturas superiores a los 100 °C. Este carbonilo metálico es un reactivo importante en la química organometálica y se usa ocasionalmente en síntesis orgánica.[2] Es una fuente de Fe(0) más reactivo que el Fe(CO)5 y menos peligroso de manejar, ya que no es volátil. Este sólido de color naranja micáceo es prácticamente insoluble en todos los disolventes comunes.
| Nonacarbonilo de dihierro | ||
|---|---|---|
9noFeFe.png.webp) | ||
 | ||
| Nombre IUPAC | ||
| Tri-μ-carbonil-bis(tricarbonilhierro) | ||
| General | ||
| Otros nombres | Nonacarbonilo de hierro | |
| Fórmula semidesarrollada | Fe2(CO)9 | |
| Fórmula molecular | Fe2C9O9 | |
| Identificadores | ||
| Número CAS | 15321-51-4[1] | |
| ChemSpider | 4807522 | |
| PubChem | 6096993 | |
| Propiedades físicas | ||
| Apariencia | naranja | |
| Densidad | 2080 kg/m³; 2,08 g/cm³ | |
| Masa molar | 36 378 g/mol | |
| Propiedades químicas | ||
| Momento dipolar | 0,0 D | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis y estructura
Siguiendo el método original:[3] fotólisis en una disolución de ácido acético de Fe(CO)5 se produce Fe2(CO)9 con buen rendimiento:[4]
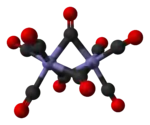
El nonacarbonilo de dihierro consiste en un par de centros metálicos Fe(CO)3 centros unidos por tres ligandos puente CO. Aunque la mayoría de libros de texto muestran un enlace Fe-Fe, análisis teóricos han manifestado consistentemente la ausencia de un enlace directo Fe-Fe.[2]
Historia
Heinrich Hirtz y su colega M. Dalton Cowap (trabajadores de la industria Imperial Chemical Industries sintetizaron varios carbonilos metálicos mononuecleares (de cobalto, molibdeno, rutenio), así como el nonacarbonilo de dihierro.[5] La elucidación de la estructura del nonacarbonilo de dihierro, que surge de la exposición a la luz solar del pentacarbonilo de hierro, no fue posible hasta 1906 gracias a James Dewar y H.O. Jones.[6]
Notas
- Número CAS
- Jennifer C. Green, Malcolm L. H. Green, Gerard Parkin "The occurrence and representation of three-centre two-electron bonds in covalent inorganic compounds" Chem. Commun. 2012, 11481-11503. doi 10.1039/c2cc35304k
- Edmund Speyer; Hans Wolf (1924). «Über die Bildungsweise von Eisen-nonacarbonyl aus Eisen-pentacarbonyl». Berichte der deutschen chemischen Gesellschaft 60: 1424-1425. doi:10.1002/cber.19270600626.
- E. H. Braye, W. Hübel (1966). «Diiron Enneacarbonyl». Inorg. Synth. Inorganic Syntheses 8: 178. ISBN 978-0-470-13239-5. doi:10.1002/9780470132395.ch46.
- L. Mond, H. Hirtz, M. D. Cowap: Note on a Volatile Compound of Cobalt With Carbon Monoxide. In: Chem. News. vol. 98, 1908, S. 165; Chem. Abs. vol. 2, 1908, S. 3315.
- J. Dewar, H. O. Jones: The Physical and Chemical Properties of Iron Carbonyl. In: Proc. R. Soc. Lond. A. 6. Dezember 1905, 76, doi 10.1098/rspa.1905.0063, S. 558–577.