Carbonilo de metal
Los carbonilos de metal o carbonilos metálicos son complejos de metales de transición con ligandos de monóxido de carbono. Los mismos pueden ser complejos de carácter eléctricamente neutro, o cationes carbonilos de metal (con carga positiva) o carbonilatos de metal (con carga negativa). El ligando monóxido de carbono puede estar unido terminalmente a un solo átomo de metal o en puente con dos o más átomos de metal. Estos complejos son homolépticos, o sea solo contienen ligandos de CO, tales como el carbonilo de níquel (Ni(CO)4), pero los carbonilos de metal más comunes son heterolépticos y contienen una mezcla de ligandos.

Un átomo de hierro con cinco ligandos CO.
Los carbonilos de metal son útiles en síntesis orgánica y como catalizadores o precursores catalíticos en catálisis homogénea, tal como ser hidroformilación y química de Reppe. En el proceso Mond, se utiliza el carbonilo de níquel para purificar el níquel. En la química organometálica los carbonilos de metal sirven como precursores para la preparación de otros complejos organometálicos.
Los carbonilos metálicos son tóxicos al contacto con la piel, inhalación o ingestión, en parte a causa de su capacidad de carbonilatar la hemoglobina dando carboxihemoglobina, que evita la unión del O2.[1]
Introducción histórica

En 1890, Ludwig Mond sintetizó el primer carbonilo metálico binario, el tetracarbonilo de níquel (Ni(CO)4), tóxico y muy volátil, que se usó para purificar el níquel por el proceso Mond. Tratando óxidos y sales de níquel con monóxido de carbono, encontró que el gas resultante de la llama de un mechero Bunsen de color amarillo verdoso, que por calentamiento en un tubo de vidrio forma un espejo de níquel. El gas podía condensarse en un líquido incoloro, transparente, con un punto de ebullición de 43 °C. Por lo tanto, el grupo de Mond había descubierto por vez primera el tetracarbonilo níquel puro.[2] La inusual volatilidad de un compuesto metálico, hizo que Lord Kelvin afirmara que Mond logró dar alas al metal.
En 1891, Marcellin Berthelot y Mond descubrieron simultáneamente de forma independiente el pentacarbonilo de hierro (Fe(CO)5) de forma similar al tetracarbonilo de níquel.
Heinrich Hirtz y su colega M. Dalton Cowap (trabajadores de la industria Imperial Chemical Industries (fundada entre otros por Mond), sintetizan más carbonilos metálicos mononuecleares (de cobalto, molibdeno, rutenio), así como el nonacarbonilo de dihierro.[3] La elucidación de la estructura del nonacarbonilo de dihierro, que surge de la exposición a la luz solar del pentacarbonilo de hierro, no fue posible hasta 1906 gracias a James Dewar y HO Jones.[4] Después de la muerte de Mond en 1909, la química de los carbonilos de metal cayó en el olvido algunos años, hasta que BASF la retomó en 1924, con la producción a gran escala del pentacarbonilo de hierro por un proceso de Alwin Mittasch para procesar el hierro a alta pureza.

El trabajo de Walter Hieber contribuyó en los años posteriores a 1928 de forma decisiva al desarrollo de la química de los carbonilos metálicos. Descubrió, entre otras cosas, la reacción básica de Hieber, lo que llevó a la síntesis del primer hidruro de carbonilo metálico conocido y abrió nuevas síntesis a carbonilos metálicos como el decacarbonilo de direnio.[5]
También en la década de 1930 descubrió Walter Reppe, un químico industrial y miembro posterior de la placa de BASF, algunos procesos catalíticos homogéneos, tales como la hidrocarboxilación, que consiste en la reacción de alquenos (olefinas) y alquinos con monóxido de carbono y agua para obtener ácidos carboxílicos insaturados y derivados. En estas reacciones, se utilizan como catalizadores tetracarbonilo de níquel o carbonilo de cobalto.[6] La ciclotrimerización y tetramerización de acetileno y sus derivados produce con éxito benceno y derivados de benceno (en la ciclotrimerización) y ciclooctatetraeno y derivados de éste (de la ciclotetramerización) con los catalizadores de carbonilos metálicos de Reppe. BASF construyó en la década de 1960, una planta de producción de ácido acrílico por el proceso Reppe. Hasta 1996 era el método usado siendo desplazado por uno más moderno basado en la oxidación catalítica de propileno.
En 1938, Otto Roelen descubrió la síntesis de alcoholes grasos mediante hidroformilación catalítica homogénea. En este caso, alquenos (olefinas) se hacen reaccionar con monóxido de carbono e hidrógeno, usando carbonilos de cobalto, para obtener aldehídos y alcoholes. Por hidroformilación se obtienen varios millones de toneladas de diversos productos cada año.[7]
La sustitución de monóxido de carbono a través de ligandos a medida, tales como la trifenilfosfina, permitió la preparación de carbonilos metálicos mixtos, cuyas propiedades pueden adaptarse específicamente a las necesidades de los procesos técnicos. Los complejos de este tipo se utilizan en los procesos industriales, tales como el proceso de Monsanto para la producción industrial de ácido acético a partir de metanol y monóxido de carbono. En 2009, los médicos examinaron el uso de carbonilos metálicos en la terapia del cáncer, en el que por reducción del monóxido de carbono con un haz luz inducido, el CO es liberado para destruir células cancerosas de forma controlada.[8][9]
Síntesis
La síntesis de los carbonilos metálicos es objeto de una intensa investigación en la química organometálica. Desde el trabajo de Mond, y luego Hieber, se han desarrollado una gran cantidad de procedimientos para la preparación de estos compuestos.[10]
Síntesis directa
El tetracarbonilo de níquel y el pentacarbonilo de hierro se pueden preparar de acuerdo con las siguientes ecuaciones de reacción de metales finamente dividido con monóxido de carbono:[11]
Reducción de sales metálicas y óxidos
Algunos carbonilos metálicos se preparan por la reducción de haluros de metal en la presencia de altas presiones de monóxido de carbono. Se emplea una variedad de agentes reductores, incluyendo sodio, cobre, aluminio, hidrógeno, así como alquilos metálicos, tales como trietilaluminio. Ejemplos:
Formación de hexacarbonilo de cromo a partir de cloruro de cromo (III) anhidro en benceno con aluminio como agente reductor, y cloruro de aluminio como catalizador:[12]
Utilización de alquilos de metal como agentes reductores:
Wolframio, molibdeno, manganeso, y sales de rodio pueden reducirse con hidruro de litio y aluminio. El hexacarbonilo de vanadio se prepara con el sodio como agente reductor en disolventes quelantes tales como diglima:[13]
En disolución acuosa, las sales de níquel o cobalto pueden ser reducidas, por ejemplo, con ditionito de sodio. En presencia de monóxido de carbono, las sales de cobalto son convertidas cuantitativamente al estado de oxidación (-1) como anión tetracarbonilcobaltato (-I):[13]
Algunos carbonilos metálicos se preparan usando monóxido de carbono (CO) como agente reductor, ya que éste también es reductor, y se usa como tal en la obtención del hierro a partir de arrabio. De esta manera, Hieber y Fuchs prepararon por primera vez el decacarbonilo de renio a partir del óxido:[14]
Si se utilizan los óxidos de metal, se forma dióxido de carbono como producto de reacción. En la reducción de cloruros de metal con monóxido de carbono se suele formar fosgeno.[10]
Fotólisis y termólisis
9closeUp.png.webp)
La fotólisis o termólisis de carbonilos mononucleares (con un solo elemento metálico como elemento central) genera carbonilos binucleares y multimetálicos, como el nonacarbonilo de dihierro (Fe2(CO)9).[15][16] El calentamiento adicional provoca que se descomponga finalmente en el metal y monóxido de carbono.
Estructura y enlace

Los enlaces del monóxido de carbono (CO) a los metales de transición son sinérgicos. La unión tiene tres componentes, dando lugar a un triple enlace parcial. Se genera un enlace sigma por la superposición del par de electrones no enlazantes del orbital sp-híbrido del átomo de carbono del carbonilo con uno de los orbitales p vacíos del metal. Un par de enlaces π surgen de solapamiento entre orbitales d llenos del metal con un par de orbitales π-antienlazantes del carbono del CO. Este último tipo de unión requiere de que el metal tenga electrones en orbitales d, y que el metal se encuentre en un estado de oxidación relativamente bajo (<2) que hace que este proceso de retrodonación sea favorable. Como los electrones d del metal forman una interacción con el orbital π antienlazante del CO, se debilita el enlace carbono-oxígeno (en comparación con el monóxido de carbono libre), mientras que el enlace metal-carbono se fortalece. Debido al carácter de enlace múltiple de la unión M-CO, la distancia entre el metal y el carbono es relativamente corto, a menudo <1,8 Å, aproximadamente 0,2 Å más corto que un enlace alquil-metal.
Varias formas canónicas se pueden dibujar para describir los modos de enlace del carbonilo metálico.
Estructuras de carbonilos metálicos pequeños más importantes
Las estructuras de carbonilos metálicos se prevén principalmente con la TREPEV, el modelo de la teoría del enlace de valencia y la regla de los 18 electrones, en estructuras más complejas se utilizan otros métodos, como el principio isolobal, uno de los logros por los que recibió el Premio Nobel por su desarrollo el científico Roald Hoffmann. En su conferencia Nobel Premio Hoffmann destacó que la analogía isolobal es un modelo útil, pero simple, y en ciertos casos no conduce al éxito.[17]
Se forman más carbonilos metálicos con los metales de los periodos más altos que con los más bajos (en la tabla periódica), lo cual se puede explicar por la teoría del campo cristalino, la división de los orbitales de valencia del metal y la configuración de bajo espín asociada a estos complejos.
En la siguiente tabla se recogen los carbonilos metálicos binarios neutros sintetizados hasta la fecha de hoy:
| 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|
| V(CO)6 | Cr(CO)6 | Mn2(CO)10 | Fe(CO)5 Fe2(CO)9 Fe3(CO)12 | Co2(CO)8 Co4(CO)12 Co6(CO)16 | Ni(CO)4 |
| Nb | Mo(CO)6 | Tc2(CO)10 Tc3(CO)12 | Ru(CO)5 Ru3(CO)12 Ru6(CO)18 | Rh2(CO)8 Rh4(CO)12 Rh6(CO)16 | Pd |
| Ta | W(CO)6 | Re2(CO)10 | Os(CO)5 Ru3(CO)12 | Ir4(CO)12 Ir6(CO)16 | Pt |
| Carbonilo metálico | Color | Simetría | IR νCO (cm-1) | Nº elec. | Estructura |
|---|---|---|---|---|---|
| Ni(CO)4 Ir4(CO)12 | incoloro amarillo pálido | tetraédrico (Td) | 2057 - | 18 | 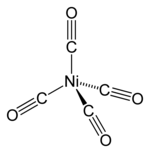 12.svg.png.webp) |
| V(CO)6 Cr(CO)6 Mo(CO)6 W(CO)6 | verde oscuro blanco blanco blanco | octaédrico (Oh) | 1976 2000 2004 1998 | 17 18 18 18 18 | 6.png.webp) |
| Fe(CO)5 Ru(CO)5 Os(CO)5 Fe2(CO)9 Ru3(CO)12 Os3(CO)12 | amarillo incoloro incoloro anaranjado anaranjado amarillo | bipirámide trigonal(D3h) | 2304 (s) 2013 (vs) 2035 (s) 1999 (vs) 2034 (s) 1991 (vs) 2082 (m) 2019 (2) 1829 (s) - - | 18 | 5.png.webp) |
| Mn2(CO)10 Tc2(CO)10 Re2(CO)10 | amarillo blanco blanco | D4d | 2044 (m) 2013 (s) 1983 (m) 2065 (m) 2017 (s) 1984 (m) 2070 (m) 2014 (s) 1976 (m) | 18 | 10.png.webp) |
| Co2(CO)8 Rh2(CO)8 Fe3(CO)12 | anaranjado - verde oscuro | C2v | - | 18 | |
| Co4(CO)12 Rh4(CO)12 | negro rojo | C3v | - | 18 | 12.png.webp) |
Carbonilos puente
El ligando carbonilo no solo puede actuar como ligando monodentado (que se une solo a un metal con un enlace simple), sino que puede actuar con una hapticidad mayor, en una gama de modos de enlace en dímeros y clusters. En el modo de puente más común, el ligando CO tiende un puente sobre un par de metales (CO-μ2). Este modo de unión se observa en los carbonilos metálicos comúnmente disponibles: Co2(CO)8, Fe2(CO)9, Fe3(CO)12, Co4(CO)12, etc.[18] En ciertos compuestos clusters de mayor número de átomos metálicos, se pueden tener puentes CO entre tres o incluso cuatro metales (estos ligandos se denotan μ3-CO y μ4-CO). Menos comunes son los modos de enlace en el que tanto átomo de carbono como el de oxígeno se enlazan al metal, por ejemplo, μ3-η2.

La espectroscopia infrarroja es una técnica sensible para la detección de ligandos puente carbonilo, que incluso puede llegar a diferenciar entre diferentes tipos de carbonilos según la hapticidad.
Características físicas
La mayoría de los carbonilos metálicos mononucleares (con un solo átomo metálico) son líquidos volátiles incoloros (o amarillo pálido) que son inflamables y tóxicos.[13] El hexacarbonilo de vanadio, el único carbonilo metálico de 17 electrones estable, es un sólido azul-negro. Los carbonilos di-y polimetálicos tienden a ser mucho más coloreados. El dodecacarbonilo de trihierro (Fe3(CO)12) forma cristales de color verde oscuro. Los carbonilos metálicos cristalinos a menudo son sublimables en vacío, a pesar de que este proceso es a menudo acompañado de la degradación del compuesto. Los carbonilos metálicos son solubles en disolventes orgánicos no polares y polares, tales como benceno, éter etílico, acetona, ácido acético glacial y tetracloruro de carbono. Algunas sales de carbonilos metálicos catiónicos y aniónicos son solubles en agua o alcoholes de bajo peso molecular.
Reactividad
Los carbonilos de metal son importantes precursores para la síntesis de otros complejos organometálicos.
Reacciones de sustitución
La sustitución en los complejos 18-electrones se produce a través de un mecanismo disociativo a través de un intermedio de 16-electrones. La sustitución puede ser inducida térmica o fotoquímicamente por ligandos dadores. La sustitución inducida fotoquímicamente excita un orbital antenlazante del complejo de la molécula al absorber un fotón de luz, de modo que el enlace metal-carbono es débil y el ligando se escinde (se rompe).[1] La gama de ligandos es grande, e incluye fosfinas, cianuros (CN-), dadores de nitrógeno, e incluso los éteres, especialmente quelantes. Las olefinas, especialmente diolefinas, son ligandos eficaces que ofrezcan derivados sintéticamente útiles.
La energía de disociación es de 105 kJ/mol para el tetracarbonilo de níquel y 155 kJ/mol para el hexacarbonilo de cromo.[1]
La sustitución en los complejos de 17-electrones, que son raros, el producida a través de un mecanismo asociativo con un intermedio de 19-electrones.
La velocidad de reacción para el mecanismo asociativo es mayor que el mecanismo disociativo en muchos casos. El hexacarbonilo de vanadio puede reaccionar por un factor de 1010 veces más rápido que el hexacarbonilo de tungsteno. Además, la velocidad de sustitución en los complejos 18 de electrones a veces se ve catalizada por cantidades catalíticas de oxidantes, a través de una transferencia de electrones.[19]
Por razones desconocidas todavía, la velocidad de sustitución más alta se da en el elemento central de cada grupo (Cr<Mo>W; Co<Rh>Ir; Ni<Pd>Pt)[1]
Reacciones de reducción
Algunos carbonilos metálicos reaccionan con agentes reductores tales como sodio metálico o amalgama de sodio para dar aniones carbonilmetalatos:
Para el pentacarbonilo de hierro, se obtiene el tetracarbonilferrato por pérdida de CO:
Reacciones de ataque nucleófilo al CO
El ligando CO es a menudo susceptible al ataque por nucleófilos. Por ejemplo, N-óxido de trimetilamina y bistrimetilsililamida convierten ligandos de CO a CO2 y CN-, respectivamente.
Reacción básica de Hieber
En la reacción básica de Hieber, el ion hidróxido (OH-) ataca al ligando CO (ataque nucleófilo al átomo de carbono carbonílico) para dar un ácido metalocarboxílico, seguido por la liberación de dióxido de carbono y la formación de hidruros metálicos o incluso carbonilmetalatos (carbonilos metálicos con carga formal negativa). Un ejemplo bien conocido de esta reacción de adición nucleófila es la conversión de pentacarbonilo de hierro al anión carbonilmetalato tetracarbonilferrato(-2):
En otro paso, se puede sintetizar hidruro de tetracarbonilhierro (II), un hidruro complejo que es muy sensible a la temperatura y al aire, que Walter Hieber descubrió en 1931. La protonación del anión hidruro da:
La reacción básica de Hieber hace que los hidruros de carbonilo metálicos, tales como el hidruro de tetracarbonilcobalto ((HCo(CO)4) sean accesibles.
Adición de un organolitiado a un M-CO
Reactivos de organolitio se adicionan a los carbonilos metálicos para producir aniones acilo de carbonilo metálico. La O-alquilación de estos aniones, por ejemplo, con sales de Meerwein (tetrafluoroboratos o trialquiloxonios), proporciona carbenos de Fischer:[1]
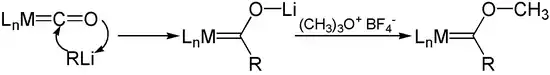
Un ejemplo es la reacción del hexacarbonilo de wolframio con un litiado en dietiléter seco que tras hacerlo reaccionar posteriormente con un tetrafluoroborato de trimetiloxonio da el carbeno de Fischer de la imagen:
Reacciones con electrófilos
A pesar de que los carbonilos de metal poseen estados de oxidación bajos, reaccionan con algunos electrófilos. Por ejemplo, se resisten al ataque por agentes alquilantes, ácidos suaves, agentes oxidantes suaves, pero la mayoría de los carbonilos metálicos suelen reaccionar con halógenos. Suele tratarse de una reacción de descarbonilación oxidativa. El pentacarbonilo de hierro, por ejemplo, forma halogenuros de carbonilo ferrosos:
Enlaces metal-metal se escinden por halógenos sin necesidad de producirse la eliminación de CO, aunque si se calienta, se produce una reacción de dimerización:
Reacciones de inserción
Compuestos insaturados, o mercurio, se pueden insertar en el enlace metal-metal de ciertos carbonilos metálicos polinucleares. Un ejemplo:
Aplicaciones y usos
Usos en metalurgia
Los carbonilos de metal se utilizan en diversos procesos industriales. Tal vez la primera aplicación fue para la extracción y purificación de níquel a través de tetracarbonilo de níquel por el proceso Mond. Por un proceso similar se produce el carbonilo de hierro, un polvo de metal de alta pureza que se prepara por descomposición térmica del pentacarbonilo de hierro. Este compuesto tiene diversos usos industriales.
Hidroformilación
Otto Roelen descubrió en 1938 la hidroformilación. Se utiliza para la síntesis a gran escala de alcoholes de cadena larga, también llamados alcoholes grasos (del inglés: fatty alcohols), para ser utilizados en la fabricación de detergentes. Hoy en día, varios millones de toneladas de productos-oxo se producen a través de este proceso. La hidroformilación es uno de los procesos más eficientes por su economía atómica, especialmente si la reacción procede con alta regioselectividad.
En el proceso oxo, una olefina, dihidrógeno, y monóxido de carbono reaccionan junto con un catalizador (por ejemplo el octacarbonilo de dicobalto) para dar aldehídos. Muy ilustrativa es la producción de butiraldehído:
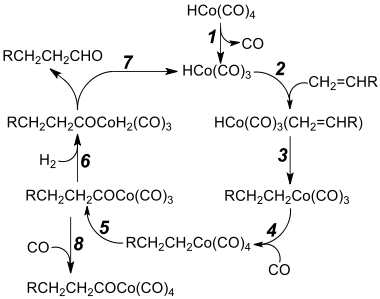
El butiraldehído se convierte a escala industrial a 2-etil-hexanol, un precursor de los plastificantes del PVC, por condensación del aldol, seguido de la hidrogenación del hidroxialdehído resultante.
Los carbonilos de rodio mixtos son más activos, y desplazaron a los carbonilos de cobalto utilizados originalmente en el proceso oxo.
Reppe trabajó con acetileno bajo presión con carbonilos metálicos, alcoholes y agua[20] consiguiendo la producción de ácido acrílico y acrilatos:
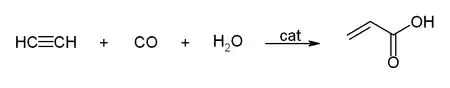
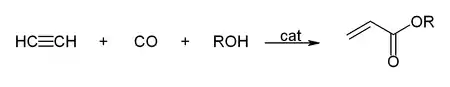
Ciclomerizaciones
La ciclomerización consiste en la ciclación de un compuesto a partir de unos bloques estructurales idénticos. Por ejemplo, la cicloadición 2+2 es una ciclodimerización que consiste en la unión de dos alquenos por cicloadición fotoquímica para formar un ciclobutano.
Reppe consiguió la producción de benceno y ciclooctatetraeno utilizando carbonilos de metal como catalizadores por reacciones de ciclotrimerización y ciclotetramerización respectivamente:[21]
 y
y
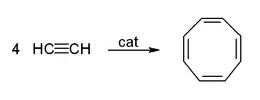
Otras aplicaciones
| Catalizador | Aplicación catalítica |
|---|---|
| cis-[Rh(CO)2I2]- | Proceso Monsanto |
| HCo(CO)4 | Hidroformilación, isomerización de alquenos |
| HRh(CO)4 | Hidroformilación (solo para algunos alquenos ramificados) |
| HRh(CO)(PPh3)3 | Hidroformilación |
| [Ru(CO)2I3]- | Homologación de ácidos carboxílicos |
| [HFe(CO)4]- | Reacción de desplazamiento del gas de agua (Water-gas shift reaction, en inglés) |
Referencias
- Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 3-527-29390-6
- Mond, L.; Langer, C.; Quincke, F. (1890). «Action of Carbon Monoxide on Nickel». Journal of the Chemical Society, Transactions 57: 749-753. doi:10.1039/CT8905700749.
- L. Mond, H. Hirtz, M. D. Cowap: Note on a Volatile Compound of Cobalt With Carbon Monoxide. In: Chem. News. vol. 98, 1908, S. 165; Chem. Abs. vol. 2, 1908, S. 3315.
- J. Dewar, H. O. Jones: The Physical and Chemical Properties of Iron Carbonyl. In: Proc. R. Soc. Lond. A. 6. Dezember 1905, 76, doi 10.1098/rspa.1905.0063, S. 558–577.
- F. Basolo. From Coello to inorganic chemistry: a lifetime of reactions.. p. 101. ISBN 9780306467745.
- R. A. Sheldon. Chemicals from synthesis gas: catalytic reactions of CO and H2 2. p. 106. ISBN 9789027714893.
- Dirk Steinborn. Grundlagen der metallorganischen Komplexkatalyse. p. 83. ISBN 9783834805812.
- Hendrik Pfeiffer, Alfonso Rojas, Johanna Niesel, Ulrich Schatzschneider: Sonogashira and "Click" reactions in the N-terminal and side chain functionalization of peptides with [Mn(CO)3(tpm)]+-based CO releasing molecules (tpm = tris(pyrazolyl)methane. In: Dalton Trans. 2009, doi 10.1039/b819091g.
- P. Gasser, u. a.: Synthesis and characterisation of hetero-bimetallic organometallic phenylalanine and PNA monomer derivatives. In: Dalton Trans. 2009, doi 10.1039/b819169g.
- Herrmann, W. A. (1988). «100 Jahre Metallcarbonyle. Eine Zufallsentdeckung macht Geschichte». Chemie in unserer Zeit 22 (4): 113-122. doi:10.1002/ciuz.19880220402.
- Huheey, J.; Keiter, E.; Keiter, R. (1995). «Metallcarbonyle». Anorganische Chemie (2nd edición). Berlin / New York: de Gruyter.
- Ernst Otto Fischer, Walter Hafner, Karl Öfele: „Über Aromatenkomplexe von Metallen, XXXI. Eine Synthese für Chromhexacarbonyl“, Chemische Berichte, Volume 92, Issue 12, S. 3050–3052, Dezember 1959; doi 10.1002/cber.19590921207.
- Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd edición). Berlin: de Gruyter. pp. 1780–1822. ISBN 978-3-11-017770-1.
- Hieber, W.; Fuchs, H. (1941). «Über Metallcarbonyle. XXXVIII. Über Rheniumpentacarbonyl». Zeitschrift für Anorganische und Allgemeine Chemie 248 (3): 256-268. doi:10.1002/zaac.19412480304.
- King, R. B. (1965). Transition-Metal Compounds 1. Nueva York: Academic Press. ISBN 0-444-42607-8.
- Braye, E. H.; Hübel, W.; Rausch, M. D.; Wallace, T. M. (1966). «Diiron Enneacarbonyl». Inorganic Syntheses 8: 178-181. ISBN 978-0-470-13239-5. doi:10.1002/9780470132395.ch46.
- R. Hoffmann: Building Bridges between Inorganic and Organic Chemistry (PDF-Datei; 307 kB), Nobel lecture, 8. December 1981.
- Dyson, P. J.; McIndoe, J. S. (2000). Transition Metal Carbonyl Cluster Chemistry. Amsterdam: Gordon & Breach. ISBN 90-5699-289-9.
- Ohst, H. H.; Kochi, J. K. (1986). «Electron-Transfer Catalysis of Ligand Substitution in Triiron Clusters». Journal of the American Chemical Society 108 (11): 2897-2908. doi:10.1021/ja00271a019.
- A. Gossauer: Struktur und Reaktivität der Biomoleküle. Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 155.
- Günther Wilke: Organo Transition Metal Compounds as Intermediates in Homogenous Catalytic Reactions (PDF-File; 381 kB).
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Carbonilo de metal.
Wikimedia Commons alberga una categoría multimedia sobre Carbonilo de metal.- metal carbonyls at Louisiana State University

