Sublimación
Sublimación es la transición de una sustancia que pasa directamente del estado sólido al estado gaseoso.[1] sin pasar por el estado líquido.[2] La sublimación es un proceso endotérmico que se produce a temperaturas y presiones inferiores al punto triple de una sustancia en su diagrama de fases, que corresponde a la presión más baja a la que la sustancia puede existir como líquido. El proceso inverso a la sublimación es la deposición, desublimación o sublimación inversa, en la que una sustancia pasa directamente de una fase gaseosa a una sólida.[3] La sublimación también se ha utilizado como término genérico para describir una transición de sólido a gas (sublimación) seguida de una transición de gas a sólido (deposición). Mientras que la vaporización de líquido a gas se produce como evaporación desde la superficie si se produce por debajo del punto de ebullición del líquido, y como ebullición con formación de burbujas en el interior del líquido si se produce en el punto de ebullición, no existe tal distinción para la transición de sólido a gas que siempre se produce como sublimación desde la superficie.

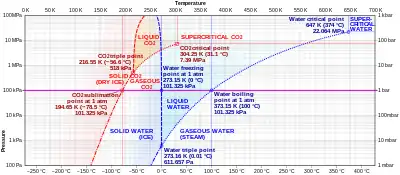
En condiciones normalizadas de presión y temperatura, la mayoría de los compuestos químicos y elementos poseen tres estados diferentes a distintas temperaturas. En estos casos, la transición del estado sólido al estado gaseoso requiere un estado líquido intermedio. La presión a la que se hace referencia es la presión parcial de la sustancia, no la presión total (por ejemplo, la atmosférica) de todo el sistema. Así, todos los sólidos que poseen una presión de vapor apreciable a una determinada temperatura suelen poder sublimarse en el aire (por ejemplo, el hielo de agua justo por debajo de 0 °C). Para algunas sustancias, como el carbono y el arsénico, la sublimación es mucho más fácil que la evaporación de la masa fundida, porque la presión de su punto triple es muy alta, y es difícil obtenerlas como líquidos.
El término sublimación se refiere a un cambio físico de estado y no se utiliza para describir la transformación de un sólido en un gas en una reacción química. Por ejemplo, la disociación al calentar el cloruro de amonio sólido en cloruro de hidrógeno y amoníaco no es una sublimación, sino una reacción química. Del mismo modo, la combustión de velas que contienen cera de parafina en dióxido de carbono y vapor de agua no es una sublimación, sino una reacción química con el oxígeno.
La sublimación se produce por la absorción de calor que proporciona la energía suficiente para que algunas moléculas superen la fuerzas de atracción de sus vecinas y escapen a la fase de vapor. Como el proceso requiere energía adicional, es un cambio endotérmico. La entalpía de sublimación (también llamada calor de sublimación) se puede calcular sumando la entalpía de fusión y la entalpía de vaporización.
Ejemplos
Dióxido de carbono
.jpg.webp)
El dióxido de carbono sólido (hielo seco) sublima en todas partes a lo largo de la línea por debajo del punto triple (por ejemplo a la temperatura de -78,5 °C (194,65 K, −109,3 °F) a presión atmosférica, mientras que su fusión en CO2 líquido puede ocurrir a lo largo de la línea sólido-líquido a presiones y temperaturas por encima del punto triple (es decir, 5,1 atm, -56,6 °C.
Agua
Nieve y hielo subliman, aunque más lentamente, a temperaturas por debajo de la línea de temperatura de congelación/punto de fusión a 0 °C para presiones parciales por debajo de la presión del punto triple de 612 Pa (0.00604 atm).[4] En la liofilización, el material a deshidratar se congela y se deja que su agua se sublime a presión reducida o al vacío. La pérdida de nieve de un campo de nieve durante una ola de frío suele deberse a que los rayos del sol actúan directamente sobre las capas superiores de la nieve. La ablación es un proceso que incluye la sublimación y el desgaste erosivo del hielo glaciar.
Naftaleno
El naftaleno, un compuesto orgánico que se encuentra comúnmente en pesticidas como la naftalina, sublima fácilmente porque está formado por moléculas no polares que se mantienen unidas sólo por fuerzas intermoleculares de van der Waals. El naftaleno es un sólido que sublima en temperatura atmosférica estándar.[5] con el punto de sublimación en torno a 80 °C o 176 °F.[6] A baja temperatura, su presión de vapor es suficientemente alta, 1 mmHg a 53 °C,[7] para que la forma sólida del naftaleno se evapore y se convierta en gas. En superficies frías, los vapores de naftalina se solidifican formando cristales en forma de aguja.


Otras sustancias
.
El yodo produce vapores al calentarlo suavemente, aunque se encuentra por encima del punto triple y, por tanto, no es una verdadera sublimación. Es posible obtener yodo líquido a presión atmosférica controlando la temperatura justo por encima del punto de fusión del yodo. En ciencia forense, el vapor de yodo puede revelar huellas dactilares latentes en papel.[8]
El arsénico también puede sublimarse a altas temperaturas.
El cadmio y el cinc no son materiales para uso en vacío adecuados porque subliman mucho más que otros materiales comunes.
El ciclo del agua y la sublimación
El agua puede encontrarse fundamentalmente en tres estados: sólida, líquida y gaseosa. El agua en la Tierra constituye la hidrosfera, y se distribuye en tres tipos de reservas o compartimentos esenciales, particularmente dentro del medio ecológico, los océanos, los continentes y la atmósfera, entre los que existe una continua circulación que configura el ciclo hidrológico. El ciclo hidrológico es mantenido por la radiación del sol, que proporciona la energía, y la fuerza gravitatoria, que condiciona y orienta la circulación.
Por medio de esta secuencia de fenómenos, el agua de la superficie terrestre pasa como vapor a la atmósfera, y regresa a sus fases líquida y sólida a través de las diversas formas de precipitación. El agua pasa al estado de vapor, no solo por la evaporación directa y la transpiración de las plantas y animales, sino por sublimación (paso directo del agua sólida a vapor de agua).
El fenómeno de sublimación regresiva o inversa (deposición)
Es el proceso inverso a la sublimación progresiva, es decir, el paso directo de gas a sólido. Por ejemplo, cuando se producen vapores al calentarse cristales de yodo y luego se pone sobre ellos un objeto que está muy frío; entonces, los vapores se transformarán nuevamente en cristales de yodo. Históricamente la palabra sublimado se refirió a las sustancias formadas por deposición a partir de «vapores» (gases), como el «sublimado corrosivo», cloruro mercúrico, formado por alteración de los calomelanos cristalizado obtenido durante las operaciones alquímicas.
Cualquier sustancia pura puede sublimarse, esto es debido a condiciones de presiones superiores y temperaturas inferiores a la que se produce dicha transición. En la naturaleza la sublimación inversa se observa en la formación de la nieve o de la escarcha. Las partículas partiendo de las cuales se produce la acreción o acrecimiento planetario, se forman por sublimación inversa a partir de compuestos en estado gaseoso originados en supernovas.
Predicciones de la sublimación
La entalpía de sublimación se ha predicho comúnmente utilizando el teorema de equipartición. Si se supone que la energía de red es aproximadamente la mitad de la energía de empaquetamiento, entonces se pueden aplicar las siguientes correcciones termodinámicas para predecir la entalpía de sublimación. Suponiendo una concentración de 1 molar gas ideal da una corrección para el entorno termodinámico (presión y volumen) en el que pV = RT, por lo tanto una corrección de 1RT. Luego hay que aplicar correcciones adicionales para la vibraciones, el rotaciones y la traslación. A partir del teorema de equipartición la rotación y la traslación gaseosas contribuyen con 1,5RT cada una al estado final, por lo tanto una corrección de +3RT. Las vibraciones y rotaciones cristalinas contribuyen con 3RT cada una al estado inicial, por lo tanto -6RT. Sumando las correcciones RT; -6RT + 3RT + RT = -2RT.[9] Esto conduce a la siguiente entalpía de sublimación aproximada. Se puede encontrar una aproximación similar para el término de entropía si se suponen cuerpos rígidos.[10][11]
Purificación por sublimación

La sublimación es una técnica utilizada por los químicos para purificar compuestos. Normalmente se coloca un sólido en un aparato de sublimación y se calienta al vacío. Bajo esta presión reducida, el sólido se volatiliza y se condensa como un compuesto purificado en una superficie enfriada (dedo frío), dejando un residuo no volátil de impurezas. Una vez que cesa el calentamiento y se elimina el vacío, el compuesto purificado puede recogerse de la superficie enfriada.[12][13] Para obtener eficiencias de purificación aún mayores, se aplica un gradiente de temperatura, que también permite la separación de diferentes fracciones. Las configuraciones típicas utilizan un tubo de vidrio evacuado que se calienta gradualmente de forma controlada. El flujo de material va desde el extremo caliente, donde se coloca el material inicial, hasta el extremo frío que está conectado a un soporte de bomba. Al controlar las temperaturas a lo largo del tubo, el operador puede controlar las zonas de recondensación, con compuestos muy volátiles que se bombean fuera del sistema completamente (o se capturan en una trampa fría separada), compuestos moderadamente volátiles que se recondensan a lo largo del tubo según sus diferentes volatilidades, y compuestos no volátiles que permanecen en el extremo caliente.
La sublimación al vacío de este tipo es también el método de elección para la purificación de compuestos orgánicos para su uso en la industria de la electrónica orgánica, donde se necesitan purezas muy altas (a menudo >99,99 %) para satisfacer las normas de la electrónica de consumo y otras aplicaciones.
Impresión por sublimación
La impresión por sublimación es una tecnología de impresión digital que utiliza material gráfico a todo color y que funciona con sustratos recubiertos de poliéster y polímeros. Este proceso, también conocido como sublimación digital, se utiliza habitualmente para decorar prendas de vestir, carteles y pancartas, así como artículos novedosos como fundas para teléfonos móviles, placas, tazas de café y otros artículos con superficies aptas para la sublimación. El proceso utiliza el proceso de sublimación, en el que el calor y la presión se aplican a un sólido, convirtiéndolo en un gas a través de una reacción endotérmica sin pasar por la fase líquida.[14]
En la impresión por sublimación, se transfieren tintes de sublimación únicos a hojas de papel «de transferencia» mediante tinta líquida en gel a través de un cabezal de impresión piezoeléctrico. La tinta se deposita en estos papeles de inyección de tinta de alta liberación, que se utilizan para el siguiente paso del proceso de impresión por sublimación. Después de imprimir el diseño digital en las hojas de transferencia de sublimación, se coloca en una prensa térmica junto con el sustrato que se va a sublimar.
Para transferir la imagen del papel al sustrato, se requiere un proceso de prensa térmica que es una combinación de tiempo, temperatura y presión. La prensa térmica aplica esta combinación especial, que puede cambiar dependiendo del sustrato, para «transferir» los tintes de sublimación a nivel molecular al sustrato. Los tintes más comunes utilizados para la sublimación se activan a 176 °C. Sin embargo, normalmente se recomienda un rango de 193 a 216 °C para obtener un color óptimo.
El resultado final del proceso de sublimación es una impresión casi permanente, de alta resolución y a todo color. Dado que los tintes se infunden en el sustrato a nivel molecular, en lugar de aplicarse a nivel tópico (como ocurre con la serigrafía y la impresión directa sobre la prenda), las impresiones no se agrietan, destiñen ni se desprenden del sustrato en condiciones normales.
A diferencia de las impresiones de inyección de tinta que cuentan con resoluciones de tonos continuos de solo 300 ppp, las impresoras de sublimación de tinta pueden lograr una resolución de hasta 9600 × 2400 ppp. La diferencia radica en que la tecnología inkjet solamente reproduce por efecto óptico un punto del color deseado mientras que en la impresión por sublimación se consigue cualquier color imprimiendo un único punto físico. Más precisamente, una impresora de inyección de tinta o láser proporciona solamente 2 tonos por imprimación; si se quiere simular un tono continuo, es decir por ejemplo 256 niveles por primario (valor considerado mínimo por los profesionales), este tipo de impresoras tendrá que imprimir entre 0 y 256 puntos físicos (por lo tanto un cuadrado de 16×16) que representarán en conjunto un único punto de tono continuo; en este caso la resolución dada por el fabricante se debe dividir por 16 para poder compararla con la resolución de una impresora de sublimación térmica. Este engaño óptico, utilizado por impresoras de inyección de tinta o láser, a veces es visible a simple vista, en forma de marco o puntos visibles; un defecto ausente en las impresiones por sublimación de tinta.
Además, las fotos obtenidas por sublimación no sufren ningún tipo de emborronamiento, el paso directo de la cera del estado sólido al estado gaseoso y luego, al contrario, del estado gaseoso al sólido, permite evitar este problema. Único inconveniente de esta tecnología: la imposibilidad de obtener un negro claro. El color negro se obtiene superponiendo los tres colores en máxima densidad. Por lo tanto, este tipo de impresión no es adecuado para la impresión en blanco y negro. Además, el precio de coste es muy elevado, el coste de una página A4 bajó en la década de 2010 de 2 a 3 €, y esto independientemente del contenido de color de la página a imprimir: de hecho, con cada impresión, una longitud igual al de la hoja se desenrolla de los tres rollos de cinta encerada.
Véase también
Referencias
- Merriam-Webster: Sublimar
- Whitten, Kenneth W.; Gailey, Kenneth D.; Davis, Raymond E. (1992). Química general (4.ª edición). Saunders College Publishing. p. org/details/generalchemistry00whit_0/page/475. ISBN 0-03-072373-6.
- Boreyko, Jonathan B.; Hansen, Ryan R.; Murphy, Kevin R.; Nath, Saurabh; Retterer, Scott T.; Collier, C. Patrick (2016). «Controlando la condensación y el crecimiento de la escarcha con micropatrones químicos». Scientific Reports 6: 19131. Bibcode:619131B 2016NatSR... 619131B. PMC 4726256. PMID 26796663. doi:10.1038/srep19131.
- Fassnacht, S. R. (2004). «Estimación de la subcaptación de nieve con manómetro Alter-shielded, sublimación del manto nivoso y transporte de nieve soplada en seis lugares de los EE.UU. coterráneos». Hydrol. Process 18 (18): 3481-3492. Bibcode:2004HyPr...18.3481F. S2CID 129927018.
- Caroll, J. (2014). Natural Gas Hydrates. p. 16. ISBN 9780128005750.
- Staff writer(s) (2015). «what solid go through sublimation?». National Science Foundation and UCSB School-University partnership. Consultado el 13 de noviembre de 2015.
- Pavia, D. (2005). Introduction to organic laboratory technique. pp. 781–782. ISBN 978-0534408336.
- Girard, James (2011). Criminalistics: Forensic Science, Crime and Terrorism. Jones & Bartlett Learning. pp. 143–144. ISBN 978-0-7637-7731-9.
- Gavezzotti, A. (1997). Aspectos teóricos y modelización informática del estado sólido molecular. Chichester: Wiley and Sons.
- McDonagh, J. L.; Nath; De Ferrari, Luna; Van Mourik, Tanja; Mitchell, John B. O. (2014). «Uniting Cheminformatics and Chemical Theory To Predict the Intrinsic Aqueous Solubility of Crystalline Druglike Molecules». Journal of Chemical Information and Modeling 54 (3): 844-56. PMC 3965570. PMID 24564264.
- McDonagh, James; Palmer, David S.; Van Mourik, Tanja; Mitchell, John B. O. (17 de octubre de 2016). «¿Son predecibles las termodinámicas de sublimación de las moléculas orgánicas?». Journal of Chemical Information and Modeling 56 (11): 2162-2179. ISSN 1549-9596. PMID 27749062.
- R. B. King Organometallic Syntheses. Volume 1 Transition-Metal Compounds; Academic Press: Nueva York, 1965. ISBN 0-444-42607-8.
- Harwood, Laurence M.; Moody, Christopher J. (1989). Química orgánica experimental: Principios y práctica (Ilustrada edición). WileyBlackwell. pp. 154-155. ISBN 978-0-632-02017-1.
- J A G Drake. Chemical technology in Printing and Imaging Systems, 1993, pp. 73-85.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre sublimación.
Wikcionario tiene definiciones y otra información sobre sublimación.- El Diccionario de la Real Academia Española tiene una definición para sublimación.
