Ditionito de sodio
El ditionito de sodio (también llamado hidrosulfito de sodio) es un polvo cristalino blanco con un olor sulfuroso débil. Aunque es estable en ausencia de aire, se descompone en agua caliente y en soluciones ácidas.
| Ditionito de sodio | ||
|---|---|---|
 | ||
 | ||
| General | ||
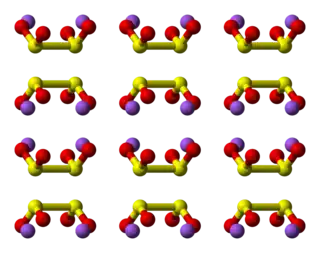
| Fórmula estructural |
| |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7775-14-6[1] | |
| Número RTECS | JP2100000 | |
| ChEBI | 66870 | |
| ChEMBL | CHEMBL3410462 | |
| ChemSpider | 22897 | |
| PubChem | 24489 | |
| UNII | 2K5B8F6ES1 | |
| Propiedades físicas | ||
| Masa molar | 173,903 g/mol | |
Estructura
La estructura ha sido examinada por espectroscopia Raman y difracción de rayos X monocristalino. El dianión ditionito tiene simetría C
2, casi eclipsada con un ángulo de torsión O-S-S-O de 16°. En forma dihidratada (Na
2S
2O
4·2H
2O) el anión ditionito tiene O-S-S-O torsional forma un ángulo de 56 °.[2]
Un enlace S-S débil está dado por la distancia de 239 pm, que se alarga en ca. 30 pm en relación con un bono SS típico. Debido a que este enlace es débil, el anión ditionito se disocia en solución en los iones [SO 2 ] -, como ha sido confirmado por espectroscopía EPR . También se observa que el 35 S sufre un intercambio rápido entre S2O42− y SO2 en solución neutra o ácida, consistente con el enlace S-S débil en el anión.[3]
Preparación
El ditionito de sodio se produce industrialmente mediante la reducción del dióxido de azufre. En 1990 se produjeron aproximadamente 300.000 toneladas.[4] La reacción con zinc en polvo es un proceso de dos pasos:
- 2 SO 2 + Zn → ZnS 2 O 4
- ZnS 2 O 4 + 2 NaOH → Na 2 S 2 O 4 + Zn (OH) 2
El método del borohidruro de sodio obedece a la siguiente estequiometría:
- NaBH 4 + 8 NaOH + 8 SO 2 → 4 Na 2 S 2 O 4 + NaBO 2 + 6 H 2 O
Cada equivalente de H- reduce dos equivalentes de dióxido de azufre. El formiato también se ha utilizado como reductor.
Propiedades y reacciones
Hidrólisis
El hidrosulfito de sodio es estable cuando está seco, pero las soluciones acuosas se deterioran debido a la siguiente reacción:
- 2 S2 O4 2− + H2 O → S2 O3 2− + 2 HSO3 -
Este comportamiento es consistente con la inestabilidad del ácido ditionoso . Por lo tanto, las soluciones de ditionito de sodio no se pueden almacenar durante un período de tiempo prolongado.[3]
El ditionito de sodio anhidro se descompone en sulfato de sodio y dióxido de azufre por encima de 90 °C en el aire. En ausencia de aire, se descompone rápidamente por encima de 150 °C a sulfito de sodio, tiosulfato de sodio, dióxido de azufre y trazas de azufre.
Reacciones redox
El ditionito de sodio es un agente reductor. A pH = 7, el potencial es de -0,66 V frente a NHE. La redox ocurre con la formación de sulfito:[5]
- S2O42- + 2 H2O → 2 HSO3- + 2 e- + 2 H+
El ditionito de sodio reacciona con el oxígeno:
- Na2S2O4 + O2 + H2O → NaHSO 4 + NaHSO3
Estas reacciones exhiben equilibrios complejos dependientes del pH que involucran bisulfito, tiosulfato y dióxido de azufre.
Con carbonilos orgánicos
En presencia de aldehídos, el ditionito de sodio reacciona para formar α-hidroxisulfinatos a temperatura ambiente, o para reducir el aldehído al alcohol correspondiente por encima de una temperatura de 85 °C.[6] [7] Algunas cetonas también se reducen en condiciones similares.
Aplicaciones
Industria
Al ser soluble en agua, el ditionito de sodio se utiliza como agente reductor en algunos procesos industriales de teñido. En el caso de tintes de azufre y tintes de tina, un tinte de otro modo insoluble en agua se puede reducir a una sal de metal alcalino soluble en agua (por ejemplo, tinte índigo ).[8]
El ditionito de sodio también se puede utilizar para el tratamiento de agua, purificación de gases, limpieza y decapado. También se ha aplicado como agente sulfonante. Además de la industria textil, este compuesto se utiliza en industrias relacionadas con el cuero, alimentos, polímeros, fotografía y muchas otras, a menudo como agente decolorante. Incluso se utiliza domésticamente como agente decolorante para ropa blanca, cuando se ha manchado accidentalmente por medio de un artículo teñido que se desliza en el ciclo de lavado a alta temperatura. Por lo general, está disponible en sobres de 5 gramos denominados hidrosulfito,dado por el nombre anticuado de la sal.
Laboratorio
El ditionito de sodio se utiliza a menudo en experimentos de fisiología como un medio para reducir el potencial redox de las soluciones (E o ' -0,66 V frente a SHE a pH 7).[9] El ferricianuro de potasio se usa generalmente como un químico oxidante en tales experimentos (E o ' ~ .436 V a pH 7). Además, el ditionito de sodio se usa a menudo en experimentos de química del suelo para determinar la cantidad de hierro que no se incorpora en los minerales de silicato primarios. Por lo tanto, el hierro extraído por el ditionito de sodio también se conoce como "hierro libre". La fuerte afinidad del ion ditionito por los cationes metálicos bivalentes y trivalentes (M 2+, M 3+ ) le permite mejorar la solubilidad del hierro y, por lo tanto, el ditionito es un agente quelante útil.
Se usaron soluciones acuosas de ditionito de sodio para producir "solución de Fieser" para la eliminación de oxígeno de una corriente de gas.[10] La piritiona se puede preparar en una síntesis de dos etapas a partir de 2-bromopiridina por oxidación al N -óxido con un perácido adecuado seguido de sustitución usando ditionito de sodio para introducir el grupo funcional tiol .[11]
Fotografía
Se utiliza en el revelador de nebulización Kodak, FD-70. Esto se usa en el segundo paso en el procesamiento de imágenes positivas en blanco y negro, para hacer diapositivas. Es parte del equipo de revelado de película positiva directa de Kodak .[12]
Seguridad
El amplio uso de ditionito de sodio se atribuye en parte a su baja toxicidad LD50 a 2,5 g / kg (ratas, oral).[4]
Véase también
- Ditionita
Referencias
- Número CAS
- Weinrach, J. B.; Meyer, D. R.; Guy, J. T.; Michalski, P. E.; Carter, K. L.; Grubisha, D. S.; Bennett, D. W. (1992). «A structural study of sodium dithionite and its ephemeral dihydrate: A new conformation for the dithionite ion». Journal of Crystallographic and Spectroscopic Research 22 (3): 291-301. doi:10.1007/BF01199531.
- Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- José Jiménez Barberá; Adolf Metzger; Manfred Wolf (15 de junio de 2000). «Sulfites, Thiosulfates, and Dithionites». Ullmann's Encyclopedia of Industrial Chemistry. Wiley Online Library. ISBN 978-3527306732. doi:10.1002/14356007.a25_477.
- Mayhew, S. G. (2008). «The Redox Potential of Dithionite and SO−2 from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase». European Journal of Biochemistry 85 (2): 535-547. PMID 648533. doi:10.1111/j.1432-1033.1978.tb12269.x.
- J. Org. Chem., 1980, 45 (21), pp 4126–4129, http://pubs.acs.org/doi/abs/10.1021/jo01309a011
- «Aldehyde sulfoxylate systemic fungicides». google.com. Archivado desde el original el 27 de abril de 2018. Consultado el 27 de abril de 2018.
- Božič, Mojca; Kokol, Vanja (2008). «Ecological alternatives to the reduction and oxidation processes in dyeing with vat and sulphur dyes». Dyes and Pigments 76 (2): 299-309. doi:10.1016/j.dyepig.2006.05.041.
- MAYHEW, Stephen G. (1978). «The Redox Potential of Dithionite and SO-2 from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase». European Journal of Biochemistry 85 (2): 535-547. ISSN 0014-2956. PMID 648533. doi:10.1111/j.1432-1033.1978.tb12269.x.
- Kenneth L. Williamson "Reduction of Indigo: Sodium Hydrosulfite as a Reducing Agent" J. Chem. Educ., 1989, volume 66, p 359. doi 10.1021/ed066p359.2
- Knight, David W. (15 de septiembre de 2006). 1-Hydroxypyridine-2(1H)-thione. «1-Hydroxypyridine-2(1H)-thione». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. ISBN 978-0471936237. doi:10.1002/047084289X.rh067.pub2.
- «Kodak Direct Positive Film 5246». 125px.com. Kodak. Consultado el 6 de noviembre de 2019.
Enlaces externos
- Ditionito de sodio - ipcs inchem [1]
- «Sodium dithionite - ipcs inchem». www.inchem.org. Berliln, Germany. 2004. Archivado desde el original el 17 de abril de 2018. Consultado el 15 de junio de 2018.