Oripavina
La oripavina es un opiáceo y el principal metabolito de la tebaína. Es el compuesto de origen del que se derivan una serie de opioides semisintéticos, que incluye los compuestos etorfina y buprenorfina. Aunque su potencia analgésica es comparable a la morfina, no se usa clínicamente debido a su grave toxicidad y bajo índice terapéutico. Debido a su uso en la fabricación de opioides fuertes, la oripavina es una sustancia controlada en algunas jurisdicciones.
| Oripavina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 6,7,8,14-Tetradehidro-4,5α-epoxi-6-metoxi-17-metilmorfinan-3-ol | ||
| General | ||
| Otros nombres | 3-O-demetil-tebaína | |
| Fórmula molecular | C18H19NO3 | |
| Identificadores | ||
| Número CAS | 467-04-9[1] | |
| ChEMBL | 437602 | |
| ChemSpider | 4575366 | |
| PubChem | 5462306 | |
| UNII | 575AOU51CR | |
| KEGG | C06175 | |
|
OC1=C(O[C@H]2C(OC)=CC=C3[C@@]42CCN5C)C4=C(C[C@H]35)C=C1
| ||
Propiedades farmacológicas
Las oripavina posee una potencia analgésica comparable a la morfina; sin embargo, no es clínicamente útil debido a una toxicidad grave y un bajo índice terapéutico. Tanto en ratones como en ratas, las dosis tóxicas causaron convulsiones tónico-clónicas seguidas de muerte, similar a la tebaína.[2] La oripavina tiene un potencial de dependencia que es significativamente mayor que el de la tebaína pero ligeramente menor que el de la morfina.[3]
Derivados puenteados
De mayor relevancia son las propiedades de los orvinoles, una gran familia de derivados semisintéticos clásicos de la oripavina sintetizados por la reacción Diels-Alder de la tebaína con un dienófilo adecuado, seguido de desmetilación en 3-O al correspondiente oripavine con puente. Estos compuestos fueron desarrollados por el grupo liderado por KW Bentley en la década de 1960, y estos compuestos de Bentley representan la primera serie de agonistas μ-opioides "super-potentes", con algunos compuestos en la serie que son más de 10,000 veces la potencia de la morfina como un analgésico.[4][5][6] El compuesto original de oripavina con puente simple 6,14-endoetenotetrahidrooripavina ya es 40 veces más potente que la morfina,[7] pero agregar un sustituyente de alcohol terciario ramificado en la posición C7 da como resultado una amplia gama de compuestos altamente potentes.[8]
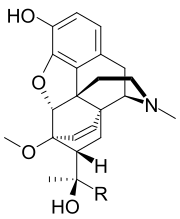
| Nombre de la droga | R | Potencia analgésica (Morfina = 1) |
|---|---|---|
| isobutil | 10 | |
| fenil | 34 | |
| n-hexil | 58 | |
| metil | 63 | |
| ciclopentil | 70 | |
| 7-PET | fenetil | 300 |
| etil | 330 | |
| Etorfina | n-propil | 3200 |
| ciclohexil | 3400 | |
| n-pentil | 4500 | |
| n-butil | 5200 | |
| isopentil | 9200 | |
Estado legal
Debido a la relativa facilidad de la modificación sintética de la oripavina para producir otros narcóticos (ya sea por vía directa o indirecta a través de tebaína), el Comité de Expertos en Drogodependencia de la Organización Mundial de la Salud recomendó en 2003 que la oripavina fuera controlada en la Lista I de la Convención Única de 1961 sobre Drogas estupefacientes.[9] El 14 de marzo de 2007, la Comisión de Estupefacientes de las Naciones Unidas decidió formalmente aceptar estas recomendaciones y colocó a la oripavina en la Lista I.[10]
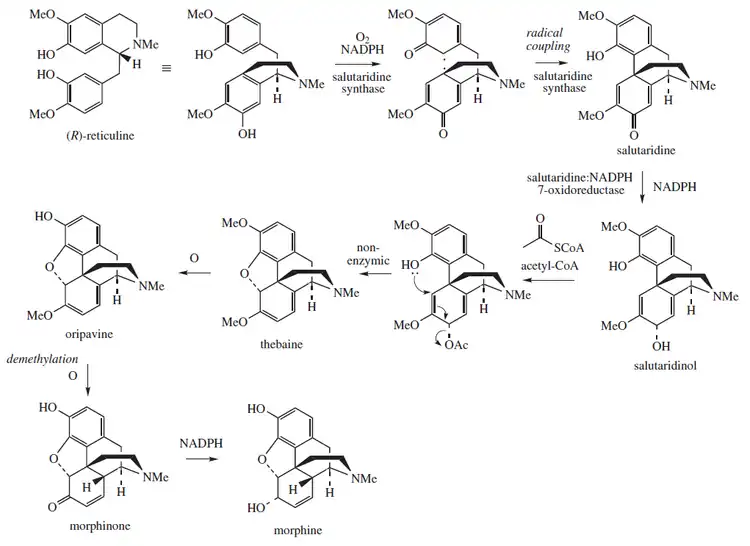
Biosíntesis
Esta molécula está relacionada biosintéticamente metabolismo de derivados del morfinano, donde la tebaína y morfina están implicadas.[11]
Referencias
- Número CAS
- Yeh, SY (diciembre de 1981). «Analgesic activity and toxicity of oripavine and phi-dihydrothebaine in the mouse and rat». Archives Internationales de Pharmacodynamie et de Thérapie 254 (2): 223-40. PMID 6121539.
- Pierre, Chanoit (1981). «Dependence potential of oripavine». Bulletin on Narcotics 33 (3): 29-35. PMID 7039748. Consultado el 5 de octubre de 2007.
- Bentley, K. W.; Boura, A. L.; Fitzgerald, A. E.; Hardy, D. G.; McCoubrey, A; Aikman, M. L.; Lister, R. E. (1965). «Compounds Possessing Morphine-Antagonizing or Powerful Analgesic Properties». Nature 206 (4979): 102-3. Bibcode:1965Natur.206..102B. PMID 14334338. doi:10.1038/206102a0.
- Bentley, K. W.; Hardy, D. G.; Meek, B (1967). «Novel analgesics and molecular rearrangements in the morphine-thebaine group. II. Alcohols derived from 6,14-endo-etheno- and 6,14-endo-ethanotetrahydrothebaine». Journal of the American Chemical Society 89 (13): 3273-80. PMID 6042763. doi:10.1021/ja00989a031.
- Bentley, K. W.; Hardy, D. G.; Meek, B (1967). «Novel analgesics and molecular rearrangements in the morphine-thebaine group. IV. Acid-catalyzed rearrangements of alcohols of the 6,14-endo-ethenotetrahydrothebaine series». Journal of the American Chemical Society 89 (13): 3293-303. PMID 6042765. doi:10.1021/ja00989a033.
- Lewis, J. W.; Bentley, K. W.; Cowan, A (1971). «Narcotic analgesics and antagonists». Annual Review of Pharmacology 11: 241-70. PMID 4948499. doi:10.1146/annurev.pa.11.040171.001325.
- Bentley, K. W.; Hardy, D. G. (1967). «Novel analgesics and molecular rearrangements in the morphine-thebaine group. 3. Alcohols of the 6,14-endo-ethenotetrahydrooripavine series and derived analogs of N-allylnormorphine and -norcodeine». Journal of the American Chemical Society 89 (13): 3281-92. PMID 6042764. doi:10.1021/ja00989a032.
- WHO Expert Committee on Drug Dependence. "Thirty-third report". WHO Technical Report Series, No. 915. Geneva, World Health Organization, 2003. Accessed September 17, 2007.
- UN Commission on Narcotic Drugs. "Decision 50/1: Inclusion of oripavine in Schedule I of the Single Convention on Narcotic Drugs of 1961 and that Convention as amended by the 1972 Protocol." Report on the fiftieth session Archivado el 10 de junio de 2007 en Wayback Machine. Archivado el 10 de junio de 2007 en Wayback Machine.. Document E/CN.7/2007/16, p 52. Geneva, United Nations Office on Drugs and Crime, 2007. Accessed September 18, 2007.
- Novak et al. (2000). «Morphine Synthesis and Biosynthesis—An Update» (PDF). Current Organic Chemistry 4 (3): 343-362. doi:10.2174/1385272003376292.