Pentóxido de yodo
El pentaóxido de yodo es el compuesto químico con la fórmula I2O5. Este óxido de yodo es el anhídrido del ácido yódico. Es producido por la deshidratación del ácido yódico a 200 °C en una corriente de aire seco:[2]
- 2HIO3 → I2O5 + H2O
| Pentóxido de yodo | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Óxido de yodo (V) | ||
| General | ||
| Otros nombres |
Pentaóxido (V) de yodo Anhídrido yódico | |
| Fórmula estructural |
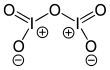 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 12029-98-0[1] | |
| ChEBI | 29914 | |
| ChemSpider | 140179 | |
| PubChem | 159402 | |
| UNII | UPU35C0Q0N | |
| Propiedades físicas | ||
| Masa molar | 333,783519 g/mol | |
Estructura
El I2O5 se dobla con un ángulo I-O-I de 139.2°, pero la molécula no tiene plano de simetría, por lo que su simetría no es C2v. Las distancias terminales I-O son de 1.80 Å y las distancias de transición I-O son de 1.95 Å.[3]
Reacciones
El pentóxido de yodo oxida fácilmente el monóxido de carbono a dióxido de carbono a temperatura ambiente:
- 5CO + I2O5 → I2 + 5CO2
Esta reacción puede usarse para analizar la concentración de CO en una muestra gaseosa.
El I2O5 forma sales yodilo, [IO2+], con SO3 y S2O6F2, pero las sales yodosil, [IO+], con ácido sulfúrico concentrado.
Véase también
- Otros compuestos de yodo con elementos de la tabla periódica:
Referencias
- Número CAS
- Greenwood & Earnshaw, páginas 851–852
- K. Selte and A. Kjekshus (1970). «Óxidos de yodo: parte III, La estructura cristalina del I2O5». Acta Chem. Scand. 24: 1912-1914. doi:10.3891/acta.chem.scand.24-1912.
Enlaces externos
- Esta obra contiene una traducción derivada de «Iodine pentoxide» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
Este artículo ha sido escrito por Wikipedia. El texto está disponible bajo la licencia Creative Commons - Atribución - CompartirIgual. Pueden aplicarse cláusulas adicionales a los archivos multimedia.