Perfluorohexano
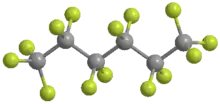
El perfluorohexano o tetradecafluoro-n-hexano es un compuesto químico formado por una cadena de 6 átomos de carbono (hexano) donde los átomos de hidrógeno han sido totalmente sustituidos por átomos de flúor.
| Perfluorohexano | ||
|---|---|---|
 Estructura química. | ||
 Estructura tridimensional. | ||
| Nombre IUPAC | ||
| 1,1,1,2,2,3,3,4,4,5,5,6,6,6-tetradecafluorohexane | ||
| General | ||
| Otros nombres | perfluorohexano, perfluoro-n-hexano, FC-72 | |
| Fórmula semidesarrollada | C6F14 | |
| Fórmula estructural |
| |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 355-42-0[1] | |
| Número RTECS | MO4310000 | |
| ChEBI | 39427 | |
| ChEMBL | CHEMBL1200607 | |
| ChemSpider | 9262 | |
| DrugBank | 09531 | |
| PubChem | 9639 | |
| UNII | FX3WJ41CMX | |
| KEGG | D05437 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 167 kg/m³; 1676 g/cm³ | |
| Masa molar | 33 804 g/mol | |
| Punto de fusión | 187,115 K (−86 °C) | |
| Punto de ebullición | 330,35 K (57 °C) | |
| Temperatura crítica | 450,6 K (177 °C) | |
| Presión crítica | 1,877 atm | |
| Viscosidad | 0,70 a 25 °C | |
| Propiedades químicas | ||
| Solubilidad en agua | Inmiscible | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Su fórmula molecular es C6F14. Pertenece a la familia de los perfluorocarburos (PFC) o perfluoroalcanos, cuya fórmula molecular general es CnF2n+2, n = 5-9.
La sustitución de los átomos de hidrógeno por átomos de flúor tiene una profunda influencia sobre las propiedades físicas y químicas de estos compuestos, permitiendo unos usos y aplicaciones muy interesantes en campos muy diversos como la electrónica, la química y la medicina.
Propiedades físico-químicas
Estas propiedades vienen determinadas por la presencia de los átomos de flúor, que al ser los más pequeños y electronegativos de la tabla periódica confieren a los perfluoroalcanos un marcado carácter apolar y unas bajas atracciones entre sus moléculas.
Como resultado, estos compuestos poseen una menor polarizabilidad en comparación sus alcanos análogos, y por tanto una temperatura de ebullición algo menor a pesar de tener pesos moleculares mucho mayores. El perfluorohexano, de peso molecular 338 posee una temperatura de ebullición de 57 °C mientras que el hexano de peso molecular 86 vaporiza a 69 °C (Kroschwitz and Howe-Grant, 1994).
Por la misma razón, estos compuestos poseen menores tensiones superficiales, índices de refracción y constantes dieléctricas, y mayores densidades, viscosidades y compresibilidades (Kroschwitz and Howe-Grant, 1994). El perflurohexano posee una densidad de 1,68 g/cm3 y una viscosidad cinética de 0,7 mPa/s a 25 °C mientras que en el hexano estos valores son 0,65 g/cm3 y 0,3 mPa/s respectivamente.
Por otro lado, el enlace C-F no solo es considerablemente fuerte, sino que también es química y térmicamente muy estable. Resiste a casi todos los ataques químicos, incluyendo el del flúor, el elemento más reactivo, por lo que se considera inerte tanto desde el punto de vista químico como biológico.
Además de estas propiedades , el perfluorohexano, al igual que otros perfluoroalcanos es incoloro, no-inflamable, inerte, no corrosivo, insoluble e inmiscible con agua y la mayoría de disolventes. Además, debido a su alta estabilidad química y biológica, y a su bajo tiempo de permanencia en el cuerpo, se puede considerar prácticamente no tóxico (escala más baja de toxicidad).
Por último se debe destacar la alta solubilidad que algunos gases apolares como el oxígeno son capaces de presentar en estas sustancias, consecuencia de nuevo de la naturaleza de los átomos de flúor. La baja presencia de interacciones inter e intramoleculares permite que las moléculas de gas no encuentren ningún impedimento estérico y se puedan alojar en altas concentraciones en el fluido.
Un poco de historia
Por todas estas características su uso empezó a desarrollarse como sustitutos de los clorofluorocarburos (CFC), hidroclorofuorocarburos (HCFC) y otros halones en distintas aplicaciones a principios de los años 90, debido a que los PFC no causan daños a la capa de ozono.
De todos los perfluoroalcanos, el perfluorohexano es el compuesto más utilizado. Su demanda ha crecido sustancialmente en los últimos años debido principalmente al desarrollo de su aplicabilidad en el campo de la electrónica. También se ha desarrollado su uso para diversas aplicaciones médicas, aunque el consumo en tonelaje por parte de éstas es menos significativo.
Aplicaciones
Electrónica
Antes del Protocolo de Kioto, los disolventes orgánicos más usados para electrónica, para limpieza de precisión y acabado de metales eran disolventes clorados como CFC-113 y 1,1,1-tricloroetano o HCFC y HFC (Tsai, 2005; Tsai, 2008). A partir de dicho protocolo, se prohibió el uso de estas sustancias, y se propusieron para estas aplicaciones algunos perfluoroalcanos como sustitutos, debido a su menor toxicidad y mayor lipofilia, aunque son peores disolventes. El más usado en este campo es el perfluorohexano debido a que posee propiedades químicas similares al CFC-113 y al 1,1,1-tricloroetano (Marino, 1993). Utilizado en forma de vapor es muy útil para eliminar trazas de grasas en estado vapor, y en forma de spray para eliminar partículas de piezas de electrónica.
Fluido transmisor de calor
De nuevo como sustitutos de los CFC, los perfluorocarburos se pueden usar como fluidos para transferencia de calor para algunos sistemas no mecánicos, debido principalmente a sus excelentes propiedades dieléctricas y la alta compatibilidad con casi todos los materiales. El más usado en este campo es el perfluorohexano (Park et al.,2004). De nuevo, la industria donde más se usa es en la electrónica, ya que su uso permite el desarrollo de materiales más densos, como superordenadores. Por otro lado, también son usados en transformadores, condensadores y soldaduras (Banks et al., 1994).
Agente supresor de incendios
Otro de los usos del perfluorohexano es como agente supresor para extinguir incendios. Se empezó a usar en 1994 como sustituto de los halones para algunos casos particulares como para protección de equipamiento eléctrico sensible, cuando el uso de estos fue prohibido. Es un compuesto excelente para esta aplicación debido a su nula conductividad y a que no deja residuos tras su uso.
Medicina
- Aerosoles
El perfluorohexano puede usarse como base para aerosoles y como emulsionante para suspensiones de micropartículas para aplicaciones médicas y farmacéuticas (Mana et al., 2007) como sustitutos de los CFC, como por ejemplo en los inhaladores para asmáticos.
- Tratamiento de quemaduras y cicatrización
Se ha desarrollado una serie de aplicaciones médicas en las que se aprovecha la gran cantidad de oxígeno que pueden disolver estos líquidos para regenerar tejidos o para ayudar a la respiración en casos de quemaduras pulmonares. En el caso de quemaduras pulmonares se insuflan los pulmones con perfluorohexano u otros perfluoroalcanos como perfluorodecalina (en forma gaseosa o en casos extremos en forma líquida) con una alta concentración de oxígeno de forma que el paciente es capaz de respirar (Whitney, 1989). En el caso que heridas, ulceras o quemaduras en la piel se administran emulsiones oxigenadas que aumentan el suministro de oxígeno a los tejidos sin necesidad de aumentar el flujo de sangre .
- Esterilización
Debido a que presentan un punto de ebullición más bajo que el agua, y a que son incluso más inertes que ésta, con los perfluroalcanos se pueden alcanzar condiciones de esterilización a temperaturas más bajas y se evitan problemas de corrosión.
- Oftalmología
En este caso además de su nula toxicidad se aprovecha la alta densidad que posee para sustituir al humor vítreo en cirugías oculares y en tratamientos de desprendimiento de retina (Peyman et al., 1995) ayudando a que se presione la retina en su lugar correcto.
- Diagnóstico por imagen
También pueden ser usados como agentes de contraste en técnicas médicas de diagnóstico por imagen (Hall et al., 2000). Se puede seguir el movimiento de los fluorocarburos con técnicas como RMN o ultrasonidos ya que el átomo de flúor no existe de forma natural en el cuerpo humano. Además la técnica tiene un sensibilidad comparable con RMN-1H y el isótopo 19-flúor es el único natural.
Otras aplicaciones
También se usa como medio de reacción en síntesis orgánica para reacciones como la Friedel-Craft (Nakano and Kitazume, 1999; Sandford, 2003). Como surfantante para modificación en fase gas de lubricantes. En láseres líquidos y ópticos (Stoilov, 1998). Como líquido de relleno en dispositivos de sonar y en lentes acústicas (Cusco and Trusler, 1995). Como detector de fugas en dispositivos electrónicos médicos (Zundorf et al., 2008)
Toxicidad
Aunque están considerados compuestos no tóxicos, hay algunos estudios en los que se demuestra que en condiciones extremas los pefluorocarburos pueden descomponer en pequeñas moléculas que pueden ser tóxicas (O'Mahony et al.,1993; Zundorf et al., 2008).
En la pirólisis del perfluorohexano se obtienen compuestos como tetrafluorometano (CF4), tetrafluoroetileno (C2F4), hexafluoroetano (C2F6), hexafluoropropeno (C3F6) y perfluoroisobutileno (C4F3). El tetrafluoroetileno presenta toxicidad crónica y es carcinógeno, mientras que el perfluoroisobutileno es unas 10 veces más tóxico que el fosgeno y su inhalación puede causar serios daños pulmonares (Wang et al., 2001). Esto hace que la manipulación de estos compuestos presente un riesgo en caso de incendios o accidentes industriales.
Otros compuestos tóxicos como floruro de carbonilo (o fluorofosgeno) (COF2), y fluoruro de hidrógeno (HF), pueden generarse si además hay otras moléculas presentes como agua,(H2O), y oxígeno (O2) (O'Mahony et al., 1993; Tsai et al., 2000; Marotta et al., 2004). Todos estos productos de descomposición son muy solubles y/o reactivos en agua, incluyendo la humedad del aire, pudiendo por tanto contaminar agua y atmósfera.
Medio Ambiente
Los PFC surgieron como compuestos de un gran interés desde el punto de vista medioambiental ya que son compuestos que no destruyen la capa de ozono. Sin embargo, debido a su alta estabilidad, su degradabilidad en el medioambiente es muy baja por lo que permanecen en el mismo durante mucho tiempo. Además están catalogados como potentes gases de efecto invernadero y son unos de los 6 objetivos del Protocolo de Kioto.
El perfluorohexano posee un potencial de calentamiento 9300 veces mayor que el dióxido de carbono (CO2) (IPCC, 2007), y posee un tiempo de vida media de 3200 años (IPCC, 2007). Del cálculo de los diferentes coeficientes de distribución se puede deducir en qué medio se acumulará durante ese tiempo.
- Coeficiente de partición octanol-agua: log Kow = 1,79
Nos caracteriza la repartición entre agua y grasas, lo que se puede traducir como su capacidad para atravesar las membranas lipídicas y acumularse en los seres vivos. Para el perflurohexano este valor es lo suficientemente bajo como para predecir que el perfluorohexano no es bioacumulativo (Allen and Shonnard, 2002), aunque sí es más lipofílico que hidrofílico.
- Solubilidad en agua: S = 1,0·10−5 mol/L
Este parámetro es importante para describir su distribución en el ciclo hidrológico. En este caso el valor es extremadamente bajo , por lo que no se disolverá en el agua y formará una fase independiente. Esto concuerda con su alta apolaridad y su baja polarizabilidad e interacciones moleculares.
- Constante de Henry: ln (KH/ MPa) = 11,96
Este valor caracteriza la repartición del compuesto en fase gas entre el atmósfera y agua. Su valor nos indica una alta tendencia a la vaporización desde las masas de agua, por lo que se encontrarán mayoritariamente en la atmósfera.
Por otro lado, su ecotoxicidad no ha sido todavía bien estudiada, por lo que se deben evitar todos los posibles vertidos al medio ambiente de esta sustancia.
Ácidos perfluoroalquílicos
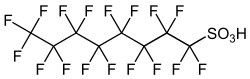
Los ácidos perfluoroalquílicos (PFAAs) como el ácido perfluorohexanosulfónico (PFHx) y sus sulfonatos derivados merecen una mención especial, ya que pueden acompañar a las formulaciones comerciales de perfluorohexano, o usarse para diferentes aplicaciones como por ejemplo para el teflón de las sartenes.
Estos compuestos han despertado un gran interés en los últimos años ya que se han clasificado como contaminantes persistentes ya que varios estudios han localizado concentraciones de estas sustancias en medios como el agua de los ríos, el polvo de los hogares y en la leche materna. El PFHx presenta un tiempo de vida media en el organismo de 8,5 años.
Legislación relacionada
Véase también
Referencias
Bibliografía
Allen DT, Shonnard DR, editors. Green engineering: environmentally conscious design of chemical processes. Upper Saddle River, New Jersey: Prentice Hall; 2002.
Banks RE, Smart BE, Tatlow JC, editors. Organofluorine chemistry-principles and commercial applications. New York: Plenum Press; 1994.
Cusco L, Trusler JPM. Identification of environmentally acceptable low-sound speed liquids. Inter J Thermophys 1995;16:675–85.
Hall CS, Lanza GM, Rose JH, Kaufmann RJ, Fuhrhop RW, Handley SH, et al. Experimental determination of phase velocity of perfluorocarbons: applications to targeted contrast agents, IEEE Trans. Ultrason Ferroelect Freq Contr 2000;47:75–84.
Intergovernmental Panel on Climate Change (IPCC). Climate change 2007— the physical science basis. Geneva, Switzerland: IPCC; 2007.
Kroschwitz JI, Howe-Grant M, editors. Kirk–Othmer encyclopedia of chemical technology, 4th ed, vol. 11. New York: John Wiley & Sons; 1994.
Mana Z, Pellequer Y, Lamprecht A. Oil-in-oil microencapsulation technique with an external perfluorohexane phase. Int J Pharm 2007;338:231–7.
Marino FA. A new process alternative for replacing ozone-depleting solvent cleaners.Plat Surf Finish 1993;80(4):41–5.
Marotta E, Paradisi C, Scorrano G. An atmospheric pressure chemical ionization study of positive and negative ion chemistry of the hydrofluorocarbons 1,1-difluoroethane(HFC-152a) and 1,1,1,2-tetrafluoroethane (HFC-134a) and of perfluoro-n-hexane (FC-72) in air plasma at atmospheric pressure. J Mass Spectrom 2004;39:791–801.
Nakano H, Kitazume T. Friedel–Crafts reaction in fluorous fluids. Green Chem 1999;1:179–81.
O'Mahony TKP, Cox AP, Roberts DJ. Quantitative analysis of the pyrolysis products of perfluorocarbon fluids by gas chromatography and spectroscopic techniques. Anal Proc 1993;30:262–6.
Park YJ, Kim CJ, Hong SE. A study of the heat transfer characteristics of an FC-72 (C6F14) two-phase closed thermosyphon with helical grooves on the inner surface. Heat Transfer Eng 2004;25:60–8.
Peyman GA, Schulman JA, Sullivan B. Perfluorocarbon liquids in ophthalmology. Surv Ophthalmol 1995;39:375–95.
Stoilov YY. Fluorocarbons as volatile surfactants. Langmuir 1998;14:5685–90.
Tsai PJ, Guo YL, Chen JL, Shieh HY. An integrated approach to initiate preventive strategies for workers exposed to Teflon pyrolytic gases in a plastic industry. J Occup Health 2000;42:297–303.
Tsai WT. An overview of environmental hazards and exposure risk of hydrofluorocarbons (HFCs). Chemosphere 2005;61:1539–47.
Tsai WT. Governmental policies on hydrochlorofluorocarbons (HCFCs) mitigation and its cleaner production measures — case study in Taiwan. J Cleaner Prod 2008;16:646–54.
Withney JD. General information about high pressure oxigen in wound healing. Heart and Lung, 1989;18:466
Wang H, Ding R, Ruan J, Yuan B, Sun X, Zhang X, et al. Perfluoroisobutylene-induced acute lung injury and mortality are heralded by neutrophil sequestration and accumulation. J Occup Health 2001;43:331–8.
Zundorf J, Kremer S, Gruger T. Formation of hydrogen fluoride by gamma and beta sterilisation in medical devices containing perfluoroheptane. Toxicology 2008;243:284–93.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Protocolo de Kioto.
Wikimedia Commons alberga una categoría multimedia sobre Protocolo de Kioto.- Hojas de seguridad del perfluorohexano
- F2 Chemicals Ltd Compañía especializada en química orgánica fluorosa
- Flutec fluids Perfluorocarburos para altas especificaciones
- Fluorinert 3M Manufactura de líquidos electrónicos
- Invenia Procedimiento para la purificación de perfluoroalcanos y utilización de perfluoroalcanos purificados
- Envionmental Grupo organizado que divulga los perjuicios que generan para la salud los PFC
- Procedimiento para la preparación de nuevos perfluoroalcanos mediante fluoración fotoquímica