Piocianina
La piocianina (PCN-) es un alcaloide fenazínico que constituye una de las muchas toxinas producidas y secretadas por la bacteria Gram negativa Pseudomonas aeruginosa. La piocianina es un metabolito secundario de coloración azul con la capacidad de oxidar y reducir otras moléculas y, por lo tanto, puede matar a los microbios que compiten contra P. aeruginosa así como a las células de los pulmones de los mamíferos a los cuales P. aeruginosa ha infectado durante la fibrosis quística. Dado que la piocianina es un zwitterión al pH de la sangre, es capaz de atravesar fácilmente la membrana celular. Hay tres estados diferentes en los que puede existir piocianina; oxidado, reducido monovalentemente o reducido divalente. Las mitocondrias juegan un papel muy importante en el ciclo de la piocianina entre sus estados redox, los cuales al ser muy activas, puede generar especies reactivas de oxígeno.
| Piocianina | ||
|---|---|---|
 | ||
 | ||
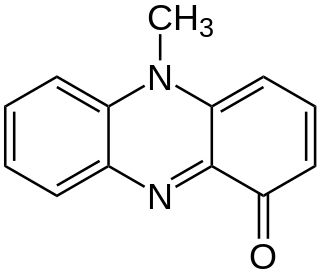
| Nombre IUPAC | ||
| 5-Metilfenazin-1-ona | ||
| General | ||
| Otros nombres | Pirocianina; 5-Metil-1(5H)-fenazinona; Sanasina; Sanazina | |
| Fórmula estructural |
 | |
| Fórmula molecular |
C 13H 10N 2O 1 | |
| Identificadores | ||
| Número CAS | 85-66-5[1] | |
| ChemSpider | 6558 | |
| PubChem | 6817 | |
|
CN1C2=CC=CC=C2N=C3C1=CC=CC3=O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido azul verdoso | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Biosíntesis
Para que la piocianina sea sintetizada por P. aeruginosa, dos genes específicos deben ser funcionales. MvfR es un gen que produce un factor de transcripción que activa los genes de phnAB. Estos genes producen la molécula quinolona que luego regula los operones 1 y 2 de phzRABCDEFG que son clave para la síntesis de fenazina.[2] La síntesis de piocianina se controla principalmente mediante el proceso de detección por señalización en quórum. Las cepas de P. aeruginosa que son incapaces de sintetizar piocianina aún se pueden beneficiar de sus efectos si la cepa ha coinfectado el pulmón con cepas naturales que puedan producir piocianina. La biosíntesis puede verse afectada al interrumpir la vía aro que es la responsable de la síntesis del ácido corísmico a partir del ácido shikímico. El ácido corísmico es el precursor de la piocianina, en la que se forma un intermediario aminado que al ensamblarse con dos unidades tautoméricas distintas, genera el ácido fenazino-1-carboxílico. Este compuesto es precursor de otras fenazinas.[3]
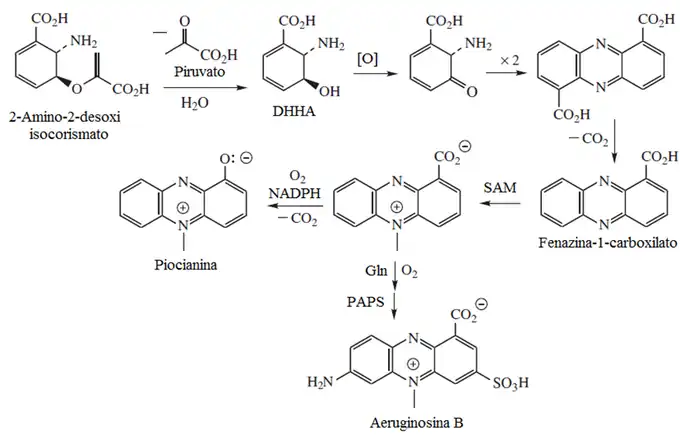
La virulencia completa de P. aeruginosa sólo puede manifestarse cuándo se ha producido la piocianina.[4]
Virulencia
La piocianina inactiva la catalasa al reducir la transcripción de su gen y dirigirse directamente la enzima. El glutatión es un antioxidante importante modulado por la piocianina. En particular, el conjunto de la forma reducida se agota mientras que la forma oxidada se promueve con peróxido de hidrógeno que no se dismuta con la catalasa. En la fibrosis quística pulmonar, la piocianina intracelular convierte el oxígeno molecular en el radical libre de superóxido mediante la oxidación de NADPH a NADP +. Esto tiene un efecto doblemente negativo en los pulmones. En primer lugar, el NADPH utilizado por la piocianina agota el sustrato disponible para la reacción catalizada por la enzima NADPH oxidasa. En segundo lugar, el radical superóxido generado puede inhibir citoquinas tales como IL-4, IL-13 e IFN-γ que generalmente regulan por incremento la NADPH oxidasa. Cuando el pulmón se enfrenta con la piocianina, se observa una mayor concentración de catalasa y superóxido dismutasa para hacer frente a la cascada de radicales que se producen.[5]
Blancos moleculares
La piocianina es capaz de actuar sobre una amplia gama de componentes y rutas celulares. Las rutas que se ven afectadas por la piocianina incluyen la cadena de transporte de electrones, el transporte vesicular y el crecimiento celular. Se observa una mayor susceptibilidad a la piocianina en las células que tienen mutación en ciertas proteínas o complejos. Las mutaciones en genes que afectan a la síntesis y ensamblaje de V-ATPasa, la maquinaria de transporte de vesículas y la maquinaria de clasificación de proteínas confieren una mayor sensibilidad a la piocianina, lo que aumenta aún más los efectos sobre la fibrosis quística en el paciente. La ATPasa vacuolar en las células de levadura es un objetivo particularmente potente ya que es el principal productor no mitocondrial de ATP, pero también tiene muchas otras funciones tales como control homeostático de calcio, la facilitación de endocitosis mediada por receptor y la degradación de proteínas. Por lo tanto, la inactivación de la ATPasa vacuolar por el peróxido de hidrógeno producido por la piocianina tiene enormes consecuencias para el pulmón. Además de estos efectos, otro objetivo de la piocianina son las proteasas tipo caspasa 3 que luego pueden iniciar la apoptosis y la necrosis. La ubiquinona y el ácido nicotínico de los portadores de electrones mitocondriales también son susceptibles a la piocianina.[6] El ciclo celular puede alterarse por la acción de la piocianina y también puede obstaculizar la proliferación de linfocitos.[7] Esto se realiza mediante la generación de especies reactivas de oxígeno, tales como el peróxido de hidrógeno y el anión superóxido, que causan estrés oxidativo al dañar el ADN directa o alternativamente al dirigirse a otros constituyentes del ciclo celular, como la recombinación del ADN y la maquinaria de reparación. La piocianina contribuye a la desproporción de la actividad de la proteasa y la antiproteasa al inhabilitar el inhibidor de la proteasa α1.[8]
Fibrosis quística
Muchos estudios han concluido que la piocianina tiene un efecto derogatorio en la fibrosis quística que permite que P. aeruginosa persista en la fibrosis quística del pulmón; a menudo se detecta en el esputo de pacientes con fibrosis quística. La piocianina in vitro tiene la capacidad de interferir con funciones tales como los golpes ciliares y, por lo tanto, causa disfunción epitelial, ya que se necesitan los cilios para barrer el moco en la garganta. Además, la apoptosis de los neutrófilos, la liberación de inmunoglobulinas de los linfocitos B y la liberación de interleucina, p. IL-8 y CCL5 se encuentran todos alterados por la piocianina, lo que causa que el sistema inmunitario del pulmón se debilite.[9][10][11] Los estudios in vivo han demostrado que el crecimiento de hongos se inhibe en presencia de piocianina. El mecanismo fungicida es la activación de NAD (P) H para inducir una cascada activa redox para producir especies reactivas de oxígeno. Esto permite que P. aeruginosa tenga una ventaja competitiva ya que puede dominar a otros microorganismos en la fibrosis quística del pulmón. La concentración intracelular de ATP también se ve disminuida por la piocianina que causa un mayor daño a CFTR que ya están alterados en la fibrosis quística. Los canales de CFTR dependen de ATP para dos propósitos principales. En primer lugar, la unión e hidrólisis del ATP tiene que producirse en dos dominios de unión de nucleótidos para que el canal se mueva entre su conformación abierta y cerrada. En segundo lugar, debe ocurrir la fosforilación de CFTR por la proteína quinasa A II para que el canal sea operacional. PKA II es activado por cAMP que se produce a partir de ATP. Ambos procesos se deterioran cuando la piocianina agota el ATP.
Defensa contra piocianina
Caenorhabditis elegans posee dos transportadores ABC llamados pgp-1 y pgp-2 los cuales son eficazmente capaces de expulsar la piocianina del interior de la célula por transporte activo.[12]
Véase también
Referencias
- Número CAS
- Mavrodi D, Bonsall, R, Delaney, S, Soule, M, Phillips G & Thomashow, L. S. (2001). «Function analysis of genes for biosynthesis of pyocyanin and phenazine -1-carboxamide from Pseudomonas aeruginosa PAO1». Journal of Bacteriology 183 (21): 6454-6465. PMC 100142. PMID 11591691. doi:10.1128/JB.183.21.6454-6465.2001.
- «Phenazine-1-carboxylic acid, a secondary metabolite of Pseudomonas aeruginosa, alters expression of immunomodulatory proteins by human airway epithelial cells». American Journal of Physiology 285: 584-L592. 2003. doi:10.1152/ajplung.00086.2003.
- «The Pseudomonas aeruginosa secretory product pyocyanin inactivates α1 protease inhibitor: implications for the pathogenesis of cystic fibrosis lung disease». Infection and Immunity 67: 1207-1212. 1999.
- «Human targets of Pseudomonas aeruginosa pyocyanin». PNAS 100 (24): 14315-14320. 2003. PMC 283589. PMID 14605211. doi:10.1073/pnas.2332354100.
- Hassett D, Woodruff W, Wozniak D, Vasil M, Cohen S, Ohman D (1993). «Cloning and characterization of the Pseudomonas aeruginosa soda and sodB genes encoding manganese- and iron cofactored SOD: demonstration of increased Mn SOD dismutase activity in alginate-producing bacteria». Journal of Bacteriology 175 (23): 7658-65. PMC 206923. PMID 8244935. doi:10.1128/jb.175.23.7658-7665.1993.
- Sorensen R, Klinger J (1987). «Biological effects of Pseudomonas aeruginosa phenazine pigments». Journal of antibiotic Chemotherapy 39: 113-124. PMID 3118778.
- Ostedgaard S, Baldursson O, Vermeer D, Welsh M, Robertson A (2001). «Regulation of the cystic fibrosis transmembrane conductance regulator ClK channel by its R domain». Journal of Biological Chemistry 276 (11): 7689-7692. doi:10.1074/jbc.R100001200.
- Kanthakumar K, Taylor G, Tsang K, Cundell D, Rutman A, Smith S, Jeffery P, Cole P, Wilson R (1993). «Mechanism of action of Pseudomona aeruginosa pyocyanin on human ciliary beat in vitro». Infection and Immunity 61: 2848-2853.
- Usher L, Lawson R, Gaery I, Taylor C, Bingle C, Taylor G, Whyte M (2002). «Induction of neutrophil apoptosis by the Pseudomonas aeruginosa exotoxin pyocyanin: a potential mechanism of persistent infection». The Journal of Immunology 4: 1861-1868.
- Denning G, Wollenweber L, Railsback M, Cox C, Stoll L, Britigan B (1998). «Pseudomonas pyocyanin increases interleukin-8 expression by human airway epithelial cells». Infection and Immunity 66 (12): 5777-5784. PMC 108730. PMID 9826354.
- «Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model». Cell 96 (1): 47-56. 1999. PMID 9989496. doi:10.1016/S0092-8674(00)80958-7.