Pirroloquinolina quinona
La Pirroloquinolina quinona (PQQ) fue descubierta por J.G. Hauge como el tercer cofactor enzimático luego de la nicotinamida y flavina en bacterias, aunque habían hipotetizado que se trataba de una naftoquinona.[2] Anthony y Zatman también encontraron el cofactor redox desconocido en la enzima alcohol deshidrogenasa, y lo llamaron metoxatina.[3] En 1979, Salisbury et al.,[4] como así también Duine et al.[5] extrajeron este grupo prostético de la metanol deshidrogenasa de metilotropos e identificaron su estructura molecular. Adachi et al. identificaron que la PQQ también se encontraba en Acetobacter.[6]
| Pirroloquinolina quinona | ||
|---|---|---|
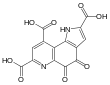 | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | C14H6N2O8 | |
| Identificadores | ||
| Número CAS | 72909-34-3[1] | |
| ChEBI | 18315 | |
| ChEMBL | CHEMBL1235421 | |
| ChemSpider | 997 | |
| DrugBank | 03205 | |
| PubChem | 1024 | |
| UNII | 47819QGH5L | |
| KEGG | C00113 | |
|
c1c2c([nH]c1C(=O)O)-c3c(cc(nc3C(=O)C2=O)C(=O)O)C(=O)O
| ||
| Propiedades físicas | ||
| Masa molar | 330,012 g/mol | |
Las enzimas que contienen PQQ se denominan quinoproteínas. La glucosa deshidrogenasa, una de las quinoproteínas, se utiliza como sensor de glucosa. Subsecuentemente se encontró que la PQQ estimulaba el crecimiento bacteriano.[7] Adicionalmente se han encontrado efectos antioxidantes y neuroprotectivos.[8]
Biogénesis mitocondrial
En 2010, investigadores de la Universidad de California, publicaron un trabajo revisado por pares demostrando que la PQQ desempeña un papel crítico en el crecimiento y desarrollo de células pluripotentes gracias a su habilidad única para activar vías de señalización que se encuentran directamente involucradas en el desarrollo y función del metabolismo energético celular.
Más significativamente, el estudio demuestra que la PQQ no solo protege a las mitocondrias del estrés oxidativo, sino que promueve la generación espontánea de nuevas mitocondrias dentro de las células envejecidas, un proceso conocido como biogénesis mitocondrial.[9] Las implicaciones de este descubrimiento para la salud humana y longevidad es significativo, porque el único otro método conocido para estimular la biogénesis mitocondrial en humanos añosos es el ejercicio aeróbico intenso,[10] restricción calórica,[11] y ciertas medicaciones tales como las tiazolidinedionas[12] y la medicación para la diabetes metformina.[13]
Activación de moléculas de señalización
El equipo de investigadores de la Universidad de California analizó la influencia de la PQQ sobre las vías de señalización celulares involucradas en la generación de nuevas mitocondrias y encontró que hay tres moléculas de señalización activadas por la PQQ que causan que las células sufran una biogénesis mitocondríal espontánea:[9]
- La PQQ activa la expresión de PCG-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), un regulador maestro que moviliza a las células en respuesta a varios detonadores externos. Estimula directamente a genes que promueven la respiración mitocondrial y celular, crecimiento y proliferación. Su capacidad de regular a la alta el metabolismo celular a nivel genético, afecta favorablemente a la presión sanguínea, colesterol y degradación de triglicéridos, y la aparición de obesidad.[14]
- La PQQ desencadena la proteína de señalización CREB (cAMP-response element-binding protein), la cual desempeña un papel pivotante en el desarrollo embrional y en el crecimiento. Interactúa además beneficiosamente con las histonas, proteínas involucradas en el empaquetamiento y organización del ADN celular.[15] La proteína CREB además estimula el crecimiento de nuevas mitocondrias.
- La PQQ regula una proteína de señalización celular recientemente descubierta llamada DJ-1. Así como la PCG-1α y CREB, DJ-1 se encuentra involucrada en la función celular y supervivencia, ha demostrado prevenir la muerte celular combatiendo el estrés oxidativo intenso,[16][17] y es muy importante para la salud del cerebro y su funcionamiento. Las mutaciones de la DJ-1 han demostrado conclusivamente estar relacionadas con la aparición temprana de algunas formas raras de enfermedad de Parkinson hereditaria y otros desórdenes neurológicos.[cita requerida]
Neuroproteción
La PQQ es un compuesto neuroprotectivo que ha demostrado en un pequeño número de estudios preliminares proteger la memoria y la cognición en animales añosos y en humanos.[18][19][20] La suplementación con PQQ estimula la producción y liberación de factores de crecimiento nervioso de parte de las células que sostienen a las neuronas en el cerebro,[21] uno de los posibles mecanismos para mejorar la función de la memoria que aparentemente se produce en animales y humanos ancianos.
La PQQ también ha demostrado poseer un efecto protector contra la autooxidación de la proteína DJ-1, uno de los primeros pasos en la aparición temprana de algunas formas de enfermedad de Parkinson.[22]
La PQQ también protege a las neuronas contra la injuria oxidativa que sigue al daño por isquemia y reperfusión, es decir el daño inflamatorio y oxidativo que resulta del súbito retorno de sangre y nutrientes a los tejidos que habían sido privados de ellos por el ataque.[23] Las especies reactivas de nitrógeno (ERNs) aumentan espontáneamente luego de un ataque cerebral o de un daño en la médula espinal lo cual impone un estrés severo a las neuronas dañadas, contribuyendo al daño neurológico a largo plazo subsecuente.[24] La PQQ suprime las ERNs en ataques cerebrales inducidos experimentalmente,[25] y provee una protección adicional luego de una lesión en la médula espinal bloqueando la óxido nítrico sintasa inducible (iNOS), la mayor fuente de ERNs.[26]
En modelos animales, la administración de PQQ inmediatamente antes a la inducción de un ataque reduce significativamente el tamaño del área cerebral dañada.[27] Estas observaciones han sido compuestas con la observación in vivo de que la PQQ protege contra la posibilidad de un ataque cerebral severo en modelos animales para ataque e hipoxia cerebrales.[23]
La PQQ además afecta algunos de los sistemas neurotransmisores cerebrales. Protege a las neuronas modulando las propiedades del receptor de N-metil-D-aspartato (NMDA),[28][29] reduciendo así la excitoxicidad, es decir el daño a largo plazo como consecuencia de la sobreestimulación de las neuronas que se encuentran asociadas con muchas enfermedades neurodegenerativas y convulsiones.[30][31][32][33]
La PQQ además protege al cerebro de la neurotoxicidad inducida por otras toxinas poderosas, incluyendo el mercurio[34] (uno de los factores sospechosos en el desarrollo del Alzheimer[35]) y la oxidopamina[36] (una potente neurotoxina utilizada por los científicos para inducir Parkinsonismo en los animales de laboratorio destruyendo a las neuronas dopaminérgicas y noradrenérgicas.[37])
La PQQ previene la agregación de la alfa-sinucleína, una proteína asociada con la enfermedad de Parkinson.[38] Protege además a las células nerviosas de los efectos tóxicos de la proteína beta amiloide vinculada con la enfermedad de Alzheimer,[39] y reduce la formación de nuevos agregados beta amiloides.[40]
Cardioprotección
El daño en un ataque de corazón, como en el de cerebro, se produce vía injuria isquémica de reperfusión. La administración de PQQ reduce el tamaño de las áreas dañadas en los modelos animales de infarto agudo de miocardio. Significativamente, esto ocurre independientemente de si el producto es administrado antes o después del evento isquémico en si, sugiriendo que la administración dentro de las primeras horas de respuesta médica podría ofrecer grandes beneficios a las víctimas de un infarto de corazón.[41]
Investigadores de la Universidad de California, en San Francisco investigaron este potencial, comparando a la PQQ con el betabloqueante metoprolol, un tratamiento post infarto de miocardio estándar. Independientemente ambos tratamientos reducen el tamaño de las áreas dañadas y protegen contra la disfunción del músculo cardíaco. Cuando se administran conjuntamente, la presión de bombeo del ventrículo izquierdo se ve mejorada. La combinación de PQQ con metoprolol además aumenta la producción de energía mitocondrial, pero el efecto es modesto comparado con la acción de la PQQ sola. Solo la PQQ reduce favorablemente la peroxidación lipídica. Estos resultados condujeron a los investigadores a concluir que la PQQ es "superior al metoprolol para proteger a las mitocondrias del daño oxidativo causado por isquemia/reperfusión".[42]
Subsecuentemente los investigadores también demostraron que la PQQ ayuda a las células musculares a resistir el estrés oxidativo agudo preservando y mejorando la función mitocondrial.[43]
Radioprotección
En un estudio de envenenamiento por radiación gama, 4 mg/Kg de PQQ mejoró la supervivencia a 30 días de 2/20 a 12/20 individuos bajo una dosis de 8 Gy.[44]
Dosificación del suplemento
A pesar de haber sido propuesta como un nutriente esencial,[25] no se ha establecido un nivel de ingesta diaria recomendado.
Controversias
Aunque la Revista Nature publicó en 2003 un trabajo de Kasahara y Kato, el cual esencialmente establecía que la PQQ era una nueva vitamina, posteriormente en 2005 también publicaron un artículo de Chris Anthony y su colega L.M. Fenton de la Universidad de Southhampton el cual dice que el trabajo de Kasahara y Kato de 2003 llegaba a conclusiones incorrectas e insustanciales.[45] En su sitio web,[46] Anthony discute las publicaciones de la Revista Nature:
Cuando le señalé a la Revista Nature que su alta reputación estaba siendo utilizada para justificar inversiones de millones de dólares en el desarrollo de la PQQ como vitamina, investigaron en la publicación original, acordaron con nuestras objeciones y publicaron nuestros argumentos en contra (Felton & Anthony, Nature Vol. 433, 2005). Además publicaron (entre otros) un trabajo de Rucker desacordando con las conclusiones de Kasahara y Kato sobre el terreno nutricional, concluyendo que "hasta el momento no hay suficiente información disponible como para establecer que la PQQ desempeña una función única como vitamina esencial en animales."
Anthony más tarde sentenció en su sitio web que "no se han descrito enzimas que contengan PQQ en animales (quinoproteínas)" y que por lo tanto la PQQ no puede ser llamada "vitamina". Esta última sentencia es una exageración, ya que hay al menos cuatro quinoproteínas humanas, cuyas actividades enzimáticas son dependientes de la PQQ:
- Serina/treonina-proteína kinasa/endorribonucleasa IRE1 (Inositol-requiring protein 1), involucrada en la respuesta a proteínas no plegadas, en Uniprot listada con el número de secuencia O75460[47]),
- flavina reductasa (Biliverdina reductasa B, en Uniprot P30043[48]),
- Acil-CoA sintetasa miembro 4 de la familia (L-aminoadipato-semialdehído deshidrogenasa, en Uniprot Q4L235[49]) y
- Dopamina beta-hidroxilasa (Dopamina beta-monooxigenasa, P09172 en Uniprot[50]).
Kasahara y Kato presentaron un análisis de los datos enzimológicos de la L-aminoadipato-semialdehído deshidrogenasa.[51]
Referencias
- Número CAS
- Hauge JG (1964). «Glucose dehydrogenase of bacterium anitratum: an enzyme with a novel prosthetic group». J Biol Chem 239: 3630-9. PMID 14257587.
- Anthony C, Zatman LJ (1967). «The microbial oxidation of methanol. The prosthetic group of the alcohol dehydrogenase of Pseudomonas sp. M27: a new oxidoreductase prosthetic group». Biochem J 104 (3): 960-9. PMC 1271238. PMID 6049934.
- Salisbury SA, Forrest HS, Cruse WB, Kennard O (1979). «A novel coenzyme from bacterial primary alcohol dehydrogenases». Nature 280 (5725): 843-4. PMID 471057. doi:10.1038/280843a0.
- Westerling J, Frank J, Duine JA (1979). «The prosthetic group of methanol dehydrogenase from Hyphomicrobium X: electron spin resonance evidence for a quinone structure». Biochem Biophys Res Commun 87 (3): 719-24. PMID 222269. doi:10.1016/0006-291X(79)92018-7.
- Ameyama M, Matsushita K, Ohno Y, Shinagawa E, Adachi O (1981). «Existence of a novel prosthetic group, PQQ, in membrane-bound, electron transport chain-linked, primary dehydrogenases of oxidative bacteria». FEBS Lett 130 (2): 179-83. PMID 6793395. doi:10.1016/0014-5793(81)81114-3.
- Ameyama M, Matsushita K, Shinagawa E, Hayashi M, Adachi O (1988). «Pyrroloquinoline quinone: excretion by methylotrophs and growth stimulation for microorganisms». BioFactors 1 (1): 51-3. PMID 2855583.
- Rucker R, Chowanadisai W, Nakano M. (2009). «Potential physiological importance of pyrroloquinoline quinone». Altern Med Rev. 14 (3): 179-83.
- Chowanadisai, W.; Bauerly, K. A.; Tchaparian, E.; Wong, A.; Cortopassi, G. A.; Rucker, R. B. (enero de 2010). «Pyrroloquinoline quinone stimulates mitochondrial biogenesis through cAMP response element-binding protein phosphorylation and increased PGC-1alpha expression». Journal of Biological Chemistry 285 (1): 142-152. PMC 2804159. PMID 19861415. doi:10.1074/jbc.M109.030130.
- Lanza, I. R.; Sreekumaran Nair, K. (agosto de 2010). «Regulation of skeletal muscle mitochondrial function: genes to proteins». Acta Physiologica 199 (4): 529-547. PMC 3070482. PMID 20345409. doi:10.1111/j.1748-1716.2010.02124.x.
- Spindler, S. R. (julio de 2010). «Caloric restriction: from soup to nuts». Ageing Research Reviews 9 (3): 324-353. PMID 19853062. doi:10.1016/j.arr.2009.10.003.
- Fujisawa, K.; Nishikawa, T.; Kukidome, D.; Imoto, K.; Yamashiro, T.; Motoshima, H.; Matsumura, T.; Araki, E. (2009). «TZDs reduce mitochondrial ROS production and enhance mitochondrial biogenesis». Biochemical and Biophysical Research Communications 379 (1): 43-48. PMID 19084501. doi:10.1016/j.bbrc.2008.11.141.
- Suwa, M.; Egashira, T.; Nakano, H.; Sasaki, H.; Kumagai, S. (diciembre de 2006). «Metformin increases the PGC-1alpha protein and oxidative enzyme activities possibly via AMPK phosphorylation in skeletal muscle in vivo». Journal of Applied Physiology 101 (6): 1685-1692. PMID 16902066. doi:10.1152/japplphysiol.00255.2006.
- «Entrez Gene: PPARGC1A peroxisome proliferator-activated receptor gamma, coactivator 1 alpha [ Homo sapiens ] GeneID: 10891».
- «Entrez Gene: CREBBP CREB binding protein [ Homo sapiens ] GeneID: 1387».
- Mitsumoto, A; Nakagawa, Y (2001). «DJ-1 is an indicator for endogenous reactive oxygen species elicited by endotoxin». Free radical research 35 (6): 885-93. PMID 11811539. doi:10.1080/10715760100301381.
- Taira, T.; Saito, Y.; Niki, T.; Iguchi-Ariga, S. M. M.; Takahashi, K.; Ariga, H. (febrero de 2004). «DJ-1 has a role in antioxidative stress to prevent cell death». EMBO Reports 5 (2): 213-218. PMC 1298985. PMID 14749723. doi:10.1038/sj.embor.7400074.
- Takatsu, H; Owada, K; Abe, K; Nakano, M; Urano, S (2009). «Effect of vitamin E on learning and memory deficit in aged rats». Journal of nutritional science and vitaminology 55 (5): 389-93. PMID 19926923. doi:10.3177/jnsv.55.389.
- Nakano M, Ubukata K, Yamamoto T, Yamaguchi H. (2009). «Effect of pyrroloquinoline quinone (PQQ) on mental status of middle-aged and elderly persons». Food Style 21 13 (7): 50-52.
- Ohwada, K.; Takeda, H.; Yamazaki, M.; Isogai, H.; Nakano, M.; Shimomura, M.; Fukui, K.; Urano, S. (enero de 2008). «Pyrroloquinoline quinone (PQQ) prevents cognitive deficit caused by oxidative stress in rats». Journal of Clinical Biochemistry and Nutrition 42 (1): 29-34. PMC 2212345. PMID 18231627. doi:10.3164/jcbn.2008005.
- Murase, K; Hattori, A; Kohno, M; Hayashi, K (1993). «Stimulation of nerve growth factor synthesis/secretion in mouse astroglial cells by coenzymes». Biochemistry and molecular biology international 30 (4): 615-21. PMID 8401318.
- Nunome, K; Miyazaki, S; Nakano, M; Iguchi-Ariga, S; Ariga, H (2008). «Pyrroloquinoline quinone prevents oxidative stress-induced neuronal death probably through changes in oxidative status of DJ-1». Biological & Pharmaceutical Bulletin 31 (7): 1321-6. PMID 18591768. doi:10.1248/bpb.31.1321.
- Jensen, FE; Gardner, GJ; Williams, AP; Gallop, PM; Aizenman, E; Rosenberg, PA (1994). «The putative essential nutrient pyrroloquinoline quinone is neuroprotective in a rodent model of hypoxic/ischemic brain injury». Neuroscience 62 (2): 399-406. PMID 7830887. doi:10.1016/0306-4522(94)90375-1.
- Ono, K.; Suzuki, H.; Sawada, M. (5 de octubre de 2010). «Delayed neural damage is induced by iNOS-expressing microglia in a brain injury model». Neuroscience Letters 473 (2): 146-150. PMID 20178828. doi:10.1016/j.neulet.2010.02.041.
- Zhang, Y; Rosenberg, PA (2002). «The essential nutrient pyrroloquinoline quinone may act as a neuroprotectant by suppressing peroxynitrite formation». The European Journal of Neuroscience 16 (6): 1015-24. PMID 12383230. doi:10.1046/j.1460-9568.2002.02169.x.
- Hirakawa, A.; Shimizu, K.; Fukumitsu, H.; Furukawa, S. (9 de enero de 2009). «Pyrroloquinoline quinone attenuates iNOS gene expression in the injured spinal cord». Biochemical and Biophysical Research Communications 378 (2): 308-312. PMID 19026989. doi:10.1016/j.bbrc.2008.11.045.
- Zhang, Y.; Feustel, P.; Kimelberg, H. (13 de junio de 2006). «Neuroprotection by pyrroloquinoline quinone (PQQ) in reversible middle cerebral artery occlusion in the adult rat». Brain Research 1094 (1): 200-206. PMID 16709402. doi:10.1016/j.brainres.2006.03.111.
- Aizenman, E; Hartnett, KA; Zhong, C; Gallop, PM; Rosenberg, PA (1992). «Interaction of the putative essential nutrient pyrroloquinoline quinone with the N-methyl-D-aspartate receptor redox modulatory site». Journal of Neuroscience 12 (6): 2362-9. PMID 1318959.
- Aizenman, E; Jensen, FE; Gallop, PM; Rosenberg, PA; Tang, LH (1994). «Further evidence that pyrroloquinoline quinone interacts with the N-methyl-D-aspartate receptor redox site in rat cortical neurons in vitro». Neuroscience letters 168 (1-2): 189-92. PMID 7518062. doi:10.1016/0304-3940(94)90447-2.
- Scanlon, JM; Aizenman, E; Reynolds, IJ (1997). «Effects of pyrroloquinoline quinone on glutamate-induced production of reactive oxygen species in neurons». European Journal of Pharmacology 326 (1): 67-74. PMID 9178657. doi:10.1016/S0014-2999(97)00137-4.
- Hossain, M. A. (Sep 2005). «Molecular mediators of hypoxic-ischemic injury and implications for epilepsy in the developing brain». Epilepsy & Behavior 7 (2): 204-213. PMID 16054439. doi:10.1016/j.yebeh.2005.05.015.
- Dong, X. X.; Wang, Y.; Qin, Z. H. (abril de 2009). «Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases». Acta Pharmacologica Sinica 30 (4): 379-387. PMID 19343058. doi:10.1038/aps.2009.24.
- Foran, E.; Trotti, D. (julio de 2009). «Glutamate transporters and the excitotoxic path to motor neuron degeneration in amyotrophic lateral sclerosis». Antioxidants & Redox Signaling 11 (7): 1587-1602. PMC 2842587. PMID 19413484. doi:10.1089/ars.2009.2444.
- Zhang, P.; Xu, Y.; Sun, J.; Li, X.; Wang, L.; Jin, L. (marzo de 2009). «Protection of pyrroloquinoline quinone against methylmercury-induced neurotoxicity via reducing oxidative stress». Free Radical Research 43 (3): 224-233. PMID 19191107. doi:10.1080/10715760802677348.
- Mutter J, C. A. (2010). «Does inorganic mercury play a role in Alzheimer's disease? A systematic review and an integrated molecular mechanism». Journal of Alzheimer's Disease 22 (2): 357-374. PMID 20847438. doi:10.3233/JAD-2010-100705.
- Hara, H.; Hiramatsu, H.; Adachi, T. (marzo de 2007). «Pyrroloquinoline quinone is a potent neuroprotective nutrient against 6-hydroxydopamine-induced neurotoxicity». Neurochemical Research 32 (3): 489-495. PMID 17268846. doi:10.1007/s11064-006-9257-x.
- Breese, G. R.; Knapp, D. J.; Criswell, H. E.; Moy, S. S.; Papadeas, S. T.; Blake, B. L. (febrero de 2005). «The neonate-6-hydroxydopamine-lesioned rat: a model for clinical neuroscience and neurobiological principles». Brain Research Reviews 48 (1): 57-73. PMID 15708628. doi:10.1016/j.brainresrev.2004.08.004.
- Kobayashi, M.; Kim, J.; Kobayashi, N.; Han, S.; Nakamura, C.; Ikebukuro, K.; Sode, K. (27 de octubre de 2006). «Pyrroloquinoline quinone (PQQ) prevents fibril formation of alpha-synuclein». Biochemical and Biophysical Research Communications 349 (3): 1139-1144. PMID 16962995. doi:10.1016/j.bbrc.2006.08.144.
- Zhang, J. J.; Zhang, R. F.; Meng, X. K. (30 de octubre de 2009). «Protective effect of pyrroloquinoline quinone against Abeta-induced neurotoxicity in human neuroblastoma SH-SY5Y cells». Neuroscience Letters 464 (3): 165-169. PMID 19699263. doi:10.1016/j.neulet.2009.08.037.
- Kim, J.; Kobayashi, M.; Fukuda, M.; Ogasawara, D.; Kobayashi, N.; Han, S.; Nakamura, C.; Inada, M.; Miyaura, C.; Ikebukuro, K.; Sode, K. (2010). «Pyrroloquinoline quinone inhibits the fibrillation of amyloid proteins». Prion 4 (1): 26-31. PMC 2850417. PMID 20083898. doi:10.4161/pri.4.1.10889.
- Zhu, B. Q.; Zhou, H. Z.; Teerlink, J. R.; Karliner, J. S. (noviembre de 2004). «Pyrroloquinoline quinone (PQQ) decreases myocardial infarct size and improves cardiac function in rat models of ischemia and ischemia/reperfusion». Cardiovascular Drugs and Therapy 18 (6): 421-431. PMID 15770429. doi:10.1007/s10557-004-6219-x.
- Zhu, B. -Q.; Simonis, U.; Cecchini, G.; Zhou, H. -Z.; Li, L.; Teerlink, J. R.; Karliner, J. S. (junio de 2006). «Comparison of pyrroloquinoline quinone and/or metoprolol on myocardial infarct size and mitochondrial damage in a rat model of ischemia/reperfusion injury». Journal of Cardiovascular Pharmacology and Therapeutics 11 (2): 119-128. PMID 16891289. doi:10.1177/1074248406288757.
- Tao, R; Karliner, J; Simonis, U; Zheng, J; Zhang, J; Honbo, N; Alano, C (2007). «Pyrroloquinoline quinone preserves mitochondrial function and prevents oxidative injury in adult rat cardiac myocytes». Biochemical and Biophysical Research Communications 363 (2): 257-62. PMC 2844438. PMID 17880922. doi:10.1016/j.bbrc.2007.08.041.
- Xiong, X. H.; Zhao, Y; Ge, X; Yuan, S. J.; Wang, J. H.; Zhi, J. J.; Yang, Y. X.; Du, B. H.; Guo, W. J.; Wang, S. S.; Yang, D. X.; Zhang, W. C. (2011). «Production and radioprotective effects of pyrroloquinoline quinone». International Journal of Molecular Sciences 12 (12): 8913-23. PMC 3257108. PMID 22272111. doi:10.3390/ijms12128913.
- Felton LM, Anthony C (2005). «Biochemistry: role of PQQ as a mammalian enzyme cofactor?». Nature 433 (7025): E10; discussion E11-2. PMID 15689995. doi:10.1038/nature03322.
- Anthony C. «Chris Anthony/My Research». Consultado el 22 de abril de 2012.
- «O75460».
- «P30043».
- «Q4L235».
- «P09172».
- Kasahara T, Kato T (2005). «Biochemistry: Is pyrroloquinoline quinone a vitamin? (Reply)?». Nature 433 (7025): E11-E12. doi:10.1038/nature03324.