Contaminación marina
La contaminación marina o contaminación del mar es la contaminación que afecta a los mares y a los océanos, desde la zona de rompientes hasta el mar abierto. Incluye lo que se produce en las costas, en los puertos, en las plataformas pesqueras, en la industria, en la navegación y en las zonas marítimas. Tiene un carácter global y requiere convenios internacionales, como MARPOL, y esfuerzos internacionales dirigidos a reducirla y asegurar un desarrollo sostenible del medio marino.

En los años 50, la mayoría de los gobiernos del mundo creían que los océanos tenían la capacidad de desaparecer los desechos plásticos, microplásticos y nucleares los cuales en las últimas décadas han llegado a playas e islas. Una de las islas más afectadas ha sido la reconocida isla de pascu, ya que, esta se encuentra a la altura del ecuador y muy cerca de una de las mayores islas de plásticos del mundo, en los últimos años han llegado cientos de toneladas de microplásticos.
La contaminación marina se produce cuando existen efectos dañinos o introducción de sustancias dañinas que resultan de la introducción al océano de productos químicos, partículas, desechos industriales, agrícolas y residenciales, ruido excesivo o la propagación de organismos invasores. El 80 % de la contaminación marina proviene de la tierra. La contaminación por el aire es también un factor contribuyente al trasladar partículas de pesticidas u otros contaminantes al océano. La contaminación de la tierra y el aire ha demostrado ser perjudicial para la vida marina y sus hábitats.[1]
La contaminación a menudo proviene de fuentes no puntuales como la escorrentía agrícola, el polvo o partículas finas en la atmósfera y desechos arrastrados por el viento. La contaminación por nutrientes es una forma de contaminación del agua que resulta en aportes excesivos de nutrientes. Es una causa primaria de eutrofización de las aguas superficiales en la que el exceso de nutrientes, generalmente nitratos y fosfatos, estimulan el crecimiento desmesurado de algas. Muchos productos químicos potencialmente tóxicos se adhieren a pequeñas partículas que luego son absorbidas por plancton y animales bénticos, la mayoría de los cuales son detritívoros o filtradores. De esta manera, las toxinas se concentran hacia arriba dentro de las cadenas alimentarias marinas. Muchas partículas se combinan químicamente de una manera altamente depletiva de oxígeno, debido a lo cual los estuarios pueden convertirse en aguas anóxicas.
Cuando los plaguicidas se incorporan al ecosistema marino, son rápidamente absorbidos en la red alimentaria marina. Una vez en las redes alimentarias, los plaguicidas pueden causar mutaciones y enfermedades que pueden ser dañinas para los seres humanos y para toda la cadena trófica. Los metales tóxicos, especialmente los metales pesados, también pueden penetrar en las redes alimentarias marinas y causar cambios en los tejidos, la bioquímica, el comportamiento, la reproducción y restringir o suprimir el crecimiento de la vida marina. Además, muchos alimentos para ganado tienen un alto contenido de harina de pescado o hidrolizado de pescado. De esta forma, las toxinas marinas pueden transferirse a los animales terrestres y aparecer en los productos lácteos y la carne consumidos por los humanos.
Historia
Aunque la contaminación marina tiene una larga historia, las primeras leyes internacionales para contrarrestarla solo se promulgaron a partir de mediados del siglo XX. Durante mucho tiempo, la mayoría de los científicos creían que los mares y los océanos eran tan grandes que tenían una capacidad ilimitada para diluir la contaminación y, con ello, neutralizar sus efectos dañinos. Sin embargo, a comienzos de la década de 1950, la contaminación marina se había convertido en una fuente de preocupación que también se manifestó en varias convenciones de las Naciones Unidas sobre el Derecho del Mar.
A finales de la década de 1950 y principios de la década de 1960, surgieron las primeras controversias sobre el vertido de desechos radiactivos en las aguas costeras de los Estados Unidos por compañías autorizadas por la Comisión de Energía Atómica de los Estados Unidos, en el mar de Irlanda por la instalación de una planta de reprocesamiento británica de Windscale, y en el mar Mediterráneo por el Commissariat à l'Energie Atomique francés.
Después de la controversia en el mar Mediterráneo, Jacques Cousteau, entre otros, se convirtió en una destacada figura internacional en la campaña para detener la contaminación marina. La contaminación marina llegó más a los titulares internacionales tras el naufragio del petrolero Torrey Canyon en 1967, y el derrame de petróleo de Santa Bárbara de 1969 en una plataforma petrolífera frente a la costa de California.
La contaminación marina se convirtió en un tema de discusión importante durante la Conferencia de las Naciones Unidas sobre el Medio Humano de 1972, celebrada en Estocolmo. En ese año se firmó la Convención sobre la prevención de la contaminación del mar por vertido de desechos y otras materias, también conocida como el Convenio de Londres. Aunque este convenio no prohibió la contaminación marina, estableció listas negras y grises de las sustancias prohibidas (negras) o reguladas por las autoridades nacionales (grises). Sin embargo, el Convenio de Londres se aplicó únicamente a los desechos vertidos desde los buques y, por lo tanto, no impidió ni reguló la contaminación por los desechos líquidos vertidos sin control por medio de conductos costeros o a través de los ríos.[2]
Vías de contaminación

Las tres principales vías de contaminación de los ecosistemas marinos incluyen la descarga directa de desechos en los mares y océanos, la escorrentía debido a la lluvia y la descarga de los contaminantes en la atmósfera.[3][4]
Descarga directa

Los contaminantes ingresan a los ríos y directamente al mar mediante las descargas urbanas desde el alcantarillado y los conductos de fábricas y factorías para sus desechos industriales, a veces en la forma de desechos peligrosos o tóxicos.
Otra fuente de contaminación marina es la minería tierra adentro, incluyendo la minería de cobre, oro, etc. La mayor parte de la contaminación se compone de tierra que termina en los ríos y que fluye hacia el mar. Sin embargo, algunos minerales descargados en el curso de la extracción minera pueden causar problemas aún más serios, como el cobre, un contaminante industrial común, que puede interferir con el ciclo de vida y el desarrollo de los pólipos de los corales marinos.[5] La minería tiene un pobre historial medioambiental. En los Estados Unidos por ejemplo, la minería ha contaminado partes de las cabeceras fluviales de más del 40 % de las cuencas hidrográficas en el oeste continental del país, según datos de la Agencia de Protección Ambiental de los Estados Unidos.[6] Gran parte de esta contaminación sigue el curso de los ríos y termina en el mar.
La basura y los residuos por parte de quienes visitan las playas sin observar las normas de limpieza produce acumulación de plásticos, microplásticos, botellas, latas, colillas de cigarro, tapones y tapas.
Escorrentía
La escorrentía de tierras agrícolas, así como la de zonas urbanas, incluyendo la construcción de carreteras, edificios, canales y puertos, lleva tierra y partículas cargadas de carbono, nitrógeno, fósforo y minerales. Esta agua rica en nutrientes puede causar la proliferación de algas y fitoplancton en las zonas costeras y producir condiciones de hipoxia por consumir el oxígeno disuelto en el agua. En las aguas costeras del sudoeste de Florida por ejemplo, la proliferación de algas dañinas existe desde hace más de cien años,[7] y ha causado la muerte de peces, tortugas, delfines y camarones; incluso puede tener efectos nocivos en los seres humanos al nadar en estas aguas.[7]
El escurrimiento contaminado proveniente de carreteras y caminos puede ser otra fuente importante de contaminación del agua en las zonas costeras. En la costa oeste de los Estados Unidos por ejemplo, aproximadamente 75 % de los químicos tóxicos que fluyen hacia el estrecho de Puget son acarreados por el agua de lluvia que corre por las carreteras pavimentadas, entradas de vehículos, techos, patios y otros terrenos urbanos.[8] En California, las aguas de escorrentía producidas por las tormentas que ocurren de octubre a marzo y que terminan en el océano Pacífico, contienen petróleo, metales pesados, contaminantes de emisiones, etc.[9]
En China, la zona costera es la más poblada y la escorrentía proveniente de esta zona contribuye en una parte importante a la contaminación del océano que también se ve afectado por la descarga de aguas residuales. En 2001, más de 66.795 mi² de las aguas oceánicas costeras chinas obtuvieron una calificación inferior a la Clase I del Estándar de Calidad del Agua del Mar de China.[10] Gran parte de la contaminación producida por la escorrentía incluía metales tóxicos, cómo Ag, Cu, Cd, Pb, As, así como DDT, PCB, etc.[10]
Contaminación procedente de buques

Los buques pueden contaminar los cursos de agua y los océanos de varias maneras. Los derrames de petróleo pueden tener efectos devastadores. Los hidrocarburos aromáticos policíclicos (PAH) que se encuentran en el petróleo crudo son tóxicos para la vida marina, muy difíciles de limpiar y permanecen durante años en el sedimento y el medio ambiente marino.[11]
En 2019, nuevos estudios científicos indicaron que los barcos de carga chinos podrían ser uno de los mayores contribuyentes de basura oceánica.[12] Un portavoz de Ocean Cleanup declaró que «todo el mundo habla de salvar los océanos al dejar de usar bolsas de plástico, pajitas y envases monouso. Eso es importante, pero cuando salimos al océano, eso no es necesariamente lo que encontramos.»[13]
Los derrames de crudo o petróleo son probablemente los acontecimientos de contaminación marina más conocidos. Sin embargo, aunque el naufragio de un buque petrolero suele resultar en una amplia cobertura en los medios de prensa y comunicación, gran parte del petróleo vertido en los mares del mundo proviene de fuentes menos conspicuas, incluida la descarga de agua de lastre, mezclada con restos de crudo, utilizadas en los tanques de los petroleros durante los viajes de retorno, las fugas en oleoductos y otras tuberías, y el aceite de motor vertido en las alcantarillas.[14]
La descarga de residuos de carga de graneleros puede contaminar los puertos, las vías fluviales y los océanos. En muchos casos, los buques siguen con la descarga de desechos si la legislación que lo prohíbe no está acompañada de medidas que permitan controlar su cumplimiento. La ausencia de normas nacionales sobre la descarga de residuos incluso puede convertirse en un incentivo para cruceros de descargar desechos en lugares donde las sanciones son inadecuadas.[15] Se ha estimado que los buques portacontenedores pierden más de 10 000 contenedores en el mar cada año, generalmente durante tormentas.[16] Los barcos también generan contaminación acústica que puede perturbar la vida silvestre natural; la descarga de aguas de lastre puede diseminar algas dañinas y otras especies invasoras.[17]
Contaminación procedente de la atmósfera
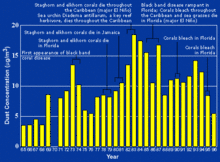
La contaminación marina se produce también a través de la atmósfera. El viento arrastra polvo y escombros, incluyendo bolsas de plástico, hacia el mar desde vertederos y otras zonas terrestres. Polvo proveniente del Sahara se traslada alrededor de la periferia sur de la cresta subtropical hacia el Caribe y Florida durante la temporada cálida cuando la cresta se fortalece, moviéndose hacia el norte a través del Atlántico subtropical. Otro movimiento global de polvo ocurre desde los desiertos Gobi y Taklamakan, por Corea, Japón y el norte del Pacífico a las Islas Hawaianas.[19] El aumento de los períodos de sequía en África a partir de la década de 1970, también ha empeorado el traslado de polvo. Aunque existe una gran variabilidad en el traslado anual de polvo hacia el Caribe,[20] el flujo suele ser mayor durante las fases positivas de la oscilación del Atlántico Norte.[21] El USGS vincula los episodios de descarga de polvo a una disminución en la salud de los arrecifes de coral en todo el Caribe y Florida, principalmente desde la década de 1970.[22]
El calentamiento global conlleva un aumento de la temperatura oceánica[23] y un incremento de los niveles de dióxido de carbono en la atmósfera. Estos niveles crecientes de dióxido de carbono causan la acidificación de los océanos.[24] Esto, a su vez, está alterando los ecosistemas acuáticos y conduce a cambios en las distribuciones de peces,[25] y tiene un impacto significativo en la sostenibilidad de la pesca y en la vida de las comunidades humanas que dependen de ella. Los ecosistemas oceánicos saludables también son importantes para la mitigación de los efectos actuales y futuros del cambio climático.[26][27]
Minería marina
La minería marina es un método de recuperación de mineral del lecho marino relativamente nuevo. Los sitios de minería oceánica generalmente se encuentran alrededor de grandes áreas de nódulos polimetálicos o de fuentes hidrotermales activos y extintos a una profundidad de aproximadamente 1400-3700 metros debajo de la superficie del mar.[28] Estas fuentes hidrotermales producen depósitos de sulfuro, que contienen metales preciosos como plata, oro, cobre, manganeso, cobalto y zinc.[29][30] Los depósitos se extraen mediante bombas hidráulicas o sistemas de cuchara que llevan el mineral a la superficie para su procesamiento. Al igual que otras operaciones mineras, la minería en aguas profundas plantea preguntas sobre el riesgo de daños ambientales a las áreas circundantes.
Como la minería de aguas profundas es un campo relativamente nuevo, aún no se conocen todas las consecuencias de las operaciones de minería a gran escala. Sin embargo, expertos señalan que la eliminación de partes del lecho marino provocará disturbios en la capa béntica, un aumento de la toxicidad de la columna de agua y las columnas de sedimentos de los relaves,[29] y dependiendo del tipo de extracción y su ubicación, estas perturbaciones del hábitat de los organismos bentónicos podrían ser permanentes.[28] Además del impacto directo de la minería en el área, las fugas, los derrames y la corrosión alterarían la composición química de la zona minera.
Se cree que las columnas o plumas de sedimento podrían constituir el mayor impacto ambiental de la minería de aguas profundas. Las columnas de sedimento se producen cuando los relaves de la minería (generalmente partículas finas) se vuelcan al océano, creando una nube de partículas suspendidas en el agua. Se distinguen dos tipos de columnas de sedimento: las que ocurren cerca del lecho marino y las que se producen en la superficie.[28] Las columnas de sedimento cerca del fondo marino se producen cuando los relaves se bombean de vuelta en la zona minera. Las partículas suspendidas aumentan la turbidez del agua, obstruyendo el aparato de alimentación por filtración utilizado por los organismos bentónicos.[31] Las columnas o plumas superficiales causan un problema más serio. Dependiendo del tamaño de las partículas y las corrientes de agua, podrían extenderse sobre vastas áreas.[28][32] Las columnas de sedimento pueden afectar al zooplancton y a la penetración de la luz, lo que a su vez afecta a la red alimentaria de la zona.[28][32]
Tipos de contaminación
Acidificación

Los océanos son el principal sumidero natural de carbono y absorben una parte importante del dióxido de carbono en la atmósfera. Como los niveles de dióxido de carbono atmosférico están aumentando, los océanos están volviéndose más ácidos.[34][35] Aunque aún no se conocen todas las consecuencias de la acidificación de los océanos, existe preocupación de que afecte todas las estructuras hechas de carbonato de calcio susceptibles a la disolución, como los corales y los moluscos bivalvos.[36]
Los océanos y los ecosistemas costeros desempeñan un papel importante en el ciclo global del carbono y han almacenado aproximadamente 25 % del dióxido de carbono emitido por las actividades humanas entre 2000 y 2007 y aproximadamente la mitad del CO2 antropogénico emitido desde el comienzo de la revolución industrial. El aumento de las temperaturas oceánicas y la acidificación de los océanos reduce la capacidad de absorción de carbono de los océanos y su función como sumidero se debilitará gradualmente,[37] dando lugar a preocupaciones globales expresadas en las declaraciones de Mónaco[38][39] y Manado.[40]
Según un informe de los científicos de la NOAA publicado en la revista Science en mayo de 2008, un gran volumen de agua relativamente acidificada del océano Pacífico estaba aflorando dentro de cuatro millas de la plataforma continental de América del Norte. Esta zona es un área crítica donde vive o nace la mayor parte de la vida marina local. Si bien el documento se limitaba a la zona desde Vancouver hasta el norte de California, otras áreas de la plataforma continental pueden estar experimentando efectos similares.[41]
Una cuestión relacionada es la de los depósitos de hidrato de metano que se encuentran debajo de los sedimentos en los fondos oceánicos. Estos almacenan grandes cantidades de metano, un gas de efecto invernadero; sin embargo, existe la posibilidad de que el calentamiento oceánico libere el metano contenido en estos depósitos. En 2004 se estimó que el inventario mundial de hidrato de metano oceánico ocupaba entre uno y cinco millones de kilómetros cúbicos.[42] Si todos estos hidratos de metano se distribuyeran uniformemente en el fondo de los océanos, alcanzarían un espesor de entre tres y catorce metros.[43] Esta estimación corresponde a 500-2500 gigatoneladas de carbono (Gt C), y puede compararse con las 5000 Gt C estimadas para todas las demás reservas de combustibles fósiles.[42][44]
Eutrofización

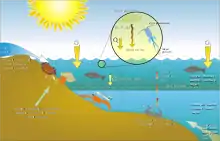
La eutrofización se refiere a un aumento de los nutrientes químicos, típicamente compuestos que contienen nitrógeno o fósforo, en un ecosistema. Puede resultar en un aumento en la productividad primaria del ecosistema (crecimiento excesivo de plantas y su rápida descomposición) y otros efectos, incluida la falta de oxígeno y las graves reducciones en la calidad del agua, que afecta a los peces y otras poblaciones de animales y plantas acuáticas.
Los ríos forman la mayor fuente de eutrofización ya que al desembocar en los mares y océanos acarrean muchos productos químicos utilizados como fertilizantes en la agricultura, así como desechos orgánicos del ganado y de los seres humanos. El exceso de sustancias químicas que agotan el oxígeno en el agua puede provocar hipoxia y culminar en áreas muertas.[45]
Los estuarios tienden a ser eutróficos porque los nutrientes provenientes de la tierra suelen concentrarse donde la escorrentía ingresa al medio marino en un canal confinado. El World Resources Institute ha identificado 375 zonas costeras hipóxicas en el mundo, que se concentran en Europa occidental, el este y sur de Estados Unidos y el este de Asia, especialmente en Japón.[46] En el golfo de México y otras zonas eutróficas ocurren regularmente las llamadas mareas rojas [47] que causan la muerte de los peces y los mamíferos marinos, y que pueden causar problemas respiratorios en los seres humanos y los animales domésticos cuando la proliferación de algas se produce cerca de la orilla del mar.[cita requerida]
Otra fuente de eutrofización en los océanos es la fijación de nitrógeno antropogénico proveniente de la atmósfera. Un estudio realizado en 2008 demostró que esto podría representar alrededor de un tercio del suministro de nitrógeno externo (no reciclado) del océano, y hasta el tres por ciento de la nueva producción biológica marina anual.[48] Se ha sugerido que la acumulación de nitrógeno reactivo en el medio ambiente puede tener consecuencias tan graves como la emisión de dióxido de carbono en la atmósfera.[49]
Una de las soluciones propuestas contra la eutrofización en los estuarios es la restauración de las poblaciones de moluscos bivalvos, como las ostras. Los arrecifes de ostras eliminan el nitrógeno de la columna de agua y filtran los sólidos en suspensión, lo que reduce la probabilidad o el alcance de las proliferaciones de algas nocivas o de las condiciones anóxicas.[50] Se considera que la alimentación por filtración de las ostras y otros bivalvos beneficia la calidad del agua[51] puesto que contribuye en controlar la densidad del fitoplancton y almacenar los nutrientes, que pueden eliminarse del sistema a través de la recolección de los moluscos bivalvos, o al enterrarse en los sedimentos o perderse por desnitrificación.[52][53] El trabajo fundacional hacia la idea de mejorar la calidad del agua marina a través del cultivo de moluscos bivalvos fue realizado por Odd Lindahl et al. en Suecia, utilizando mejillones.[54]
Desechos plásticos


Los desechos marinos se componen principalmente de desechos tirados o abandonados por los seres humanos que terminan flotando en el océano. El ochenta por ciento de los desechos marinos se componen de material plástico, un componente que ha ido acumulándose rápidamente desde finales del siglo XX.[55] Se estima que la masa de plástico acumulado en los océanos puede haber alcanzado 100 000 000 de toneladas (98 000 000 de toneladas largas; 110 000 000 de toneladas cortas) por el año 2008.[56]
China, Indonesia, las Filipinas, Tailandia, y Vietnam descargan más residuos plásticos al mar que todos los demás países del mundo juntos.[57] Los Ríos Yangtze (China), Indo (Pakistán), Amarillo (China), Hai (China), Nilo (Egipto), Ganges (India), de las Perlas (China), Amur (Sino-ruso), Níger (Nigeria), y Mekong (Vietnam) descargan el 95 % de los plásticos que invaden los océanos.[58][59]
Las bolsas de plástico desechadas, los anillos six-pack y otros desechos de plástico que terminan en el océano constituyen un peligro para la vida silvestre y la pesquería.[60] Las amenazas para la vida acuática incluye el enredo, la asfixia y la ingestión de plástico.[61][62][63] Las redes de pesca, usualmente hechas de plástico desde mediados del siglo XX, pueden ser abandonadas o perdidas en el océano por los pescadores. Conocidas como redes fantasma, enredan peces, delfines, tortugas marinas, tiburones, dugongos, cocodrilos, aves marinas, cangrejos y otros animales marinos, restringiendo el movimiento, causando inanición, laceración, infección, y también la sofocación en aquellos que necesitan subir a la superficie para respirar.[64]

Muchos animales que viven en la superficie o dentro del mar ingieren restos de plástico que a menudo se parecen a sus presas naturales.[65] Cuando son relativamente voluminosos o enredados, estos desechos plásticos a menudo se atascan en el tracto digestivo. Especialmente los animales con adaptaciones evolutivas en la garganta que sirven para evitar que las presas resbaladizas puedan escapar, no logran deshacerse de los objetos de plástico atascados. Las tortugas marinas, por ejemplo, a menudo ingieren bolsas de plástico sumergidas, suspendidas en el agua, ya que se parecen a las medusas, una de sus principales presas;[66] como bloquean el paso de los alimentos, causan la muerte por inanición o infección.[67][68]
Los desechos de plástico se acumulan porque no se biodegradan del mismo modo que otras substancias. Con el tiempo se degradarán al ser expuestos al sol, pero solo lo harán en condiciones secas, puesto que el agua inhibe el proceso de fotodegradación.[69] En ambientes marinos, el plástico fotodegradado se desintegra en piezas cada vez más pequeñas que permanecen polímeros, incluso hasta alcanzar el tamaño molecular. Cuando las partículas de plástico flotantes o suspendidas en el agua se fotodegradan hasta el tamaño del zooplancton, los animales marinos, como las medusas, intentan consumirlas, y de esta manera el plástico ingresa en la cadena alimentaria marina.[70][71] Piezas de plástico terminan a menudo en los estómagos de aves y otros animales marinos,[72] como las tortugas marinas y los albatros de patas negras.[73]
Los desechos marinos tienden a acumularse en el centro de los giros oceánicos. La «mancha o isla de basura del Pacífico» tiene un nivel muy elevado de fragmentos y partículas de plástico suspendidos en la columna de agua superior. En muestras tomadas en 1999, la masa de plástico superó seis veces la del zooplancton, la vida animal dominante en el área.[55][74] Las islas Midway, al igual que las islas hawaianas, reciben una parte importante de los desechos de la mancha de basura. El noventa por ciento de esta basura se compone de plástico que se acumula en las playas de Midway, donde se convierte en un peligro para las poblaciones de aves de la isla. Las islas Midway albergan dos tercios (1 500 000) de la población mundial de los albatros de Laysan.[75] Casi todos estos albatros tienen fragmentos de plástico en su sistema digestivo[76] y un tercio de sus polluelos mueren.[77]
Los aditivos tóxicos utilizados en la fabricación del plástico pueden transferirse al entorno en cuanto son expuestos al agua. En el agua, los contaminantes hidrófobos se concentran y se magnifican en la superficie de los desechos plásticos,[56] haciendo que el plástico sea mucho más dañino para la salud en el océano de lo que sería en tierra.[55] Los contaminantes hidrófobos también tienden a bioacumularse en los tejidos grasos de los animales, y con ello se biomagnifican en la cadena alimentaria y afectan especialmente a los superpredadores. Se ha comprobado que algunos de estos aditivos plásticos interrumpen el sistema endocrino cuando se consumen, otros pueden suprimir el sistema inmune o disminuir las tasas de reproducción.[74] Los desechos flotantes también pueden absorber contaminantes orgánicos persistentes del agua de mar, incluidos PCB, DDT y PAH.[78] Además de los efectos tóxicos,[79] cuando se ingieren, algunos de estos aditivos afectan a las células cerebrales de los animales de manera similar al estradiol, y provocan disturbios hormonales en los animales afectados.[73] También se descubrió que durante el proceso de descomposición del plástico se transfieren al agua substancias tóxicas, como el bisfenol A (BPA) y el oligómero PS.[80]
Una preocupación creciente con respecto a la contaminación por los desechos plásticos en el ecosistema marino es la aparición del microplástico. Los microplásticos son diminutas partículas de plástico aproximadamente de menos de 5 milímetros de diámetro. Es un aditivo común en jabones de manos, limpiadores faciales y otros exfoliantes desde la década de 2000. Cuando los consumidores utilizan estos productos, los microplásticos pasan por el sistema de alcantarillado y por cursos de agua y los ríos a los océanos; debido a su diminuto tamaño, es probable que no sean capturados en las plantas de tratamiento de aguas residuales.[81] Los microsplásticos son dañinos para todos los organismos, y en el ambiente marino especialmente para los que se alimentan por filtración, ya que pueden fácilmente ingerir el plástico.
La presencia de pequeños fragmentos de plástico en el océano Atlántico Norte se destacó en la década de 1970 (Cole et al., 2011), pero atrajo la mínima atención de la comunidad científica (Andrady, 2011). Sin embargo, los períodos prolongados de exposición a luz solar puede provocar la fotodegradación de los plásticos en el océano, ya que la radiación UV de la luz solar provoca la oxidación de la matriz polimérica (Barnes et al., 2009. Según Andrady (2011), la degradación de los plásticos se clasifica de forma diferente dependiendo de la causa:
a) Biodegradación: la acción de organismos vivos, generalmente microbios. b) Fotodegradación: la acción de la luz (luz solar habitual en la exposición exterior). c) Degradación termo-oxidativa: descomposición oxidativa lenta a temperaturas moderadas. d) Degradación térmica: acción de las altas temperaturas. e) Hidrólisis: reacción con el agua.
Toxinas
Además de los plásticos, también existen problemas con otras toxinas que no se desintegran rápidamente en el medio marino, incluyendo toxinas persistentes como PCB, DDT, TBT, pesticidas, furanos, dioxinas, fenoles y residuos radiactivos. Los metales pesados son elementos químicos metálicos que tienen una densidad relativamente alta y son tóxicos o venenosos a bajas concentraciones. Ejemplos son el mercurio, plomo, níquel, arsénico y cadmio. Estas toxinas pueden acumularse en los tejidos de muchas especies marinas en un proceso conocido como bioacumulación. También se acumulan en ambientes bentónicos, como los estuarios y en los sedimentos de las bahías, que se convirtieron en un registro geológico de las actividades humanas del siglo XX.
- Ejemplos específicos
- Debido a su alta posición en la cadena alimenticia, y la consiguiente acumulación de metales pesados de su dieta, las especies de peces mayores, como el atún rojo y el albacora, pueden tener altos niveles de mercurio en sus tejidos. Por esta razón, en marzo de 2004, la FDA estadounidense decidió emitir directrices, en la que recomendó que las mujeres embarazadas, las madres lactantes y los niños limitaran su consumo de atún y otras especies de peces depredadores.[82]
- Algunos moluscos bivalvos y cangrejos pueden sobrevivir en ambientes contaminados, acumulando metales pesados o toxinas en sus tejidos. Por ejemplo, el cangrejo de Shanghái tiene una notable capacidad para sobrevivir en un hábitat acuático altamente modificado, incluyendo aguas contaminadas.[83] El cultivo y la recolección de tales especies requiere un manejo cuidadoso si van a utilizarse como alimento.[84][85]
- La escorrentía agrícola contaminada con residuos de pesticidas puede causar cambios genéticos que transforman el género de especies de peces de machos en hembras.[86]
- Desde el final de la Segunda Guerra Mundial, varios países, incluido la Unión Soviética, el Reino Unido, los Estados Unidos y Alemania, han vertido los restos tóxicos de sus armas químicas en el mar Báltico, lo que da lugar a preocupaciones sobre la contaminación ambiental causada.[87][88]
- En 2005, la 'Ndrangheta, un sindicato de la mafia italiana, fue acusado de hundir al menos 30 barcos cargados con desechos tóxicos, en gran parte radiactivos. Dio lugar a investigaciones extensas sobre los vertidos ilegales de residuos nucleares.[89]
- El daño a la planta de energía nuclear Fukushima Dai-ichi en 2011, resultó en la emisión de residuos radiactivos en la atmósfera y en el océano. Todavía hay muchos isótopos en el océano, que afectan directamente a la red alimentaria bentónica y la cadena alimentaria más amplia. La concentración de 137C en el sedimento del fondo marino contaminado por agua con altas concentraciones en abril-mayo de 2011 fue muy elevada y solo muestra signos de disminución muy lenta.[90]

Ruido submarino
Los animales marinos pueden ser afectados por la contaminación acústica, es decir el ruido submarino producido por el tráfico marítimo, las detonaciones de cargas durante exploraciones geosísmicas petroleras y el sonar naval de baja frecuencia. En el mar, los sonidos se desplazan con mayor velocidad y sobre distancias mayores que en la atmósfera. Los animales marinos, como los cetáceos, a menudo tienen una vista débil y viven en un mundo principalmente definido por información acústica. Esto se aplica también a muchos peces que permanecen en la oscuridad de las zonas más profundas del mar.[91] Entre 1950 y 1975, el ruido ambiental medido en un sitio en el océano Pacífico aumentó en aproximadamente diez decibelios, es decir, un aumento de intensidad diez veces mayor a la medición inicial.[92][93]
Un aumento del ruido submarino hace que las especies se comuniquen con un volumen más fuerte, un fenómeno conocido como respuesta vocal de Lombard o fenómeno de Lombard.[94] También se observó que los cantos de las ballenas se vuelven más largos cuando las instalaciones de sonar para detectar los submarinos están encendidas.[95] Si los animales marinos no «hablan» lo suficientemente alto, su voz puede ser enmascarada por los sonidos antropogénicos. Estas voces inauditas podrían ser advertencias, hallazgos de presas o preparaciones para una caza coordinada. Sin embargo, cuando una especie comienza a «hablar más fuerte», enmascara las voces de otras especies, haciendo que todo el ecosistema finalmente hable más fuerte.[96]
De acuerdo con la oceanógrafa Sylvia Earle, «la contaminación acústica submarina es como la muerte por mil cortes. Cada sonido en sí mismo puede no ser una cuestión de importancia crítica, pero tomados en conjunto, el ruido de la navegación marítima, las exploraciones geosísmicas y la actividad militar, están creando un entorno totalmente diferente del que existía hace cincuenta años. Ese alto nivel del ruido tendrá evidentemente un fuerte impacto en la vida en el mar».[97]
El ruido producido por el tráfico marítimo y otras actividades humanas también puede ser dañino para los cnidarios y ctenóforos, grupos de organismos muy importantes en el ecosistema marino. Fomentan una gran diversidad y, por sus estructuras simples, se utilizan como modelos para la ecología y la biología. Las vibraciones causadas por el ruido submarino dañan los pelos de los cilios en los celentéreos. En un estudio se comprobó que en los organismos que fueron repetidamente expuestos a ondas de sonido submarino, se observaron células ciliadas dañadas, extruidas o eliminadas o que se presentaron doblados, flácidos, o careciendo de cinocilios y estereocilios.[98]
Adaptación y mitigación
Gran parte de la contaminación antropogénica termina en el océano. La edición de 2011 del Anuario del Programa de las Naciones Unidas para el Medio Ambiente identifica como una de los principales problemas ambientales emergentes la pérdida al océano de grandes cantidades de fósforo, «un fertilizante valioso necesario para alimentar a una creciente población mundial», y el impacto que tienen los miles de millones de piezas de desechos de plástico a nivel mundial para los ambientes marinos.[99] Bjorn Jennssen (2003) afirma que «La contaminación antropogénica puede reducir la biodiversidad y la productividad de los ecosistemas marinos, resultando en la reducción y el agotamiento de los recursos alimentarios marinos humanos».[100] Existen dos formas en que se puede mitigar el nivel general de esta contaminación: o bien se reduce la población humana, o bien se encuentra una forma de reducir la huella ecológica del ser humano promedio. Si no se adopta la segunda vía, entonces la primera puede imponerse a medida que desfallezcan los ecosistemas del planeta.
La segunda vía implica que los humanos, individualmente, contaminen menos. Eso requiere voluntad social y política, junto con un cambio de conciencia para que más personas respeten el medio ambiente y estén menos dispuestas a abusar de él lo que empezó a implementarse desde la década de 2010 al hacerse más obvios los efectos del cambio climático global.[101] A nivel operativo, implica la creación de regulaciones y la participación de los gobiernos a nivel internacional.[102] Como la contaminación se extiende más allá de las fronteras nacionales, requiere de un esfuerzo internacional para crear las reglamentaciones que permiten reducirla.[103]
Convenios internacionales
- Convenio internacional para prevenir la contaminación de las aguas del mar por hidrocarburos, el primero sobre este tema, se aprobó en 1954, y en 1959 la OMI asumió la responsabilidad de administrarlo. A finales de los años sesenta se tomaron nuevas medidas a raíz de una serie de graves accidentes involucrando petroleros. Desde entonces la OMI ha adoptado numerosas medidas para prevenir los accidentes y derrames de petróleo en el mar, minimizar sus consecuencias y luchar contra la contaminación marina, incluida la causada por el vertido de desechos generados por actividades en tierra.
- Convenio internacional relativo a la intervención en alta mar en casos de accidentes que causen una contaminación por hidrocarburos (1969).
- Convenio sobre la prevención de la contaminación del mar por vertimiento de desechos y otras materias (1972).[104]
- Convenio internacional sobre cooperación, preparación y lucha contra la contaminación por hidrocarburos (1990).
- Convenio Internacional para prevenir la contaminación por los Buques (1973).
- Modificado por su protocolo de 1978 (MARPOL 73/78).
- Enmiendas al convenio, aprobadas en 1992.
- Modificado por su protocolo de 1978 (MARPOL 73/78).
- Convenio internacional de responsabilidad civil por daños causados por contaminación de las aguas por hidrocarburos.
- Convenio internacional para la constitución de un fondo internacional de indemnización de daños causados por la contaminación de hidrocarburos.
- Convención de las Naciones Unidas sobre el Derecho del Mar (1982).
- Convenio de Estocolmo sobre los contaminantes orgánicos persistentes (2004).
- Convenios regionales
- Convenio de Barcelona para la protección del Mar Mediterráneo (1976).
- Enmiendas al convenio, aprobadas en 1995.
- Convención sobre cooperación para la protección y el desarrollo del medio marino y las zonas costeras de la región de África occidental y central (1981).[105]
- Convención para la Conservación de Recursos Vivos Marinos Antárticos (1982).
- Convención Regional para la Conservación del Mar Rojo y del Golfo de Adén (1982).[106]
- Convenio para la protección y el desarrollo del medio marino en la región del Gran Caribe o Convenio de Cartagena (1983).[107]
- Convenio para la protección, la ordenación y el desarrollo del medio marino y costero en la región de África oriental (1985).[105]
- Acuerdo de la ASEAN para la conservación de la naturaleza y de los recursos naturales (1985).[105]
- Convención para la Protección del Medio Ambiente Marino del Atlántico del Nordeste (1998).
Véase también
- Contaminación hídrica
- Impacto ambiental potencial del desarrollo de petróleo y gas costa afuera
- Barcos tóxicos
- Organización Marítima Internacional
- Día Mundial de los Océanos
Referencias
- US Department of Commerce, National Oceanic and Atmospheric Administration. «What is pollution in the ocean?». oceanservice.noaa.gov (en inglés). Consultado el 22 de noviembre de 2015.
- Hamblin, Jacob Darwin (2008). Poison in the Well: Radioactive Waste in the Oceans at the Dawn of the Nuclear Age (en inglés). Rutgers University Press. ISBN 978-0-8135-4220-1.
- Patin, S.A. «Anthropogenic impact in the sea and marine pollution». offshore-environment.com (en inglés).
- Véase también Patin, S.A. Pollution and the Biological Resources of the Oceans (en inglés). Butterworths.
- Young, Emma (2003). «Copper decimates coral reef spawning» (en inglés). Consultado el 26 de agosto de 2006.
- Environmental Protection Agency. «Liquid Assets 2000: Americans Pay for Dirty Water» (en inglés). Archivado desde el original el 15 de mayo de 2008. Consultado el 23 de enero de 2007.
- Weis, Judith S.; Butler, Carol A., eds. (2009). Salt Marshes. A Natural and Unnatural History (en inglés). Rutgers University Press. pp. 117-149. ISBN 9780813545486.
- «Control of Toxic Chemicals in Puget Sound, Phase 2: Development of Simple Numerical Models» (en inglés). Washington State Department of Ecology. 2008. Archivado desde el original el 2 de marzo de 2017. Consultado el 10 de diciembre de 2009.
- Holt, Benjamin; Trinh, Rebecca; Gierach, Michelle M. (15 de mayo de 2017). «Stormwater runoff plumes in the Southern California Bight: A comparison study with SAR and MODIS imagery». Marine Pollution Bulletin 118 (1): 141-154. doi:10.1016/j.marpolbul.2017.02.040.
- Daoji, Li; Daler, Dag (2004). «Ocean Pollution from Land-Based Sources: East China Sea, China». Ambio 33 (1/2): 107-113. doi:10.2307/4315461.
- Panetta, L.E. (Chair) (2003). America's living oceans: charting a course for sea change (PDF) (en inglés). Pew Oceans Commission.
- Ryan, Peter G.; Dilley, Ben J.; Ronconi, Robert A.; Connan, Maëlle (25 de septiembre de 2019). «Rapid increase in Asian bottles in the South Atlantic Ocean indicates major debris inputs from ships». Proceedings of the National Academy of Sciences: 201909816. PMID 31570571. doi:10.1073/pnas.1909816116 – via www.pnas.org.
- «Ocean plastic waste probably comes from ships, report says». AFP.com.
- Farmer, Andrew (1997). Managing Environmental Pollution (en inglés). Psychology Press. ISBN 0415145155.
- Schulkin, A. (2002). "Safe «Harbours: Creating an International Solution to Cruise Ship Pollution». Georgetown International Environmental Law Review (en inglés) 15 (1): 105-132.
- Podsadam, Janice (19 de junio de 2001). «Lost Sea Cargo: Beach Bounty or Junk?» (en inglés). National Geographic News. Consultado el 8 de abril de 2008.
- Meinesz, A. (2003). «Deep Sea Invasion: The Impact of Invasive Species» (en inglés). PBS: NOVA. Consultado el 26 de noviembre de 2009.
- «Coral Mortality and African Dust: Barbados Dust Record: 1965-1996» (en inglés). United States Geological Survey. Consultado el 10 de diciembre de 2009.
- Duce, R. A.; Unni, C. K.; Ray, B. J.; Prospero, J. M.; Merrill, J. T. (1980). «Long-Range Atmospheric Transport of Soil Dust from Asia to the Tropical North Pacific: Temporal Variability». Science (en inglés) 209 (4464): 1522-4. Bibcode:1980Sci...209.1522D. PMID 17745962. doi:10.1126/science.209.4464.1522.
- «Study Says African Dust Affects Climate in U.S., Caribbean» (en inglés). Usinfo.state.gov. Archivado desde el original el 22 de junio de 2012. Consultado el 10 de junio de 2007.
- Prospero, J. M.; Nees, R. T. (1986). «Impact of the North African drought and El Niño on mineral dust in the Barbados trade winds». Nature (en inglés) 320 (6064): 735-738. Bibcode:1986Natur.320..735P. doi:10.1038/320735a0.
- «Coral Mortality and African Dust» (en inglés). United States Geological Survey. Archivado desde el original el 2 de mayo de 2012. Consultado el 10 de junio de 2007.
- Observations: Oceanic Climate Change and Sea Level Archivado el 13 de mayo de 2017 en Wayback Machine. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. (15MB)
- Doney, S. C. (2006) "The Dangers of Ocean Acidification" Scientific American, marzo de 2006
- Cheung, W.W.L., et al (2009). «Redistribution of Fish Catch by Climate Change. A Summary of a New Scientific Analysis». Pew Ocean Science Series (en inglés). Archivado desde el original el 26 de julio de 2011. Consultado el 2 de diciembre de 2009.
- «Global Partnership Climate, Fisheries and Aquaculture» (en inglés). PACFA. 2009. Archivado desde el original el 15 de diciembre de 2009. Consultado el 12 de diciembre de 2009.
- «Fisheries and Aquaculture in a Changing Climate» (en inglés). FAO.
- Ahnert, A.; Borowski, C. (2000). «Environmental risk assessment of anthropogenic activity in the deep-sea». Journal of Aquatic Ecosystem Stress and Recovery (en inglés) 7 (4): 299-315. doi:10.1023/A:1009963912171.
- Halfar, J.; Fujita, R. M. (2007). «ECOLOGY: Danger of Deep-Sea Mining». Science 316 (5827): 987. PMID 17510349. doi:10.1126/science.1138289.
- Glasby, G. P. (2000). «ECONOMIC GEOLOGY: Lessons Learned from Deep-Sea Mining». Science 289 (5479): 551-3. PMID 17832066. doi:10.1126/science.289.5479.551.
- Sharma, R. (2005). «Deep-Sea Impact Experiments and their Future Requirements». Marine Georesources & Geotechnology (en inglés) 23 (4): 331-338. doi:10.1080/10641190500446698.
- Nath, B. N.; Sharma, R. (2000). «Environment and Deep-Sea Mining: A Perspective». Marine Georesources & Geotechnology 18 (3): 285-294. doi:10.1080/10641190009353796.
- Coral reefs around the world The Guardian, 2 de septiembre de 2009
- Orr, J. C.; Fabry, V. J.; Aumont, O.; Bopp, L.; Doney, S. C.; Feely, R. A.; Gnanadesikan, A.; Gruber, N.; Ishida, A.; Joos, F.; Key, R. M.; Lindsay, K.; Maier-Reimer, E.; Matear, R.; Monfray, P.; Mouchet, A.; Najjar, R. G.; Plattner, G. K.; Rodgers, K. B.; Sabine, C. L.; Sarmiento, J. L.; Schlitzer, R.; Slater, R. D.; Totterdell, I. J.; Weirig, M. F.; Yamanaka, Y.; Yool, A. (2005). «Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms». Nature (en inglés) 437 (7059): 681-686. Bibcode:2005Natur.437..681O. PMID 16193043. doi:10.1038/nature04095.
- Key, R. M.; Kozyr, A.; Sabine, C. L.; Lee, K.; Wanninkhof, R.; Bullister, J. L.; Feely, R. A.; Millero, F. J.; Mordy, C.; Peng, T. -H. (2004). «A global ocean carbon climatology: Results from Global Data Analysis Project (GLODAP)». Global Biogeochemical Cycles (en inglés) 18 (4): n/a. Bibcode:2004GBioC..18.4031K. doi:10.1029/2004GB002247.
- Raven, J. A. et al. (2005). Ocean acidification due to increasing atmospheric carbon dioxide. Archivado el 27 de septiembre de 2007 en Wayback Machine. Royal Society, London, UK
- «Blue Carbon. The role of healthy oceans in binding carbon» (en inglés). UNEP, FAO, IOC. 2009. Archivado desde el original el 5 de septiembre de 2011. Consultado el 30 de marzo de 2018.
- «Monaco Declaration» (en inglés). Archivado desde el original el 6 de febrero de 2009. Consultado el 2 de diciembre de 2009.
- «Ocean Acidification. A Summary for Policymakers from the Second Symposium on the Ocean in a High-CO2 World» (en inglés). Intergovernmental Oceanographic Commission of UNESCO, International Geosphere-Biosphere Programme, Marine Environment Laboratories (MEL) of the International Atomic Energy Agency, Scientific Committee on Oceanic Research. 2008. Archivado desde el original el 23 de septiembre de 2010. Consultado el 2 de diciembre de 2009.
- «Manado Ocean Declaration». World Ocean Conference Ministerial/High Level Meeting. Manado, Indonesia, 11-14 de mayo de 2009 (en inglés). Archivado desde el original el 3 de noviembre de 2013. Consultado el 30 de marzo de 2018.
- Feely, R. A.; Sabine, C. L.; Hernandez-Ayon, J. M.; Ianson, D.; Hales, B. (2008). «Evidence for Upwelling of Corrosive "Acidified" Water onto the Continental Shelf». Science (en inglés) 320 (5882): 1490-2. Bibcode:2008Sci...320.1490F. PMID 18497259. doi:10.1126/science.1155676.
- Milkov, A. V. (2004). «Global estimates of hydrate-bound gas in marine sediments: How much is really out there?». Earth-Science Reviews 66 (3-4): 183-197. Bibcode:2004ESRv...66..183M. doi:10.1016/j.earscirev.2003.11.002.
- Los océanos tienen una extensión de 361 000 000 km² (trescientos sesenta y un millones de kilómetros cuadrados).
- USGS World Energy Assessment Team, 2000. US Geological Survey world petroleum assessment 2000-–description and results. USGS Digital Data Series DDS-60
- Gerlach, S. A. (1975) Marine Pollution, Springer, Berlin
- Selman, Mindy (2007). Eutrophication: An Overview of Status, Trends, Policies, and Strategies (en inglés). World Resources Institute.
- Carlisle, Elizabeth (1 de mayo de 2000). «The Gulf of Mexico Dead Zone and Red Tides» (en inglés). Consultado el 27 de diciembre de 2006.
- Duce, R. A.; Laroche, J.; Altieri, K.; Arrigo, K. R.; Baker, A. R.; Capone, D. G.; Cornell, S.; Dentener, F.; Galloway, J.; Ganeshram, R. S.; Geider, R. J.; Jickells, T.; Kuypers, M. M.; Langlois, R.; Liss, P. S.; Liu, S. M.; Middelburg, J. J.; Moore, C. M.; Nickovic, S.; Oschlies, A.; Pedersen, T.; Prospero, J.; Schlitzer, R.; Seitzinger, S.; Sorensen, L. L.; Uematsu, M.; Ulloa, O.; Voss, M.; Ward, B.; Zamora, L. (2008). «Impacts of Atmospheric Anthropogenic Nitrogen on the Open Ocean». Science 320 (5878): 893-7. Bibcode:2008Sci...320..893D. PMID 18487184. doi:10.1126/science.1150369.
- «Addressing the nitrogen cascade». EurekAlert Science News (en inglés). American Association for the Advancement of Science. 15 de mayo de 2008.
- Kroeger, Timm (2012). Dollars and Sense: Economic Benefits and Impacts from two Oyster Reef Restoration Projects in the Northern Gulf of Mexico Archivado el 4 de marzo de 2016 en Wayback Machine.. TNC Report
- Burkholder, JoAnn M. and Shumway, Sandra E. (2011). "Bivalve shellfish aquaculture and eutrophication". In: Shellfish Aquaculture and the Environment. Ed. Sandra E. Shumway. John Wiley & Sons
- Kaspar, H. F.; Gillespie, P. A.; Boyer, I. C.; MacKenzie, A. L. (1985). «Effects of mussel aquaculture on the nitrogen cycle and benthic communities in Kenepuru Sound, Marlborough Sounds, New Zealand». Marine Biology 85 (2): 127-136. doi:10.1007/BF00397431.
- Newell, R.I.E.; Cornwell, J.C.; Owens, M.S. (2002). «Influence of simulated bivalve biodepositon and microphytobenthos on sediment nitrogen dynamics, a laboratory study». Limnology & Oceanography 47 (5): 1367-1379. doi:10.4319/lo.2002.47.5.1367.
- Lindahl, O.; Hart, R.; Hernroth, B.; Kollberg, S.; Loo, L. O.; Olrog, L.; Rehnstam-Holm, A. S.; Svensson, J.; Svensson, S.; Syversen, U. (2005). «Improving marine water quality by mussel farming: A profitable solution for Swedish society». Ambio 34 (2): 131-138. PMID 15865310. doi:10.1579/0044-7447-34.2.131.
- Weisman, Alan (2007). The World Without Us (en inglés). St. Martin's Thomas Dunne Books. ISBN 0-312-34729-4.
- «Plastic Debris: from Rivers to Sea» (PDF) (en inglés). Algalita Marine Research Foundation. Archivado desde el original el 19 de agosto de 2008. Consultado el 29 de mayo de 2008.
- Hannah Leung (21 de abril de 2018). «Five Asian Countries Dump More Plastic Into Oceans Than Anyone Else Combined: How You Can Help». Forbes (en inglés). Consultado el 23 de junio de 2019. «China, Indonesia, Philippines, Thailand, and Vietnam are dumping more plastic into oceans than the rest of the world combined, according to a 2017 report by Ocean Conservancy ».
- Christian Schmidt; Tobias Krauth; Stephan Wagner (11 de octubre de 2017). «Export of Plastic Debris by Rivers into the Sea». Environmental Science & Technology (en inglés) 51 (21): 12246-12253. Bibcode:2017EnST...5112246S. PMID 29019247. doi:10.1021/acs.est.7b02368. «The 10 top-ranked rivers transport 88–95% of the global load into the sea ».
- Harald Franzen (30 de noviembre de 2017). «Almost all plastic in the ocean comes from just 10 rivers». Deutsche Welle (en inglés). Consultado el 18 de diciembre de 2018. «It turns out that about 90 percent of all the plastic that reaches the world's oceans gets flushed through just 10 rivers: The Yangtze, the Indus, Yellow River, Hai River, the Nile, the Ganges, Pearl River, Amur River, the Niger, and the Mekong (in that order). »
- «Research. AMRF/ORV Alguita Research Projects» (en inglés). Algalita Marine Research Foundation/Macdonald Design. Archivado desde el original el 13 de marzo de 2017. Consultado el 19 de mayo de 2009.
- «Marine Litter: An Analytical Overview». UNEP. 2005. Archivado desde el original el 17 de julio de 2007. Consultado el 2 de abril de 2018.
- «Six pack rings hazard to wildlife». helpwildlife.com (en inglés). Archivado desde el original el 13 de octubre de 2016. Consultado el 22 de octubre de 2008.
- «Louisiana Fisheries – Fact Sheets». seagrantfish.lsu.edu (en inglés). University of Louisiana.
- «'Ghost fishing' killing seabirds» (en inglés). BBC News. 28 de junio de 2007.
- Weiss, Kenneth R. (2 de agosto de 2006). «Plague of Plastic Chokes the Seas». Los Angeles Times (en inglés). Archivado desde el original el 25 de marzo de 2008. Consultado el 1 de abril de 2008.
- Venema, Vibeke (17 de octubre de 2014). «The Dutch boy mopping up a sea of plastic». BBC.
- Moore, Charles (noviembre de 2003). «Across the Pacific Ocean, plastics, plastics, everywhere». Natural History. Archivado desde el original el 27 de septiembre de 2007. Consultado el 5 de abril de 2008.
- Sheavly, SB & Register, KM (2007). «Marine debris and plastics: Environmental concerns, sources, impacts and solutions». Journal of Polymers & the Environment (en inglés) 15 (4): 301-305. doi:10.1007/s10924-007-0074-3.
- Weisman, Alan (verano de 2007). «Polymers Are Forever». Orion magazine. Archivado desde el original el 2 de noviembre de 2014. Consultado el 1 de julio de 2008.
- Thompson, R. C. (2004). «Lost at Sea: Where is All the Plastic?». Science 304 (5672): 838. PMID 15131299. doi:10.1126/science.1094559.
- Moore, C. J.; Moore, S. L.; Leecaster, M. K.; Weisberg, S. B. (2001). «A Comparison of Plastic and Plankton in the North Pacific Central Gyre». Marine Pollution Bulletin 42 (12): 1297-300. PMID 11827116. doi:10.1016/S0025-326X(01)00114-X.
- Moore, Charles (noviembre de 2003). «Across the Pacific Ocean, plastics, plastics, everywhere». Natural History Magazine (en inglés). Archivado desde el original el 27 de septiembre de 2007.
- Moore, Charles (2 de octubre de 2002). «Great Pacific Garbage Patch» (en inglés). Santa Barbara News-Press. Archivado desde el original el 12 de septiembre de 2015. Consultado el 2 de abril de 2018.
- «Plastics and Marine Debris». Algalita Marine Research Foundation. 2006. Consultado el 1 de julio de 2008.
- «Midway's albatross population stable | Hawaii's Newspaper». The Honolulu Advertiser (en inglés). 17 de enero de 2005. Consultado el 20 de mayo de 2012.
- Jordan, Chris (11 de noviembre de 2009). «Midway: Message from the Gyre». Consultado el 13 de noviembre de 2009.
- «Q&A: Your Midway questions answered» (en inglés). BBC News. 28 de marzo de 2008. Consultado el 12 de mayo de 2010.
- Rios, L. M.; Moore, C.; Jones, P. R. (2007). «Persistent organic pollutants carried by synthetic polymers in the ocean environment». Marine Pollution Bulletin (en inglés) 54 (8): 1230-7. PMID 17532349. doi:10.1016/j.marpolbul.2007.03.022.
- Tanabe, S.; Watanabe, M.; Minh, T. B.; Kunisue, T.; Nakanishi, S.; Ono, H.; Tanaka, H. (2004). «PCDDs, PCDFs, and Coplanar PCBs in Albatross from the North Pacific and Southern Oceans: Levels, Patterns, and Toxicological Implications». Environmental Science & Technology (en inglés) 38 (2): 403-13. Bibcode:2004EnST...38..403T. PMID 14750714. doi:10.1021/es034966x.
- Bernstein, M. (19 de agosto de 2009). «Plastics in oceans decompose, release hazardous chemicals, surprising new study says». www.acs.org (en inglés). American Chemical Society.
- Fendall, Lisa S.; Sewell, Mary A. (2009). «Contributing to marine pollution by washing your face: Microplastics in facial cleansers». Marine Pollution Bulletin (en inglés) 58 (8): 1225-8. PMID 19481226. doi:10.1016/j.marpolbul.2009.04.025.
- «What You Need to Know About Mercury in Fish and Shellfish» (en inglés). marzo de 2004. Archivado desde el original el 19 de mayo de 2007. Consultado el 19 de mayo de 2007.
- Gollasch, Stephen (3 de marzo de 2006). «Ecology of Eriocheir sinensis» (en inglés). Archivado desde el original el 13 de marzo de 2016. Consultado el 2 de abril de 2018.
- Hui, C. (2005). «Mercury burdens in Chinese mitten crabs (Eriocheir sinensis) in three tributaries of southern San Francisco Bay, California, USA». Environmental Pollution (en inglés) 133 (3): 481-7. PMID 15519723. doi:10.1016/j.envpol.2004.06.019.
- Silvestre, F.; Trausch, G.; Péqueux, A.; Devos, P. (2004). «Uptake of cadmium through isolated perfused gills of the Chinese mitten crab, Eriocheir sinensis». Comparative Biochemistry and Physiology A (en inglés) 137: 189-196. doi:10.1016/S1095-6433(03)00290-3.
- Science News. "DDT treatment turns male fish into mothers." Archivado el 26 de septiembre de 2012 en Wayback Machine. 5 de febrero de 2000.
- «Chemical Weapon Time Bomb Ticks in the Baltic Sea». Deutsche Welle. 1 de febrero de 2008.
- «Helsinki Commission Activities 2006: Overview». Baltic Sea Environment Proceedings No. 112 (en inglés). Helsinki Commission. Archivado desde el original el 29 de febrero de 2012. Consultado el 4 de noviembre de 2009.
- Bocca, Riccardo (5 de agosto de 2005). «Parla un boss: Così lo Stato pagava la 'ndrangheta per smaltire i rifiuti tossici». L'Espresso (en italiano).
- Roman Bezhenar, Kyung Tae Jung, Vladimir Maderich, Stefan Willemsen, Govert de With & Fangli Qiao (2016). «Transfer of radiocaesium from contaminated bottom sediments to marine organisms through benthic food chains in post-Fukushima and post-Chernobyl periods». Biogeosciences (en inglés). pp. 3021-3034.
- «Noise pollution». sea.org (en inglés). Archivado desde el original el 7 de diciembre de 2016. Consultado el 24 de octubre de 2009.
- Ross, D. (1993). «On Ocean Underwater Ambient Noise». Institute of Acoustics Bulletin (en inglés) (St Albans, Herts, Reino Unido: Institute of Acoustics) (18): 5-8.
- McDonald, Mark A.; John A. Hildebrand; Sean M. Wiggins; Donald Ross (octubre de 2008). «A 50 Year comparison of ambient ocean noise near San Clemente Island: A bathymetrically complex coastal region off Southern California». The Journal of the Acoustical Society of America (en inglés) (Acoustical Society of America) (124): 1985-1992. doi:10.1121/1.2967889.
- Glossary Archivado el 29 de junio de 2017 en Wayback Machine. Discovery of Sounds in the Sea. Retrieved 23 December 2009
- Fristrup, K. M.; Hatch, L. T.; Clark, C. W. (2003). «Variation in humpback whale (Megaptera novaeangliae) song length in relation to low-frequency sound broadcasts». The Journal of the Acoustical Society of America (en inglés) 113 (6): 3411-24. Bibcode:2003ASAJ..113.3411F. PMID 12822811. doi:10.1121/1.1573637.
- «Effects of Sound on Marine Animals». Discovery of Sounds in the Sea (en inglés). Archivado desde el original el 13 de enero de 2010. Consultado el 23 de diciembre de 2009.
- «Sounding the Depths: Supertankers, Sonar, and the Rise of Undersea Noise, Executive Summary». Natural Resources Defense Council Press Release (en inglés). New York, N.Y.: www.nrdc.org. 1999. Archivado desde el original el 4 de abril de 2018. Consultado el 3 de abril de 2018.
- Marta Solé, Marc Lenoir, José Manuel Fortuño, Mercè Durfort, Mike van der Schaar & Michel André (2016). «Evidence of Cnidarians sensitivity to sound after exposure to low frequency underwater sources». Scientific Reports (en inglés).
- «Fertilizer and plastic pollution are main emerging issues in 2011 UNEP Year Book». News Centre, United Nations Environment Programme, The Hague (en inglés). 17 de febrero de 2011.
- Jenssen, BM (2003). «Marine pollution: the future challenge is to link human and wildlife studies» (PDF). Environ Health Perspect (en inglés) 111 (4): A198-A199. PMC 1241462. PMID 12676633. doi:10.1289/ehp.111-a198.
- Kullenberg, G. (1999). «Approaches to addressing the problems of pollution of the marine environment: An overview». Ocean & Coastal Management (en inglés) 42 (12): 999-1018. doi:10.1016/S0964-5691(99)00059-9.
- Matthews, G. (1973). «Pollution of the oceans: An international problem?». Ocean Management (en inglés) 1: 161-170. doi:10.1016/0302-184X(73)90010-3.
- Warner R. (2009). Protecting the oceans beyond national jurisdiction: strengthening the international law framework. Vol. 3 de Legal aspects of sustainable development (en inglés). Brill. ISBN 978-90-04-17262-3.
- «Convenio sobre la prevención de la contaminación del mar por vertimiento de desechos y otras materias». imo.org. Organización Marítima Internacional (OMI).
- Naciones Unidas (2005). El Derecho del Mar: Obligaciones de los Estados Partes conforme a la Convención de las Naciones Unidas sobre el Derecho del Mar e instrumentos complementarios.. Nueva York: División de Asuntos Oceánicos y del Derecho del Mar, Oficina de Asuntos Jurídicos, Naciones Unidas. p. 55. ISBN 92-1-333342-0.
- «Convención Regional para la Conservación del Mar Rojo y del Golfo de Adén». ecolex.org. ECOLEX.
- «Convenio para la protección y el desarrollo del medio marino en la región del Gran Caribe». cep.unep.org. Programa de las Naciones Unidas para el Ambiente (UNEP).
Bibliografía adicional
- Cookson, Clive (febrero de 2015). Oceans choke as plastic waste pours in at 8 million tonnes a year (registración requerida), The Financial Times (en inglés).
- Ahn, Y.H.; Hong, G.H.; Neelamani, S.; Philip, L. y Shanmugam, P. (2006) Assessment of Levels of coastal marine pollution of Chennai city, southern India. Water Resource Management, 21(7), 1187–1206 (en inglés).
- Daoji, L. y Dag, D. (2004) Ocean pollution from land-based sources: East China sea. AMBIO – A Journal of the Human Environment, 33(1/2), 107–113.
- Dowrd, B.M.; Press, D. y Los Huertos, M. (2008) Agricultural non-point sources: water pollution policy: The case of California's central coast. Agriculture, Ecosystems & Environment, 128(3), 151–161 (en inglés).
- Gioia, Rosalinda; Eckhardt, Sabine; Breivik, Knut; Jaward, Foday; Prieto, Ailette; Nizzeto, Luca; Jones, Kevin C. (enero de 2011). «Evidence for Major Emissions of PCBs in the West African Region». Environmental Science & Technology (en inglés) 45 (4): 1349-1355. doi:10.1021/es1025239.
- Laws, Edward A. (2000) Aquatic Pollution John Wiley and Sons. ISBN 978-0-471-34875-7 (en inglés).
- Slater, D. (2007) Affluence and effluents. Sierra 92(6), 27.
- UNEP/GPA (2006) The State of the Marine Environment: Trends and processes United Nations Environment Programme, Global Programme of Action, La Haya. 2006 ISBN 92-807-2708-7 (en inglés).
- UNEP (2007) Land-based Pollution in the South China Sea. UNEP/GEF/SCS Technical Publication N.º 10 (en inglés).
- Weis, Judith S. (2015) Marine pollution: what everyone needs to know. Oxford Univ. Press, Oxford, ISBN 978-0-19-999668-1 (en inglés).
Enlaces externos
- La contaminación marina. nationalgeographic.es, 20 de junio de 2016.
- Información sobre contaminación costera del Coastal Ocean Institute, Woods Hole Oceanographic Institution (en inglés).
- Contaminación por mercurio (en inglés).
- How Oil Spill Absorbent Products Work (en inglés).
- Facts about Marine Mercury Pollution from Oceana.org (en inglés).
- Science News / Marine Pollution Spawns 'wonky Babies' Archivado el 25 de junio de 2009 en Wayback Machine. (en inglés).
- Plastics at SEA: North Atlantic Expedition (en inglés).
- Plastic Trash Plagues the Ocean, Trashing the Ocean, Oil's Impact on Marine Invertebrates on the Smithsonian Ocean Portal (en inglés).
- El joven inventor que sueña con limpiar los océanos - Documental sobre un proyecto para limpiar los océanos del plástico acumulado.
- Which Countries Create the Most Ocean Trash?—Wall Street Journal (12 de febrero de 2015) (en inglés).
- Toxicología acuática (en la Wikipedia en inglés).
- Impacto ambiental de los pesticidas (en la Wikipedia en inglés).
- Contaminación por mercurio en el océano (en la Wikipedia en inglés).
- Contaminación por nutrientes (en la Wikipedia en inglés).
- Toxicidad por contaminación de petróleo en peces marinos (en la Wikipedia en inglés).
- Vertido de desechos tóxicos por la 'Ndrangheta (en la Wikipedia en inglés).
- Conferencia sobre los océanos de las Naciones Unidas (en la Wikipedia en inglés).
- Esta obra contiene una traducción derivada de «Marine pollution» de Wikipedia en inglés, concretamente de esta versión del 2 de abril de 2018, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.