Molécula de agua
El agua u oxidano (H2O) es un compuesto químico inorgánico formado por dos átomos de hidrógeno (H) y uno de oxígeno (O).[3] Esta molécula es esencial en la vida de los seres vivos, al servir de medio para el metabolismo de las biomoléculas, se encuentra en la naturaleza en sus tres estados y fue clave para su formación. Hay que distinguir entre el agua potable y el agua pura, pues la primera es una mezcla que también contiene sales en solución; es por esto que en laboratorio y en otros ámbitos se usa agua destilada.
| Agua (H2O) | ||
|---|---|---|
 Diagrama de la molécula del agua(H2O). | ||
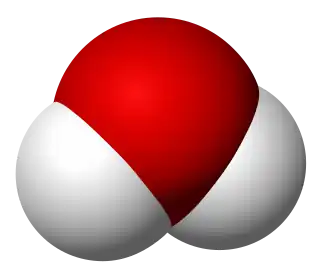 Representación molecular del agua(H2O). | ||
| Nombre IUPAC | ||
| Oxidano[1] | ||
| General | ||
| Otros nombres |
Hidróxido de hidrógeno Protóxido de hidrógeno Hidrato Ácido hídrico Óxido de dihidrógeno R-718 Dihidruro de oxígeno Ácido hidroxílico Monóxido de dihidrógeno Hidróxido de hidronio Ácido hidróxico Ácido oxhídrico Agua destilada Agua pura | |
| Fórmula semidesarrollada | HOH | |
| Fórmula molecular | H2O | |
| Identificadores | ||
| Número CAS | 7732-18-5[2] | |
| Número RTECS | ZC0110000 | |
| ChEBI | 15377 | |
| ChemSpider | 937 | |
| PubChem | 962 | |
| UNII | 059QF0KO0R | |
|
| ||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1000 kg/m³; 1 g/cm³ | |
| Masa molar | 1 801 528 g/mol | |
| Punto de fusión | 0 °C (273 K) | |
| Punto de ebullición | 100 °C (373 K) | |
| Temperatura crítica | 374 °C (647 K) | |
| Presión crítica | 217.7 atm | |
| Presión de vapor |
1 atm (100 °C) 0,0231 atm (20 °C) 0,00603 atm (0 °C) | |
| Estructura cristalina | Hexagonal (véase hielo) | |
| Viscosidad | 1 cP (20 °C) | |
| Índice de refracción (nD) | 1,333 | |
| Constante dieléctrica | 78,5 | |
| Propiedades químicas | ||
| Acidez | 15,74 pKa | |
| Solubilidad en agua | 100 % | |
| Momento dipolar | 1,85 D | |
| Termoquímica | ||
| ΔfH0gas | -241,83 kJ/mol | |
| ΔfH0líquido | -285,83 kJ/mol | |
| ΔfH0sólido | -291,83 kJ/mol | |
| S0gas, 1 bar | 188,84 J·mol–1·K | |
| S0líquido, 1 bar | 69,95 J·mol–1·K–1 | |
| S0sólido | 41 J·mol–1·K–1 | |
| E0 | 0,002 Volt | |
| Capacidad calorífica (C) | 1 | |
| Riesgos | ||
| Riesgos principales |
No Asignados (URLs inservibles) | |
| Ingestión | Necesaria para la vida; su consumo excesivo puede producir dolores de cabeza, confusión y calambres. Puede ser fatal en atletas. | |
| Inhalación | No es tóxica. Puede disolver el surfactante de los pulmones. La sofocación en el agua se denomina ahogo. | |
| Piel | La inmersión prolongada puede causar descamación. | |
| Ojos | No es peligrosa para los ojos. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

Propiedades del agua
Proveniente del latín aqua, es el término que se usa para referirse al agua en estado líquida (entre 0 °C y 100 °C). Al encontrarse por debajo de los 100°, el agua se mantiene intacta. Por esta razón existen los océanos, mares, ríos, lagos o lagunas dispersos sobre la Tierra.
Características físicas y químicas
El agua es inodora, incolora, e insípida, es decir, no tiene un olor propio, no tiene color ni sabor.[4] Su importancia reside en que casi la totalidad de los procesos químicos que suceden en la naturaleza, no solo en organismos vivos sino también en la superficie no organizada de la tierra, así como los que se llevan a cabo en laboratorios y en la industria, tienen lugar entre sustancias disueltas en agua.[5]
Henry Cavendish descubrió en 1781 que el agua era una sustancia compuesta en vez de un elemento, como en la antigüedad se creía.[6] Los resultados de dicho descubrimiento fueron desarrollados por Antoine Laurent de Lavoisier (químico destacado en diferentes temas de la química) dando a conocer que el agua estaba formada por dos átomos de hidrógeno y uno de oxígeno.[7] En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt publicaron un documento científico que demostraba que el agua estaba formada por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
La molécula de agua adopta una geometría no lineal, con los dos átomos de hidrógeno formando un ángulo de 104,45 grados entre sí.[8] Esta configuración, junto con la mayor electronegatividad del átomo de oxígeno le confieren polaridad a la molécula, cuyo momento dipolar eléctrico es de 6,2x10-30 C m.[9] Este carácter dipolar de la molécula de agua da lugar a la formación de hasta cuatro enlaces de hidrógeno con moléculas circundantes.[10]
Los enlaces por puentes de hidrógeno son enlaces por fuerzas de van der Waals de gran magnitud, aunque son unas 20 veces más débiles que los enlaces covalentes; son responsables de la dilatación del agua al solidificarse, es decir, su disminución de densidad cuando se congela. En estado sólido, las moléculas de agua se ordenan formando tetraedros, situándose en el centro de cada tetraedro un átomo de oxígeno y en los vértices dos átomos de hidrógeno de la misma molécula y otros dos átomos de hidrógeno de otras moléculas que se enlazan electrostáticamente por puentes de hidrógeno con el átomo de oxígeno. La estructura cristalina resultante es muy abierta y poco compacta, menos densa que en estado líquido. El agua tiene una densidad máxima de 1 g/cm³ cuando está a una temperatura de 4 °C,[11] característica especialmente importante en la naturaleza que hace posible el mantenimiento de la vida en medios acuáticos sometidos a condiciones exteriores de bajas temperaturas.
La dilatación del agua al solidificarse también tiene efectos de importancia en los procesos geológicos de erosión. Al introducirse agua en grietas del suelo y congelarse posteriormente, se originan tensiones que rompen las rocas.
Disolvente
El agua es descrita muchas veces como el solvente universal, porque disuelve muchos de los compuestos sólidos, acuosos y gaseosos conocidos. Sin embargo, no lo es (aunque es tal vez lo más cercano), porque no disuelve a todos los compuestos y, de hacerlo, no sería posible construir ningún recipiente para contenerla.
El agua es un disolvente polar, más polar, por ejemplo, que el etanol. Como tal, disuelve bien sustancias iónicas y polares, como la sal de mesa (cloruro de sodio). No disuelve, de manera apreciable, sustancias fuertemente apolares, como el azufre en la mayoría de sus formas alotrópicas, además, es inmiscible con disolventes apolares, como el hexano. Esta cualidad es de gran importancia para la vida.
Esta selectividad en la disolución de distintas clases de sustancias se debe a su capacidad para formar puentes de hidrógeno con otras sustancias que pueden presentar grupos polares, o con carga iónica, como: alcoholes, azúcares con grupos R-OH, aminoácidos y proteínas con grupos que presentan cargas parciales + y − dentro de la molécula, lo que da lugar a disoluciones moleculares. También, las moléculas de agua pueden disolver sustancias salinas que se disocian formando disoluciones iónicas.
En las disoluciones iónicas, los iones de las sales orientan, debido al campo eléctrico que crean a su alrededor, a los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua en forma de iones hidratados o solvatados.
Algunas sustancias, sin embargo, no se mezclan bien con el agua, incluyendo aceites y otras sustancias hidrofóbicas. Membranas celulares, compuestas de lípidos y proteínas, aprovechan esta propiedad para controlar las interacciones entre sus contenidos químicos y los externos, lo que se facilita, en parte, por la tensión superficial del agua.
La capacidad disolvente es responsable de:
- Las funciones metabólicas.
- Los sistemas de transporte de sustancias en los organismos.
Sin embargo, la disolución de sustancias en el agua es la causa de la contaminación de la misma: si se arrojan materiales sensibles al agua como plástico o madera, en años (que podrían ser más de 100) se desintegran y pasan a circular libre y peligrosamente por el agua. Esto es principalmente malo para los animales acuáticos. Los más peligrosos contaminantes son:
- Arrojo de basura al agua (bolsas, botellas, maderas, restos de comida, sustancias líquidas ácidas, etc), que con el tiempo se desintegra.
- Derrames petroleros: grandes accidentes sobre una plataforma petrolera que derraman petróleo y toxinas en el mar/océano.
- Degradación de los naufragios: El rescate de pecios es importante, ya que con el tiempo, los aviones y barcos sumergidos en el agua se degradan y contaminan el agua. Una idea muy buena para rescatar pecios sería destruyéndolos y llevarlos a la superficie de a pedazos (para que no sean tan pesados), pero es inaceptable dejarlos en el fondo.
- Proceso de sustancias químicas: el arrojo de sustancias químicas muy complejas al agua. La única forma que existe para separar estas sustancias es con métodos científicos como la destilación.
Polaridad
Las moléculas de agua son muy polares, puesto que hay una gran diferencia de electronegatividad entre el hidrógeno y el oxígeno. Los átomos de oxígeno son mucho más electronegativos (atraen más a los electrones) que los de hidrógeno, lo que dota a los dos enlaces de una fuerte polaridad eléctrica, con un exceso de carga negativa del lado del oxígeno, y de carga positiva del lado del hidrógeno. Los dos enlaces no están opuestos, sino que forman un ángulo de 104,45° debido a la hibridación del átomo de oxígeno así que, en conjunto, los tres átomos forman una molécula angular, cargado negativamente en el vértice del ángulo, donde se ubica el oxígeno y, positivamente, en los extremos de la molécula, donde se encuentran los hidrógenos. Este hecho tiene una importante consecuencia, y es que las moléculas de agua se atraen fuertemente, adhiriéndose por donde son opuestas las cargas. En la práctica, un átomo de hidrógeno sirve como puente entre el átomo de oxígeno al que está unido covalentemente y el oxígeno de otra molécula. La estructura anterior se denomina enlace de hidrógeno o puente de hidrógeno.
El hecho de que las moléculas de agua se adhieran electrostáticamente, a su vez modifica muchas propiedades importantes de la sustancia que llamamos agua, como la viscosidad dinámica, que es muy grande, o los puntos (temperaturas) de fusión y ebullición o los calores de fusión y vaporización, que se asemejan a los de sustancias de mayor masa molecular.
Cohesión
La cohesión es la propiedad por la que las moléculas de agua se atraen entre sí. Debido a esta interacción se forman cuerpos de agua por adhesión de moléculas de agua, las gotas.
Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. Al no poder comprimirse puede funcionar en algunos animales como un esqueleto hidrostático, como ocurre en algunos gusanos perforadores capaces de agujerear la roca mediante la presión generada por sus líquidos internos. Estos puentes se pueden romper fácilmente con la llegada de otra molécula con un polo negativo o positivo dependiendo de la molécula, o, con el calor.
La fuerza de cohesión permite que el agua se mantenga líquida a temperaturas no extremas.
Adhesión
El agua, por su gran potencial de polaridad, cuenta con la propiedad de la adhesión, es decir, el agua generalmente es atraída y se mantiene adherida a otras superficies.
Tensión superficial

Por su misma propiedad de cohesión, el agua tiene una gran atracción entre las moléculas de su superficie, creando tensión superficial. La superficie del líquido se comporta como una película capaz de alargarse y al mismo tiempo ofrecer cierta resistencia al intentar romperla; esta propiedad contribuye a que algunos objetos muy ligeros floten en la superficie del agua aun siendo más densos que esta. A presión constante, el índice de tensión superficial del agua disminuye al aumentar su temperatura.[12]
Debido a su elevada tensión superficial, algunos insectos pueden estar sobre ella sin sumergirse e, incluso, hay animales que corren sobre ella, como el basilisco. También es la causa de que se vea muy afectada por fenómenos de capilaridad.
Las gotas de agua son estables también debido a su alta tensión superficial. Esto se puede ver cuando pequeñas cantidades de agua se ponen en superficies no solubles, como el vidrio, donde el agua se agrupa en forma de gotas.
Acción capilar
El agua cuenta con la propiedad de la capilaridad, que es la propiedad de ascenso, o descenso, de un líquido dentro de un tubo capilar. Esto se debe a sus propiedades de adhesión y cohesión.
Cuando se introduce un capilar en un recipiente con agua, esta asciende espontáneamente por el capilar como si trepase "agarrándose" por las paredes, hasta alcanzar un nivel superior al del recipiente, donde la presión que ejerce la columna de agua se equilibra con la presión capilar. A este fenómeno se debe, en parte, la ascensión de la savia bruta, desde las raíces hasta las hojas, a través de los vasos leñosos.
Calor específico
Esta propiedad también se encuentra en relación directa con la capacidad del agua para formar puentes de hidrógeno intermoleculares. El agua puede absorber grandes cantidades de calor que es utilizado para romper los puentes de hidrógeno, por lo que la temperatura se eleva muy lentamente. El calor específico del agua se define como la cantidad de energía necesaria para elevar la temperatura, en un grado Celsius, a un gramo de agua en condiciones estándar y es de 1 cal/°C•g, que es igual a 4,1840 J/K•g.
Esta propiedad es fundamental para los seres vivos (y la Biosfera en general) ya que gracias a esto, el agua reduce los cambios bruscos de temperatura, siendo un regulador térmico muy bueno. Un ejemplo de esto son las temperaturas tan suaves que hay en las zonas costeras, que son consecuencias de estas propiedad. También ayuda a regular la temperatura de los animales y las células permitiendo que el citoplasma acuoso sirva de protección ante los cambios de temperatura. Así se mantiene la temperatura constante.
La capacidad calorífica del agua es mayor que la de otros líquidos.
Para evaporar el agua se necesita mucha energía. Primero hay que romper los puentes y posteriormente dotar a las moléculas de agua de la suficiente energía cinética para pasar de la fase líquida a la gaseosa. Para evaporar un gramo de agua se precisan 540 calorías, a una temperatura de 100 °C.
Temperatura de fusión y evaporación
Presenta un punto de ebullición de 100 °C (373,15 K) a presión de 1 atmósfera (se considera como estándar para la presión de una atmósfera la presión promedio existente al nivel del mar). El calor latente de evaporación del agua a 100 °C es 540 cal/g (o 2260 J/g).
Tiene un punto de fusión de 0 i;°C (273,15 K) a presión de 1 atm, sin embargo, nuevos estudios por parte de un equipo de químicos de la Universidad de Utah (EE. UU.), han demostrado que el agua no se fusiona completamente a 0 °C sino que es a -13 °C que el hielo se solidifica por completo.[13] El calor latente de fusión del hielo a 0 °C es 80 cal/g (o 335 J/g). Tiene un estado de sobreenfriado líquido a −25 °C.
La temperatura crítica del agua, es decir, aquella a partir de la cual no puede estar en estado líquido independientemente de la presión a la que esté sometida, es de 374 °C y se corresponde con una presión de 217,5 atmósferas.
Densidad
La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión.
A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad a los 100 °C, donde tiene 0,958 kg/L. Mientras baja la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/L) y ese aumento es constante hasta llegar a los 4,0 °C, donde alcanza su máxima densidad: 1 kg/L.
Cristalización
A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente, hasta que a los 0 °C disminuye hasta 0,9999 kg/L. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/L a 0,917 kg/L.
La cristalización es el proceso por el que el agua pasa de su estado líquido al sólido cuando la temperatura disminuye de forma continua convirtiéndolo en hielo.
Otras propiedades
- pH neutro, en presencia de CO2 se vuelve ligeramente ácido.
- Con ciertas sales forma hidratos.
- Reacciona con los óxidos de metales formando bases.
- Es catalizador en muchas reacciones químicas.
- Presenta un equilibrio de autoionización, en el cual hay iones H3O+ y OH−.
- Estudio Hidrobiológico
La realización de un estudio hidrobiológico permite:
- Proporcionar datos sobre el estado de un sistema acuático de forma regular.
- Documentar la variabilidad a corto y largo plazo de la calidad del agua por fenómenos naturales o actividades humanas.
- Evaluar el impacto de la polución producido por la actividad humana.
- Evaluar la influencia de ciertas zonas de muestreo sobre la fauna del lugar.
- Evaluar las características hidráulicas del cauce del río y la evolución del caudal mediante medidas de flujo. De esta manera, se puede establecer las variaciones de caudal que sufre el río a lo largo de ciclo estacional y anual.
- Realizar un estudio de la rivera.
- Evaluar los Índices Biológicos.
Destilación
Para obtener agua químicamente pura es necesario realizar diversos procesos físicos de purificación ya que el agua es capaz de disolver una gran cantidad de sustancias químicas, incluyendo gases.
Se llama agua destilada al agua que ha sido evaporada y posteriormente condensada. Al realizar este proceso se eliminan casi la totalidad de sustancias disueltas y microorganismos que suele contener el agua y el resultado es prácticamente la sustancia química pura H2O.
El agua pura no conduce la electricidad, pues está libre de sales y minerales.
Importancia de la posición astronómica de la Tierra
La coexistencia de las fases sólidas, líquidas y gaseosas pero, sobre todo, la presencia permanente de agua líquida, es vital para comprender el origen y la evolución de la vida en la Tierra tal como es. Sin embargo, si la posición de la Tierra en el Sistema Solar fuera más cercana o más alejada del Sol, la existencia de las condiciones que permiten a las formas del agua estar presentes simultáneamente serían menos probables.
La masa de la Tierra permite mantener la atmósfera. El vapor de agua y el dióxido de carbono en la atmósfera causan el efecto invernadero, lo que ayuda a mantener relativamente constante la temperatura superficial. Si el planeta tuviera menos masa, una atmósfera más delgada causaría temperaturas extremas no permitiendo la acumulación de agua excepto en los casquetes polares (como en Marte). De acuerdo con el modelo nébula solar de la formación del Sistema Solar, la masa de la Tierra se debe en gran parte a su distancia al Sol.
La distancia entre el Sol y la Tierra y la combinación de radiación solar recibida y el efecto invernadero en la atmósfera aseguran que su superficie no sea demasiado fría o caliente para el agua líquida. Si la Tierra estuviera más alejada del Sol, el agua líquida se congelaría. Si estuviera más cercana, su temperatura superficial elevada limitaría la formación de las capas polares o forzaría al agua a existir solo como vapor. En el primer caso, la baja reflectibilidad de los océanos causaría la absorción de más energía solar. En el último caso, la Tierra sería inhabitable (al menos por las formas de vida conocidas) y tendría condiciones semejantes a las del planeta Venus.
Las teorías Gaia proponen que la vida se mantiene adecuada a las condiciones por sí misma al afectar el ambiente de la Tierra.
El cambio del estado en el agua

Estado sólido
Al estar el agua en estado sólido, todas las moléculas se encuentran unidas mediante un enlace de hidrógeno, que es un enlace intermolecular y forma una estructura parecida a un panal de abejas, lo que explica que el agua sea menos densa en estado sólido que en el estado líquido. La energía cinética de las moléculas es muy baja, es decir que las moléculas están casi inmóviles.
El agua glacial sometida a extremas temperaturas y presiones criogénicas adquiere una alta capacidad de sublimación, al pasar de sólida a vapor por la acción energética de los elementos que la integran —oxígeno e hidrógeno— y del calor atrapado durante su proceso de congelación-expansión. Es decir, por su situación de confinamiento a grandes profundidades se deshiela parcialmente, lo cual genera vapor a una temperatura ligeramente superior del helado entorno, suficiente para socavar y formar cavernas en el interior de los densos glaciales. Estas grutas, que además contienen agua proveniente de sistemas subglaciales, involucran a las tres fases actuales del agua, donde al interactuar en un congelado ambiente subterráneo y sin la acción del viento se transforman en el cuarto estado del agua: plasma semilíquido o gelatinoso.

Estado líquido
Cuando el agua está en estado líquido, al estar a mayor temperatura, aumenta la energía cinética de las moléculas, por lo tanto el movimiento de las moléculas es mayor produciendo rotura en los enlaces de hidrógeno quedando algunas moléculas sueltas y la mayoría unidas.
Es un estado de la agregación de la materia en forma de fluido altamente incompresible.
Estado gaseoso
Cuando el agua es gaseosa, la energía cinética es tal que se rompen todos los enlaces de hidrógeno quedando todas las moléculas libres. El vapor de agua es tan invisible como el aire; el vapor que se observa sobre el agua en ebullición o en el aliento emitido en aire muy frío, está formado por gotas microscópicas de agua líquida en suspensión; lo mismo que las nubes.
Véase también
Referencias
- Nomenclatura de Química Inorgánica. Recomendaciones de la IUPAC de 2005. Ciriano López, Miguel Ángel; Román Polo, Pascual (versión española), Connelly, Neil G. (ed.), Damhus, Ture (ed.) Prensas Universitarias de Zaragoza, 2007
- Número CAS
- Vergara, Ed (2 de octubre de 2015). Trascender: Los Tres Elementos (en inglés). WestBow Press. ISBN 9781512708264. Consultado el 29 de enero de 2018.
- CEP, Editorial (7 de octubre de 2010). Manual Alimentación, Nutrición y Dietética. Formación para el Empleo. EDITORIAL CEP. ISBN 9788468184913. Consultado el 29 de enero de 2018.
- Herbas, Luis Martos (2011). En Torno Al Universo Invisible. Lulu.com. ISBN 9781447509066. Consultado el 29 de enero de 2018.
- Puleo, Alicia H. (1991). Cómo leer a Schopenhauer. Alicia Puleo. ISBN 9788433408099. Consultado el 29 de enero de 2018.
- PAINO, IVAN (22 de febrero de 2015). EL DISEÑO UNIVERSAL: GEOMETRIA SAGRADA DE LA GRAN PIRAMIDE VOL.II. Ediciones Isthar Luna Sol. ISBN 9788494065873. Consultado el 29 de enero de 2018.
- Pilar, CABILDO MIRANDA Ma del; Pilar, CORNAGO RAMÍREZ; Consuelo, ESCOLÁSTICO LEÓN; Soledad, ESTEBAN SANTOS; Angeles, FARRÁN MORALES; Marta, PÉREZ TORRALBA; Dionisia, SANZ DEL CASTILLO (4 de mayo de 2012). Procesos orgánicos de bajo impacto ambiental. Química verde. Editorial UNED. ISBN 9788436263497. Consultado el 29 de enero de 2018.
- Franco García, Ángel. «Materiales dieléctricos». Física con ordenador. Universidad del País Vasco.
- Vázquez-Contreras, Edgar. «Los puentes de hidrógeno». Bioquímica y Biología Molecular en línea. Instituto de Química, UNAM. Archivado desde el original el 22 de mayo de 2016. Consultado el 10 de diciembre de 2016.
- Biología marina, p. 39, en Google Libros – Giuseppe Cognetti, Michele Sarà, Giuseppe Magazzù
- Véanse las tablas Archivado el 29 de septiembre de 2004 en Wayback Machine. elaboradas por un equipo de la Escuela de Ingeniería de Antioquía (Colombia).
- Elena Sanz (24 de noviembre de 2011). «¿A qué temperatura se congela el agua?». Consultado el 11 de abril de 2012. «Un equipo de químicos de la Universidad de Utah (EE UU) acaba de demostrar que el agua no se congela totalmente hasta que alcanza los -13 °C, y no a 0 °C como solemos pensar. Es a esa temperatura extremadamente baja cuando el agua no solo se enfría sino que definitivamente su estructura molecular cambia y adquiere formas tetraédricas, en las que cada molécula de agua se une a otras cuatro, formando lo que conocemos como hielo. No obstante, incluso a estas temperaturas pueden quedar restos de agua líquida entre el agua sólida, aunque dura tan poco tiempo que resulta casi imposible de detectar o medir. »
Enlaces externos
 Wikiquote alberga frases célebres de o sobre Molécula de agua.
Wikiquote alberga frases célebres de o sobre Molécula de agua.