Porphyromonas gingivalis
Porphyromonas gingivalis es un cocobacilo Gram-negativo, no móvil, anaerobio estricto, asacarolítico, perteneciente al filo Bacteroidetes.[1][2][3][4][5] Es una bacteria periodontopatógena altamente prevalente, tanto en periodontitis crónica como agresiva,[3][4] y rara vez se encuentra presente en un periodonto sano.[1] Además, se ha identificado como factor de riesgo para enfermedades sistémicas inflamatorias, infecciones pulmonares, como la neumonía por aspiración, parto pretérmino, bajo peso al nacer, afecciones cardíacas como la enfermedad cardíaca ateroesclerótica e infarto del miocardio al encontrarse en placas ateroescleróticas[2][4][6] y se cree que podría estar involucrada en el desarrollo de la enfermedad de Alzheimer [7]
| Porphyromonas gingivalis | ||
|---|---|---|
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Bacteroidetes | |
| Clase: | Bacteroidetes | |
| Orden: | Bacteroidales | |
| Familia: | Porphyromonadaceae | |
| Género: | Porphyromonas | |
| Especie: |
P. gingivalis (Coykendall et al. 1980) Shah and Collins 1988 | |
Epidemiología
América del Norte y Europa
Según un estudio realizado en 1997 en una clínica universitaria, el 79 % de los pacientes con enfermedad periodontal eran positivos para P. gingivalis, comparado con el 25 % de los sujetos sanos. Sin embargo, cabe señalar que la prevalencia de esta bacteria en el grupo sano variaba considerablemente según la etnia, presentándose en el 22 % de los blancos, el 53 % de los afroamericanos y el 60 % de los estadounidenses de origen asiático. Posteriormente, el año 2000, un estudio realizado en Suecia indicó que P. gingivalis se encontraba en el 95% de los pacientes con periodontitis, pero también en los casos control la prevalencia era alta, siendo del 82 %. No obstante, al analizar la carga bacteriana, se encontraron grandes diferencias en relación con la colonización de alto nivel (≥ 105 células bacterianas por muestras de placa), siendo la prevalencia de 19 % en pacientes y 3 % en controles.[8]
Asia
Un estudio realizado en Indonesia en 1998 indicó que la prevalencia de P. gingivalis en adolescentes de zonas rurales era del 87%. Ese mismo año, otro estudio en China detectó la bacteria en el 55% de una muestra de obreros jóvenes. No obstante, investigaciones realizadas en zonas rurales de China y Tailandia indicaron que el cocobacilo era prácticamente omnipresente.[8]
Morfología
P. gingivalis es un cocobacilo, gram-negativo, anaerobio estricto, de 1 - 3,5 μm de largo por 0,5 - 0,8 μm de ancho.[2][5] Su pared celular presenta lipopolisacáridos a nivel de la membrana externa. Presenta cápsula; abundantes fimbrias; vesículas a nivel superficial, las cuales contienen enzimas implicadas en su virulencia; y enzimas proteolíticas. Carece de flagelos y no forma esporas.[2]
Factores de virulencia
P. gingivalis expresa una serie de factores de virulencia, tales como cápsula, lipopolisacáridos (LPS), hemaglutininas, fimbrias y enzimas proteolíticas:[1][2][3][4][5][6]

- Cápsula: La cápsula de P. gingivalis está constituida por polisacáridos. Confiere estabilidad estructural a la bacteria y tiene un papel fundamental en la evasión de la respuesta inmune, eludiendo la fagocitosis, opsonización y la acción del complemento.
es una bacteria muy peligrosa
- Lipopolisacárido: P. gingivalis presenta lipopolisacárido (LPS) a nivel de la membrana externa, el cual interrumpe la homeostasis inmunológica del hospedero y produce inflamación gingival. Este LPS induce la producción de IL-6 e IL-8 desde fibroblastos del ligamento periodontal en humanos.
- Vesículas de membrana externa: Presentan numerosas enzimas en su interior, como fosfolipasa C, proteasas, fosfatasa alcalina, hemolisinas y lipopolisacáridos, las cuales producen daño celular.
- Hemaglutininas: Promueven la colonización mediante la unión bacteriana a receptores oligosacáridos en células humanas.
- Fimbrias: Presentan capacidad de unión a sustratos, moléculas y células, además de propiedades quimiotácticas y de inducción de citoquinas. Permiten al microorganismo invadir los tejidos periodontales y colonizar la cavidad oral.
- Proteinasas cisteinproteasas: Proporciona nutrientes para el crecimiento bacteriano, generando daño colateral al hospedero, mediante la degradación de colágeno. Estas proteínas producen el 85% de la actividad proteolítica generada por P. gingivalis y el 100% de la actividad tipo tripsina. Producen la degradación de fibronectina, fibrinógeno y de las uniones de las células epiteliales.
- Proteinasas no cisteinproteasas: Corresponden a colagenasa, proteasa, hemaglutinina, dipeptidilpeptidasa y periodontaina.
- Inductor de metaloproteinasas de la matriz: Es producido por fibroblastos, leucocitos y macrófagos al ser inducidos por P. gingivalis. Degradan la mayoría de las moléculas de la matriz extracelular, como el colágeno, la fibronectina y la laminina.
Transmisión
Existe evidencia de transmisión vertical de P. gingivalis de padres a hijos. Además, mediante métodos moleculares, se ha demostrado también la transmisión horizontal de este cocobacilo entre parejas. No obstante, no ha sido posible demostrar que la enfermedad periodontal sea contagiosa.[1]
Fisiopatología
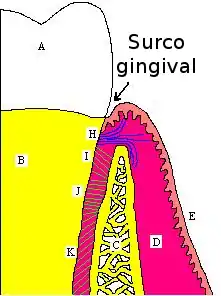
P. gingivalis es un colonizador secundario del surco gingival. Esta colonización es posible gracias a la capacidad de adherirse que le proporcionan las fimbrias, además de la acción de las vesículas de membrana y hemaglutininas. Tienen la capacidad de invadir las células epiteliales en un período aproximado de veinte minutos, replicándose dentro de ellas, lo que le da la capacidad de evadir la respuesta inmune del hospedero. Su capacidad proteolítica, así como la alteración de la respuesta innata y adaptativa del hospedero, y la respuesta inflamatoria en el surco, hacen que el proceso de destrucción del periodonto se torne crónico.[2]
Posible relación con la enfermedad de Alzheimer
Estudios publicados en 2019 por un laboratorio, parecen demostrar una relación entre la presencia de P. gingivalis, característica en la periodontitis crónica y la enfermedad de Alzheimer (EA).[9]
Los análisis de tejidos post mortem en 3 cerebros de humanos fallecidos con la EA, sugieren que la creación de las características placas de la proteína beta-amiloide y de material celular los llamados ovillos, puede estar relacionada con la presencia crónica de P. gingivalis. En un estudio con ratones clonados, sin infección previa de P. gingivalis, sometidos esta vez a una infección no periodontal, con dicha bacteria, muestran transcurrido un período de algunos meses, problemas cognitivos.[9]
En los análisis cerebrales de dichos ratones se empiezan a formar los mismos depósitos en placas en forma de ovillos de la proteína beta-amiloide y muestran un deterioro cerebral similar al de la EA en humanos. Deben realizarse estudios independientes para confirmar este descubrimiento.
Ya se están empezando a crear fármacos similares a vacunas, como por ejemplo el inhibidor de Kgp COR388 que están siendo aplicados a nivel experimental en pacientes voluntarios, afectados o no por la EA. Que no se utilicen antibióticos específicos para el tratamiento por infección de P. gingivalis, que en definitiva es una bacteria gram-negativa, es debido a que éstos son moderadamente eficaces a nivel bucal para el tratamiento de la periodontitis, pero pierden su eficacia cuando tienen que atravesar la barrera hematoencefálica que rodea al cerebro y al sistema nervioso central. Si dicho estudio confirmara su descubrimiento sería la mayor revolución en los últimos veinte años para encontrar una explicación razonable y formas de tratamiento adecuadas para una enfermedad tan grave e invalidante como la EA.[9]
Referencias
- Negroni M. Microbiología Estomatológica. Fundamentos y guía práctica. 2.ª ed. ISBN 9500604833, 9789500604833. Ed. Médica Panamericana.
- Ramos D. et al. Porphyromonas gingivalis: patógeno predominante en la periodontitis crónica. Odontología Sanmarquina 2011; 14(1): 34-38. Consultado el 17 de julio de 2015.
- Díaz Zúñiga J. et al. Virulencia y variabilidad de Porphyromonas gingivalis y Aggregatibacter actinomycetemcomitans y su asociación a la periodontitis. Consultado el 17 de julio de 2015.
- Díaz Caballero A., et al. Periodontitis, Porphyromonas gingivalis y su relación con la expresión de quorum sensing. Revista Cubana de Estomatología v.47 n.4 Ciudad de La Habana oct.-dic. 2010. Consultado el 17 de julio de 2015
- Del Río P. Actividad biocida de un propolis chileno frente a Porphyromonas gingivalis: Estudio in vitro. Universidad de Chile, Facultad de Odontología, Departamento de Patología, Área de Microbiología. Consultado el 17 de julio de 2015.
- Ardila Medina C.M. y Lafaurie Villamil G.I. Asociación entre porphyromona gingivalis y proteína C reactiva en enfermedades sistémicas inflamatorias. Avances en Periodoncia e Implantología Oral v.22 n.1 Madrid abr. 2010. Consultado el 17 de julio de 2015.
- MacKenzie, Debora. «We may finally know what causes Alzheimer’s – and how to stop it». New Scientist (en inglés estadounidense). Consultado el 25 de enero de 2019.
- Lindhe J. Periodontología Clínica E Implantología Odontólogica, Volumen 1, 5.ª ed. ISBN 9500615592, 9789500615594. Ed. Médica Panamericana, 2009.
- Dominy, Stephen S.; Lynch, Casey; Ermini, Florian; Benedyk, Malgorzata; Marczyk, Agata; Konradi, Andrei; Nguyen, Mai; Haditsch, Ursula; Raha, Debasish; Griffin, Christina; Holsinger, Leslie J.; Arastu-Kapur, Shirin; Kaba, Samer; Lee, Alexander; Ryder, Mark I.; Potempa, Barbara; Mydel, Piotr; Hellvard, Annelie; Adamowicz, Karina; Hasturk, Hatice; Walker, Glenn D.; Reynolds, Eric C.; Faull, Richard L. M.; Curtis, Maurice A.; Dragunow, Mike; Potempa, Jan (de enero de 2019). «Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors». Science Advances (en inglés) 5 (1): eaau3333. PMC 6357742. PMID 30746447. doi:10.1126/sciadv.aau3333. Consultado el 8 de junio de 2021.