Proteínas intrínsecamente desestructuradas
Las proteínas intrínsecamente desestructuradas (IUP, IDP o NUP, por sus siglas en inglés) son proteínas que se caracterizan por su falta de estructura terciaria estable cuando está en forma de cadena peptídica aislada bajo condiciones fisiológicas in vitro.[2][3] Su descubrimiento desafió el paradigma clásico de la estructura de las proteínas, que consideraba que una estructura bien definida era imprescindible para que la proteína pudiese desempeñar su función, así como que es la estructura lo que define esta función. A todas luces éste no es el caso de las proteínas intrínsecamente desestructuradas, que mantienen su funcionalidad a pesar de la falta de una estructura bien definida incluso en condiciones fisiológicas. Tales proteínas, en algunos casos, pueden adoptar una estructura tridimensional definida tras su unión a otras macromoléculas. El 50% de las proteínas de eucariotas tienen al menos una región desestructurada de longitud mayor a 30 aminoácidos.

Muchas proteínas no se cristalizan, por lo tanto, no se puede determinar su estructura tridimensional, aún en los casos en que la cristalización se puede llevar a cabo, hay zonas suficientemente desordenadas como para que el cristal no las incluya. La razón es que algunas proteínas o fragmentos de proteína no tienen estructura ordenada en disolución, como es el caso de las IUP, y su forma recuerda a las formas desnaturalizadas de otras proteínas.
Estas proteínas son importantes en rutas reguladoras y de señalización celular. Suelen estar en puntos de conexión en el centro de redes proteicas que constituyen rutas de señalización.[4][5]
Historia
Trabajos experimentales de finales del siglo XX han demostrado desórdenes estructurales en proteínas y dominios de proteínas. En 1950, la espectroscopia Raman mostró que la caseína de la leche no estaba plegada. Muchas proteínas no se podían cristalizar, pero estos fallos no tuvieron mucho peso porque muchas proteínas de las que se sabe la estructura no se pudieron cristalizar. Dispersiones de proteína con rayos X de ángulo pequeño indicaron un inesperado gran tamaño, lo que ahora se sabe, era consecuencia de regiones sin estructura. También, un gran número de proteínas desarrollaron un comportamiento notablemente extraño, ya que a diferencia de las proteínas estructuradas, eran resistentes al calor y al ácido.
Estas observaciones no se pudieron consensuar para reconocer el desorden en la estructura de las proteínas. Esto fue conseguido finalmente por estudios NMR, que demostraron desórdenes de proteínas importantes fisiológicamente en condiciones nativas y proporcionaron información a nivel de residuos de la estructura y la dinámica.[6]
Estructura
Las proteínas intrínsecamente desestructuradas adoptan una estructura cuando interaccionan con otras proteínas, ácidos nucleicos, membranas o pequeñas moléculas, pero la estructura puede variar dependiendo de la pareja con la que se unan. Esta capacidad les permite adoptar diferentes estructuras e interaccionar con modelos diferentes. De este modo proporcionan funciones biológicas diferentes, ya que se unen para llevar a cabo una función o también por cambios en el ambiente donde se encuentra la proteína.
Las estructuras resultantes pueden ser no compactas (con parte plegadas y otras desestructuradas) o firmemente plegadas.
Las IUPs tienen estructuras dinámicas que se van convirtiendo durante diferentes períodos de tiempo, con similitudes a los estados no rígidos de las proteínas globulares normales. Las 4 conformaciones diferentes de las proteínas son las estructuradas (plegadas, ordenadas), las glóbulo fundido, las glóbulo prefundido y las desestructuradas (no plegadas). En otras palabras, las IUPs pueden estar colapsadas (como glóbulo fundido) o extendidas (como hélices o glóbulo prefundido).
Las proteínas intrínsecamente desestructuradas tienen secuencias de aminoácidos diferenciadas de las otras proteínas. Estas diferencias incluyen la composición de aminoácidos, la complejidad de la secuencia, la hidrofobicidad, el carácter aromático, la carga, la flexibilidad y el tipo de substituciones de aminoácidos a lo largo del tiempo de evolución. Estas regiones son ricas en aminoácidos polares y cargados, con residuos hidrófilos y que tienden a alterar las estructuras ordenadas. Aunque tienen algunas partes hidrofóbicas, estas son poco abundantes, ya que las partes hidrofóbicas promueven un plegamiento espontáneo.
Las IUPs son pobres en aminoácidos hidrofóbicos (Ile, Leu y Val) y aromáticos (Trp, Tyr y Phe), que estabilizan los centros hidrofóbicos de las proteínas globulares estructuradas, y contienen pocos residuos de Cys y Asn. Estos residuos se llaman aminoácidos promotores de orden. Por otra parte, las IUPs están enriquecidas con aminoácidos polares (Gly, Gln, Ser, Pro, Glu y Lys) y destructores de estructuras (Gly y Pro) y con residuos aminoacídicos promotores de desorden, lo que hace que no tengan una estructura definida.[4][5][7][6]
Funciones
El descubrimiento de las funciones de las proteínas intrínsecamente desestructuradas significó refutar el concepto clásico de las proteínas de estructura-función. La demostración de la existencia y abundancia de estas proteínas descubrió también su importante implicación en las diferentes vías de señalización celular y rutas reguladoras.[4]
El desorden estructural y la alta densidad de carga de estas proteínas o regiones proteicas llevó en un inició a pensar, que se trataba de meros conectores entre regiones de las proteínas con estructura secundaria definida. Esta primera función enlazante es una de las múltiples funciones que se les atribuyen actualmente a las proteínas o regiones intrínsecamente desestructuradas, las cuales se consideran multifuncionales (también llamadas moonlighting).[7][5] La diversidad funcional proporcionada por las proteínas intrínsecamente desestructuradas complementa las funciones de las proteínas estructuradas cuya limitación se ve compensada por la flexibilidad de las IUP.[3]
La plasticidad y flexibilidad conformacional de estas moléculas permite la unión con gran variedad de ligandos y proporciona utilidades bioquímicas múltiples.[4][7] Las interacciones moleculares de estas proteínas se caracterizan por uniones de alta especificidad y baja afinidad.[8] Las IUP intervienen específicamente en el reconocimiento molecular y en numerosas interacciones con proteínas (quinasas, factores de transcripción,...), ácidos nucleicos ( ARNt, ARNr, ADN…), membranas, iones o azúcares.[7]
A las proteínas intrínsecamente se les atribuyen 28 funciones distintas registradas en diferentes regiones proteicas desestructuradas.[8]
Estas múltiples funciones que realizan fragmentos intrínsecamente desestructurados en distintas proteínas, pueden clasificarse en 4 grupos:
- Intervención en las modificaciones post-traduccionales de las proteínas (PMT). Se trata de proteínas con regiones desestructuradas en las que estas regiones intervienen en la metilación, la acetilación, la glicosilación, la fosforilación, entre otras PMT. Ejemplos: la topoisomerasa II cuya fracción desestructurada interviene en la fosforilación, el factor de transcripción c-Jun, el factor de transcripción dTAFII230,...
- Interacciones moleculares. Las regiones intrínsecamente desestructuradas participan de la regulación transcripcional y traduccional mediante la unión de proteínas con ácidos nucleicos (ADN, ARNt, ARNr,...), como también intervienen en la creación de interacciones entre proteínas y lípidos, y proteínas y metales. Ejemplos : la histona H5, la fenilalanil-tRNA sintetasa,...
Además las IUP permiten las interacciones entre proteínas y catalizan el ensamblaje de grandes complejos multiproteicos. Ejemplos: La flagelina, la α-sinucleína,... Son proteínas cuyas IUP permiten la unión proteína-proteína y la polimerización.[8][5]
- Intervención en el plegamiento de ácidos nucleicos y proteínas. Las regiones desestructuradas inducen el pliegue de otras proteínas y previenen la creación de agregados, de manera que intervienen como chaperonas desestructuradas tanto en RNA como en sustratos proteicos.[9] Los polipéptidos desestructurados actúan como chaperonas y también forman parte de ellas. La flexibilidad de estas regiones confiere maleabilidad a estas proteínas encargadas del plegamiento.
- Afectación de la entropía. Se encargan de la regulación entrópica de las reacciones.[8]
Estas funciones son las más relevantes y comunes en el ser humano, aun así, encontramos la presencia de estas regiones desestructuradas en muchas otras proteínas y con funciones distintas a las mencionadas. Se les atribuyen funciones espaciadoras o aislantes y almacenadoras. Las IUP actúan también de reservorios o depósitos de material de deshechos posteriormente a la unión a iones y moléculas.[5]
Son en definitiva, polipéptidos sin estructura definida con múltiples utilidades e imprescindibles para la biosíntesi de proteínas, la formación de complejos macromoleculares y infinitas reacciones enzimáticas que requieren de la alta especificidad, la baja afinidad y la flexibilidad de estas regiones.[8]
Las IUP y la respuesta al estrés
Existen proteínas no estructuradas llamadas hidrofilinas que se encuentran presentes en todos los grupos taxonómicos y cuya acumulación está asociada a organismos expuestos a condiciones de limitación de agua. Un ejemplo surge del estudio de un grupo de hidrofilinas llamadas proteínas LEA en plantas.[7] Éstas se presentan de manera abundante en la etapa tardía de la embriogénesis de la semilla debido a que ocurre una desecación natural muy alta[10] y posteriormente en los tejidos vegetativos sometidos a déficit hídrico (sequía, salinidad y congelamiento).[11]
Identificación y análisis
Hay diversos métodos para identificar estructuras intrínsecamente desordenadas, basados en los métodos de análisis de la estructura tridimensional de las proteínas.
Cristalografía de rayos X
La cristalografía de rayos X es una técnica espectroscópica basada en la difracción de los rayos X al entrar en contacto con sólidos en estado cristalino. Permite obtener información acerca de la localización de los átomos de una estructura cristalina y como consecuencia, de la estructura tridimensional de una molécula o en este caso de una proteína.[5][12] Un requisito esencial para el funcionamiento de la técnica es que la muestra tenga una estructura cristalina, cuando no la tiene la espectroscopia detecta una carencia de densidad electrónica y no se puede encontrar la estructura tridimensional. Las proteínas intrínsecamente desestructuradas al no poder cristalizarse se presentan de este modo en la espectroscopia de rayos X, como una carencia de densidad electrónica. Así pues la cristalografía de rayos X permite ver si una región tiene una baja densidad electrónica, y esto puede indicar la presencia de una región intrínsecamente desestructurada. Sin embargo esta situación también puede ser debida a que no se haya encontrado la manera de cristalizar una proteína, de modo que esta técnica tiene el sesgo de no poder asegurar la presencia de una proteína intrínsecamente desestructurada.[13]
Espectroscopia de resonancia magnética nuclear
La espectroscopia de resonancia magnética nuclear es el principal método para obtener información acerca de las proteínas intrínsecamente desestructuradas. Primeramente presenta una ventaja respecto la cristalografía de rayos X ya que no hace falta que las proteínas estén cristalizadas, para este método se usan proteínas en disolución. Por esta razón hay menos error en la estimación del encuentro de regiones intrínsecamente desestructuradas. En las proteínas estructuradas los picos individuales de resonancia están repartidos, es decir, tienen un desplazamiento químico distinto. Por otro lado, en las proteínas intrínsecamente desestructuradas los picos tienen tendencia a estar mucho más cerca o a superponerse, es decir los desplazamientos químicos son muy parecidos. Estas diferencias permiten la identificación de regiones intrínsecamente desestructuradas de manera precisa.[13][14]
Proteólisis
La proteólisis consiste en el uso de enzimas proteoliticas para obtener información sobre la estructura de una proteína y su flexibilidad. Las proteínas intrínsecamente desestructuradas o las regiones intrínsecamente desestructuradas son más sensibles a la proteólisis que las proteínas estructuradas, la digestión por proteasas es mucho más rápida debido a su estructura.[15] La ventaja de esta técnica es que aporta información específica sobre la posición de las regiones intrínsecamente desestructuradas. Es especialmente útil en conjunto con otras técnicas. Usada juntamente con la cristalografía de rayos X permite saber si una región con baja densidad electrónica está realmente intrínsecamente desordenada. También lo asegura su uso juntamente con la espectroscopia de RMN.[13][14]
Espectroscopia de dicroismo circular
La espectroscopia en el DC lejano proporciona estimaciones de la estructura secundaria de una proteína. En la espectroscopia en el DC cercano, se muestran picos altos para los grupos aromáticos en proteínas ordenadas, mientras que en las desestructuradas los picos desaparecen debido al “motional averaging”.[13]
Esta técnica tiene la limitación de que tan solo es semi-cuantitativa, de modo que no aporta datos del todo claros.
Difracción de rayos X a bajo ángulo
La difracción de rayos X a bajo ángulo (SAXS) permite identificar regiones intrínsecamente desestructuradas. Los átomos de las proteínas intrínsecamente desestructuradas tienen un radio anormalmente grande y la técnica de SAXS identifica esta característica, así que permite encontrar regiones desestructuradas de este modo. Es especialmente útil en combinación con la cristalografía de rayos X y la espectroscopia de dicroismo circular.[13][14]
Incidencia en la salud
En los últimos años se ha hallado una clara relación entre algunas enfermedades y proteínas intrínsecamente desestructuradas. En humanos, se han relacionado con IDPs enfermedades tan comunes como el cáncer, enfermedades cardiovasculares, neurodegenerativas, el Sida, la obesidad, la diabetes y la amiloidosis.[16] El 79 % de las proteínas asociadas con el cáncer, el 66 % de las proteínas con funciones en señalización celular y el 61 % de las proteínas relacionadas con enfermedades cardiovasculares contienen regiones desestructuradas de más de 30 aminoácidos.[17][18] La relación entre IDPs y numerosas enfermedades existe gracias a algunas de las características de las proteínas intrínsecamente desestructuradas. Estas propiedades son:
- Su habilidad para plegarse en entrar en contacto con otra proteína o con un ácido nucleico. Las regiones donde acostumbran a ocurrir las interaccionen entre proteínas se denominan α-MoRF. El número de MORFs que se encuentran en una IDP es de vital importancia para la descubierta de fármacos.
- Su regulación funcional vía splicing alternativo (AS) o via modificaciones postraduccionales.
- Su plasticidad y promiscuidad a formar interacciones. Una región desestructurada puede unirse a diferentes moléculas y diferentes regiones de la proteína desestructurada pueden unirse a una única región de la otra molécula.[16]
IDP y cáncer
Las células cancerígenas son aquellas que han perdido su capacidad para controlar la división celular. Diversas proteínas relacionadas con la aparición de tumores malignos, como la p27, p53, la AFP y BRCA1, tienen regiones desestructuradas.
- p27: Tiene un papel central en la regulación de la división celular en mamíferos. Inhibe varias enzimas llamadas proteína quinasas, que facilitan la división celular, enrollándose a su alrededor. Además, la falta de estructurada de la p27 facilita que pueda interaccionar con diversas diana. Como más bajos son los niveles de p27 en un paciente enfermo de cáncer, peor es el pronóstico.[5]
- p53: Esta proteína es un factor de transcripción que está en el centro de una gran red de señales de regulación de la expresión de genes. Reconoce genes relacionados con la regulación del ciclo celular y con la apoptosis. Normalmente se encuentran en niveles bajos, pero cuando se detectan daños en el ADN aumentan los niveles de p53 iniciando así un proceso de protección. Mediante la regulación de la transcripción de unos genes específicos, detiene la división celular hasta que se repare el daño. Si el daño es demasiado grave, la p53 inicia un proceso de muerte celular programada.[19] En los últimos años han surgido numerosos estudios sobre la interacción entre la p53 y la proteína Mdm2 (llamada Hdm2 en humanos). Esta última inactiva la proteína p53 al unirse en su dominio de transcripción activa. Esta interacción causa una pérdida de la funcionalidad de la p53 que frecuentemente da lugar a la transformación cancerosa de la célula.[16]
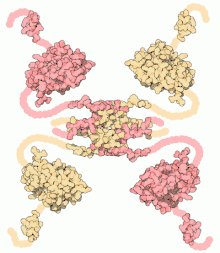 Estructura de la proteína p53.
Estructura de la proteína p53.
Farmacología
Las interacciones entre proteínas son de gran interés farmacológico, ya que pueden ser el objetivo de una futura medicación. El estudio de las uniones entre dos proteínas es vital para poder obtener fármacos capaces de modular las uniones entre proteínas y así interrumpir la acción de proteínas relacionadas con patologías. En muchas interacciones proteína-proteína una de estas está intrínsecamente desestructurada.[16]
Referencias
- Song, Jikui; Lee, Min S.; Carlberg, Inger; Vener, Alexander V.; Markley, John L. (26 de diciembre de 2006). «Micelle-induced folding of spinach thylakoid soluble phosphoprotein of 9 kDa and its functional implications». Biochemistry 45 (51): 15633-15643. ISSN 1520-4995. PMC 2533273. PMID 17176085. doi:10.1021/bi062148m. Consultado el 16 de marzo de 2023.
- Dyson, H. Jane; Wright, Peter E. (Marzo de 2005). «Intrinsically unstructured proteins and their functions». Nature Reviews. Molecular Cell Biology 6 (3): 197-208. ISSN 1471-0072. PMID 15738986. doi:10.1038/nrm1589. Consultado el 16 de marzo de 2023.
- Dunker, A. Keith; Silman, Israel; Uversky, Vladimir N.; Sussman, Joel L. (Diciembre de 2008). «Function and structure of inherently disordered proteins». Current Opinion in Structural Biology 18 (6): 756-764. ISSN 1879-033X. PMID 18952168. doi:10.1016/j.sbi.2008.10.002. Consultado el 16 de marzo de 2023.
- Stryer, Lubert (1995). Biochemistry. New York : W.H. Freeman. ISBN 978-0-7167-2009-6. Consultado el 16 de marzo de 2023.
- Nelson, David L.; Cox, Michael M. (2014). Principios De Bioquimica Lehninger 6ed (en portugués). Consultado el 16 de marzo de 2023.
- Tompa, Peter (Diciembre de 2012). «Intrinsically disordered proteins: a 10-year recap». Trends in Biochemical Sciences 37 (12): 509-516. ISSN 0968-0004. PMID 22989858. doi:10.1016/j.tibs.2012.08.004. Consultado el 16 de marzo de 2023.
- Velázquez, César Luis Cuevas; Robles, Alejandra Covarrubias (2011). «Las proteínas desordenadas y su función: una nueva forma de ver la estructura de las proteínas y la respuesta de las plantas al estrés». TIP Revista Especializada en Ciencias Químico-Biológicas 14 (2): 97-105. ISSN 2395-8723. Consultado el 16 de marzo de 2023.
- Dunker, A. Keith; Brown, Celeste J.; Lawson, J. David; Iakoucheva, Lilia M.; Obradović, Zoran (28 de mayo de 2002). «Intrinsic disorder and protein function». Biochemistry 41 (21): 6573-6582. ISSN 0006-2960. PMID 12022860. doi:10.1021/bi012159+. Consultado el 16 de marzo de 2023.
- Tompa, Peter; Kovacs, Denes (Abril de 2010). «Intrinsically disordered chaperones in plants and animals». Biochemistry and Cell Biology = Biochimie Et Biologie Cellulaire 88 (2): 167-174. ISSN 1208-6002. PMID 20453919. doi:10.1139/o09-163. Consultado el 16 de marzo de 2023.
- Dure, L.; Galau, G. A. (Julio de 1981). «Developmental Biochemistry of Cottonseed Embryogenesis and Germination : XIII. REGULATION OF BIOSYNTHESIS OF PRINCIPAL STORAGE PROTEINS». Plant Physiology 68 (1): 187-194. ISSN 0032-0889. PMID 16661868. doi:10.1104/pp.68.1.187. Consultado el 16 de marzo de 2023.
- Bies-Ethève, Natacha; Gaubier-Comella, Pascale; Debures, Anne; Lasserre, Eric; Jobet, Edouard; Raynal, Monique; Cooke, Richard; Delseny, Michel (Mayo de 2008). «Inventory, evolution and expression profiling diversity of the LEA (late embryogenesis abundant) protein gene family in Arabidopsis thaliana». Plant Molecular Biology 67 (1-2): 107-124. ISSN 0167-4412. PMID 18265943. doi:10.1007/s11103-008-9304-x. Consultado el 16 de marzo de 2023.
- Alberts, Bruce (2015). Molecular biology of the cell. New York, NY : Garland Science, Taylor and Francis Group. ISBN 978-0-8153-4432-2. Consultado el 16 de marzo de 2023.
- Dunker, A. K.; Lawson, J. D.; Brown, C. J.; Williams, R. M.; Romero, P.; Oh, J. S.; Oldfield, C. J.; Campen, A. M. et al. (2001). «Intrinsically disordered protein». Journal of Molecular Graphics & Modelling 19 (1): 26-59. ISSN 1093-3263. PMID 11381529. doi:10.1016/s1093-3263(00)00138-8. Consultado el 16 de marzo de 2023.
- Oldfield, Christopher J.; Dunker, A. Keith (2014). «Intrinsically disordered proteins and intrinsically disordered protein regions». Annual Review of Biochemistry 83: 553-584. ISSN 1545-4509. PMID 24606139. doi:10.1146/annurev-biochem-072711-164947. Consultado el 16 de marzo de 2023.
- Suskiewicz, Marcin J.; Sussman, Joel L.; Silman, Israel; Shaul, Yosef (Agosto de 2011). «Context-dependent resistance to proteolysis of intrinsically disordered proteins». Protein Science: A Publication of the Protein Society 20 (8): 1285-1297. ISSN 1469-896X. PMC 3189518. PMID 21574196. doi:10.1002/pro.657. Consultado el 16 de marzo de 2023.
- Uversky, Vladimir N.; Oldfield, Christopher J.; Dunker, A. Keith (2008). «Intrinsically disordered proteins in human diseases: introducing the D2 concept». Annual Review of Biophysics 37: 215-246. ISSN 1936-122X. PMID 18573080. doi:10.1146/annurev.biophys.37.032807.125924. Consultado el 16 de marzo de 2023.
- Vucetic, Slobodan; Xie, Hongbo; Iakoucheva, Lilia M.; Oldfield, Christopher J.; Dunker, A. Keith; Obradovic, Zoran; Uversky, Vladimir N. (Mayo de 2007). «Functional anthology of intrinsic disorder. 2. Cellular components, domains, technical terms, developmental processes, and coding sequence diversities correlated with long disordered regions». Journal of Proteome Research 6 (5): 1899-1916. ISSN 1535-3893. PMC 2588346. PMID 17391015. doi:10.1021/pr060393m. Consultado el 16 de marzo de 2023.
- Cheng, Yugong; LeGall, Tanguy; Oldfield, Christopher J.; Dunker, A. Keith; Uversky, Vladimir N. (5 de septiembre de 2006). «Abundance of intrinsic disorder in protein associated with cardiovascular disease». Biochemistry 45 (35): 10448-10460. ISSN 0006-2960. PMID 16939197. doi:10.1021/bi060981d. Consultado el 16 de marzo de 2023.
- Goodsell, David (2002). «p53 Tumor Suppressor». Protein Data Bank. Archivado desde el original el 26 de marzo de 2015. Consultado el 27 de octubre de 2015.
