Química host-guest
En química supramolecular,[1] la química anfitrión-huésped describe complejos compuestos por dos o más moléculas o iones unidos en una relación estructural única sostenida por fuerzas diferentes a los enlaces covalentes. La química anfitrión-huésped abarca la idea del reconocimiento molecular a través de interacciones no covalentes. Dichas interacciones son críticas para mantener la estructura tridimensional de moléculas grandes (como proteínas) y está involucrada en diversos procesos biológicos en los que moléculas grandes se unen a otras de manera específica pero temporal.
A pesar de que las interacciones no covalentes pueden dividirse de forma general entre las principalmente electrostáticas y las principalmente dispersivas, hay algunos tipos de interacciones que cabe resaltar.
- Interacciones iónicas (predominantemente electrostáticas)
- Puentes de hidrógeno y Puentes de halógeno
- Fuerzas de Van der Waals (dipolo-dipolo, dipolo-dipolo inducido, dipolo instantáneo-dipolo inducido)
- Interacciones hidrofóbicas (predominantemente dispersivas)
Algunas de las interacciones enlistadas pueden combinarse en cierto grado.[2]
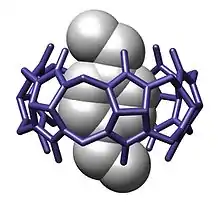
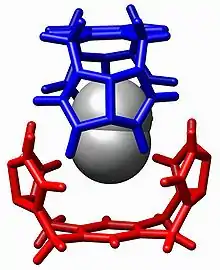
Panorama general
La química anfitrión-huésped es una rama de la química supramolecular en la que una molécula huésped forma un compuesto químico con una molécula anfitrión o un ion. Ambos componentes del compuesto están unidos mediante interacciones no covalentes, usualmente puentes de hidrógeno. La unión entre el anfitrión y el huésped usualmente es altamente específica para ambas partes. La formación de estos complejos es el objeto de estudio del reconocimiento molecular.
Existe un equilibrio entre la forma libre en la que el huésped y el anfitrión están separados, y la forma conjunta, en la que existe un complejo estructuralmente definido que contiene al huésped y al anfitrión.
- H ="Anfitrión" (Host), G ="huésped" (Guest), HG ="complejo huésped-anfitrión" (Host-Guest complex)
La molécula que funciona como anfitrión suele ser la molécula más grande, la cual envuelve a la molécula más pequeña (el huésped). En sistemas biológicos, los términos análogos a huésped y anfitrión son enzima (anfitrión) y substrato (huésped).[5]
Para diseñar sistemas sintéticos que lleven a cabo funciones específicas, es importante entender la termodinámica de la unión entre el anfitrión y el huésped. Los químicos se enfocan en el intercambio de energía de diferentes interacciones enlazantes y se intentan desarrollar experimentos que cuantifiquen los orígenes fundamentales de estas interacciones no covalentes mediante el uso de técnicas como la resonancia magnética nuclear, espectroscopía UV-visible y calorimetría de titulación isotérmica.[6] El análisis cuantitativo de los valores de las constantes de complejación proveen información termodinámica útil.[5]
Principios termodinámicos de las interacciones
Las ventajas termodinámicas de la química anfitrión-huésped surgen de la idea de que la energía libre de Gibbs total es menor debido a la interacción entre ambas especies. Los químicos supramoleculares se dedican a medir la energía y las propiedades termodinámicas de estas interacciones no covalentes con el objetivo de ampliar la visión acerca de los resultados de la combinación de todas las pequeñas fuerzas no covalentes que se usan para generar un efecto total sobre la estructura supramolecular.
Una constante de asociación K°a puede ser definida por la expresión
Donde {HG] es la actividad termodinámica del complejo al equilibrio. {H} representa la actividad del anfitrión y {G}, la actividad del huésped. Las cantidades [HG], [H] y [G] son las concentraciones de las correspondientes sustancias y Γ es el cociente de los coeficientes de actividad.
En la práctica, la constante de equilibrio está definida en términos de las concentraciones.[7]
Cuando se usa esta definición, se implica que el cociente de los coeficientes de actividad tiene un valor numérico de 1. Por lo tanto, se observa que la constante de equilibrio Ka tiene unidades de [concentración]-1, sin embargo, esto no puede ser posible pues el cambio en la energía libre de Gibbs en condiciones estándar es proporcional al logaritmo de Ka y los logaritmos no tienen unidades.
Esta paradoja se resuelve al definir la dimensión de Γ como el recíproco (inverso) de la dimensión del cociente de las concentraciones. Esto implica que Γ tiene un valor constante bajo todas las condiciones experimentales relevantes. Sin embargo, es común que se le asigne una dimensión como milimol/litro o micromol/litro a un valor de K que ha sido determinado experimentalmente.
Un valor grande de Ka indica que el anfitrión y el huésped interactúan fuertemente para formar el complejo.[5]
Determinación de la constante de asociación.
Complejación simple anfitrión-huésped
Cuando el anfitrión y el huésped se combinan para formar un complejo único, el equilibrio se representa de la siguiente manera:
Y la constante de equilibrio K se define como:
Donde [ i ] representa la concentración de la especie química i (se asume que los coeficientes de actividad tienen un valor de 1).
Las ecuaciones del balance de masa son:
Donde GT y HT representan las concentraciones totales del anfitrión (H) y el huésped (G). Estas ecuaciones pueden ser reducidas a una sola ecuación cuadrática en, por ejemplo, [G], y tienen solución analítica para cualquier valor de K. Las concentraciones [H] y [HG] posteriormente pueden ser deducidas.
El siguiente paso es calcular el valor de una cantidad correspondiente a la . Entonces, la suma de cuadrados U sobre todos los puntos puede definirse como:
Y puede minimizarse con respecto al valor de la constante de estabilidad K y a un parámetro como el desplazamiento químico de las especies HG (datos de RMN) o su absorbancia molar (datos UV-visible). La minimización puede ser realizada en una hoja de cálculo usando herramientas de solución de ecuaciones.
El procedimiento solo es válido cuando se tiene la certeza de que el producto 1:1 es el único complejo formado. Una forma de validar la suposición es comprobar que los residuales muestren una distribución aleatoria; de lo contrario, se debe considerar la formación de especies con otras estequiometrías.
Datos de resonancia magnética nuclear (RMN)
Con espectros de RMN, el desplazamiento químico observado (que surge de un átomo contenido en una molécula reactiva o en uno o más complejos de dicho reactivo), será el promedio ponderado respecto a la concentración de todos los desplazamientos de las especies químicas. El intercambio químico se asume rápido en la escala de tiempo de la RMN. En términos de fracción mol:
Donde es el desplazamiento químico de la i-ésima especie que contiene el núcleo analizado y es la concentración expresada en fracción mol, la cual se calcula de la siguiente manera:
c es la concentración de la especie j en mol/dm³. La expresión tiene la misma forma que la ley de Beer.[1]
Referencias
- Steed, Jonathan W., 1969- (2009). Supramolecular chemistry (2nd ed edición). Wiley. ISBN 0-470-51234-2. OCLC 251208094. Consultado el 23 de abril de 2020.
- Lodish, Harvey F.; Berk, Arnold.; Kaiser, Chris.; Krieger, Monty.; Scott, Matthew P.; Bretscher, Anthony.; Ploegh, Hidde L.; Matsudaira, Paul T. (2008). Molecular cell biology (6th ed edición). W.H. Freeman. ISBN 0-7167-4366-3. OCLC 83758878. Consultado el 23 de abril de 2020.
- Freeman, W. A. (1 de agosto de 1984). «Structures of the p-xylylenediammonium chloride and calcium hydrogensulfate adducts of the cavitand 'cucurbituril', C36H36N24O12». Acta Crystallographica Section B: Structural Science (en inglés) 40 (4): 382-387. ISSN 0108-7681. doi:10.1107/S0108768184002354. Consultado el 23 de abril de 2020.
- Valdés, Carlos; Toledo, Leticia M.; Spitz, Urs; Rebek Jr., Julius (1 de agosto de 1996). «Structure and Selectivity of a Small Dimeric Encapsulating Assembly». Chemistry – A European Journal 2 (8): 989-991. ISSN 0947-6539. doi:10.1002/chem.19960020814. Consultado el 23 de abril de 2020.
- Anslyn, Eric V., 1960- (2006). Modern physical organic chemistry. University Science. ISBN 1-891389-31-9. OCLC 55600610. Consultado el 23 de abril de 2020.
- Piñeiro, Ángel; Banquy, Xavier; Pérez-Casas, Silvia; Tovar, Edgar; García, Abel; Villa, Alessandra; Amigo, Alfredo; Mark, Alan E. et al. (1 de mayo de 2007). «On the Characterization of Host−Guest Complexes: Surface Tension, Calorimetry, and Molecular Dynamics of Cyclodextrins with a Non-ionic Surfactant». The Journal of Physical Chemistry B 111 (17): 4383-4392. ISSN 1520-6106. doi:10.1021/jp0688815. Consultado el 23 de abril de 2020.
- Skoog, Douglas A.; West, Donald M.,; Holler, F. James,; Crouch, Stanley R.,; Mora Lugo, Eugenio de la,. Fundamentos de química analítica / Douglas A. Skoog, Donald M. West, F. James Holler, Stanley R., Crouch ; traducción Dr. Eugenio de la Mora Lugo, M. en C. Jesús Miguel Torres Flores. (Novena edición edición). ISBN 978-607-519-377-9. OCLC 905620069. Consultado el 23 de abril de 2020.