Regulación de la expresión génica
La regulación génica comprende todos aquellos procesos celulares que aumentan o disminuyen los productos finales de los genes (proteínas o ARN). En la naturaleza encontramos una gran variedad de procesos regulatorios, por ejemplo, en el desarrollo, la respuesta a estímulos del ambiente o la adaptación a una nueva fuente alimenticia. Se puede decir que casi cualquier paso de la expresión génica puede ser modulada, desde la iniciación de la transcripción, al procesamiento de ARN o una modificación pos-traduccional de una proteína. Normalmente un gen regulador controla a otro, por eso se habla de redes regulatorias.

La regulación génica es esencial para los virus, procariotas y eucariotas, ya que permite la versatilidad y adaptabilidad de estos organismos frente a su entorno al permitirles expresar ciertas proteínas frente a determinada necesidad. En el caso de organismos multicelulares, la regulación génica puede conducir a procesos de diferenciación celular y morfogénesis en el embrión, lo que produce diferentes linajes celulares con perfiles de expresión diferentes del mismo genoma.
Historia
Desde 1951 Barbara McClintock demostró la interacción entre dos loci diferentes –Activador (Ac) y Dissociador (Ds)– en el desarrollo del color en las semillas del maíz. Pero fue hasta el trabajo del Operón Lactosa por parte de François Jacob y Jacques Monod, que se consideró la identificación de un sistema de regulación genético. Ya que se describió como las enzimas relacionadas con el metabolismo de la lactosa eran expresadas por E. coli solo en la presencia de lactosa y la ausencia de glucosa.
Desde entonces la Biología del Desarrollo ha descrito diferentes redes de regulación, pero el cuestionamiento sobre el origen y la evolución de estas redes es la pregunta central de la Biología Evolutiva del Desarrollo (Evo-Devo).
Etapas reguladas de la expresión génica
Todas las etapas de la expresión génica pueden ser moduladas, desde el la transcripción de ADN a ARN hasta la modificación pos-traduccional de la proteína. A contínuación hay un listado de las etapas donde hay regulación. La más extensa de ellas es la iniciación de la transcripción:
- Apertura de la Cromatina
- Transcripción
- Modificación pos-transcripcional
- Transporte del ARN
- Traducción
- Degradación del ARNm
Modificación de la Cromatina y el ADN
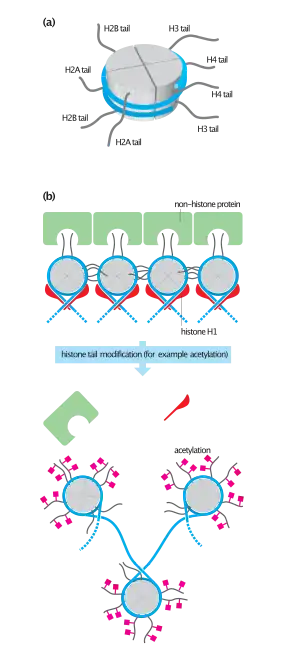
Para los eucariotas el acceso a largas regiones del ADN dependen de la estructura de la cromatina, que puede ser alterada por modificación de las histonas. Así mismo puede modificarse la cadena de ADN, producto de Metilación, ARN no codificantes o proteínas con unión al ADN. Cada una de estas modificaciones pueden incrementar o disminuir la expresión genética. Estas modificaciones al no alterar el código genético no son directamente heredables y se conocen como modificaciones epigenéticas.
Modificaciones estructurales
Complejos octaméricos de proteínas –llamados nucleosomas– son responsables por el super-enrrollamiento del ADN. Estos complejos pueden ser modificados temporalmente por procesos como la fosforilación, acetilación o metilación. Estas modificaciones suelen ser responsables por cambios semi-permanentes en los niveles de expresión. En general, la densidad de empaquetamiento es un indicativo de la frecuencia de transcripción.[1]
Modificaciones químicas
La metilación sobre el ADN es un método ampliamente conocido para la represión génica. Este proceso suele llevarse a cabo por metil-transferasas sobre las citosinas de secuencias repetitivas C-G (islas CpG).
El análisis de los patrones de metilación en ciertas regiones del ADN –por ejemplo un promotor– puede llevarse a cabo por un mapeo con Bisulfito. Esta técnica se basa en que los residuos de Citosina serán modificados a Uracilo por el bisulfito, a menos que estén metiladas. Al hacer un análisis de secuencias entre secuencias bisulfitadas y normales dará el patrón de metilación de la región.
Regulación de la transcripción
La Regulación en la transcripción controla directamente la cantidad de ARN que es sintetizada. Teniendo en cuenta que el proceso es llevado a cabo por la ARN polimerasa, esta se puede alterar por diferentes mecanismos:
Los factores de especificidad son secuencias cortas de aminoácidos que regulan el reconocimiento del promotor por parte de la RNA Polimerasa. El más conocido de estos es el Factor Sigma de E. coli.
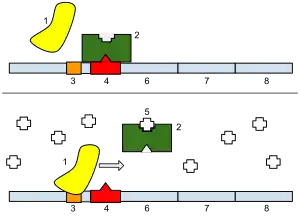
De manera similar encontramos Represores, proteínas capaces de unirse al Operador del gen –u otras regiones represoras–. Por la cercanía al promotor, bloquea físicamente la unión de la RNA polimerasa evitando así la transcripción.
Existen Factores de Transcripción, que facilitan la unión de la RNA Polimerasa. Junto a los Enhancers y Activadores cumplen funciones similares pero opuestas a las de los represores. Estimulando la unión a la hebra de ADN, generando más ARN mensajero.
Regulación en el Cáncer
Se ha visto que en algunos cánceres –como el colorrectal– las islas CpG suelen estar afectadas por 3 a 6 mutaciones iniciales que terminan en la aparición incidental de 33 a 66 mutaciones.[2] Del mismo modo, existen más 600 genes que se silencian por islas CpG en este mismo tipo de cáncer. En casos de Cáncer de mama, represiones de genes como BRCA1 ocurren más frecuentemente por sobre-expresión de microARNs.[3]
Regulación en las adicciones
Debido a la persistencia de las adicciones, este comportamiento logra tener una huella epigenética que genera efectos genéticos a largo plazo, sobre todo en el cerebro.[4]
Por ejemplo el abuso de drogas suele causar tres tipos de alteraciones epigenéticas: metilaciones y acetilaciones de histonas, metilación de islas CpG e irregularidades en la producción de microARN.
El tabaquismo probado en ratones llevó a la acetilación de histonas, que incidió en un aumento de proteínas como la FosB.[5] En estudios en 16.000 humanos, de diferentes niveles de tabaquismo se encontró más de 18.000 islas CpG de eritrocitos con problemas en la metilación, afectando más de 7000 genes (un tercio de la totalidad de genes humanos). La mayoría de estos problemas se ven reversados después de 5 años de dejar de fumar, sin embargo quedan "cicatrices moleculares" sobre 942 genes.[6]
Regulación pos-transcripcional
Una vez se trancribió el AD y tenemos el ARN mensajero, hay cierto nivel de regulación relacionada en cuanto ARN mensajero es traducido en proteína. Las células logran esto mediante la modulación del las caperuzas, splicing, la adición de colas poli-A, la tasa de exportación de secuencias desde el núcleo y en muchos casos el secuestro de los transcritos de ARN. Procesos llevados a cabo exclusivamente por eucariotas.
Esta modulación es mediada por proteínas u otros ARN que tendrán afinidad por ciertas secuencias.
Procedimiento del pre-mRNA eucarionte
Las células eucaritas convierten el transcripto primario inicial sintetizado por la ARN polimerasa II en un mARN funcional. Tres eventos principales tienen lugar durante el proceso:
- Formación de la caperuza 5’: Las moléculas de ARN nacientes producidas por el ARN polimeraa II alcanzan una longitud de 25-30 nucleótidos, se añaden a sus extremos 5’ la 7-metilguanosina. En este paso, el RNA es catalizado por una enzima dimérica formadora del caperuza, la cual se asocia con el dominio carboxiloterminal (CTD) de la ARN polimerasa II.
- Poliadenilación 3’: El corte y poliadenilación 3’ de los pre-mRNA están estrechamente relacionados. El ensamblaje del gran complejo "corte/ poliadenilación multiproteico" alrededor de la señal poli A rica en A-U de los pre-mARN es análogo en muchos aspectos a la formación del complejo de preiniciación de la transcripción en la caja TATA (rica en A-T) de una molécula de ADN molde.
- Corte y empalme del ARN: El corte y empalme del ARN se produce en secuencias conservadas cortas de los pre-mRNA mediante dos reacciones de transesterificación.
El proceso tiene lugar en el núcleo a medida que el pre-mRNA se transcribe. Posteriormente el mRNA funcional producido es exportdo al citoplasma.

Regiones 3' no traducidas (3'-UTR) y micro ARN
Las regiones 3' no traducidas (en inglés 3'-UTRs) del ARN mensajero suelen albergar regiones reguladoras con una influencia pos-transcripcional de la expresión génica.
Estas regiones 3'-UTR contienen sitios de unión para micro ARNs (mi ARN) y proteínas regulatorias. Al unirse a estas regiones los miARN pueden disminuir la expresión de varios mARN al inhibir la traducción o provocando de manera directa la degradación del transcrito. Esta región puede tener regiones represoras para inhibir la expresión del mARN.
Experimentos directos han demostrado que un solo miARN puede reducir la estabilidad de cientos de mARN únicos.[7]
La pérdida de regulación de estos miARN ha demostrado tener serios efectos en enfermedades como: Cáncer, Esquizofrenia, Trastorno bipolar, trastorno depresivo, enfermedad de Parkinson, enfermedad de Alzheimer y trastornos del espectro autista.
Regulación de la traducción
La traducción del mARN puede ser controlada por un número diverso de mecanismos, la mayoría a nivel de la iniciación. El reclutamiento de la unidad pequeña del ribosoma puede ser modulada por la estructura secundaria del mARN, por la unión de una proteína o de ARN complementario.
Tanto en procariotas como en eucariotas existe una gran cantidad de proteínas que se unen al ARN, la mayoría reconocen la estructura secundaria del transcrito, que puede cambiar bajo diferentes condiciones (temperatura o ligando).
Algunos transcritos pueden actuar como ribozimas, regulandose a sí mismas.

Modificación pos-traduccional
Es la modificación química de una proteína después de su traducción. Se puede transformar la estructura de la proteína:
- Adicionándole un grupo funcional (acetato, lípido, carbohidrato, fosfato) cambiando así la naturaleza de sus aminoácidos
- Cambiar su estructura añadiendo puentes disulfuro o romperla por acción de una enzima.
Existen otras formas para modificar una proteína, como la fosforilación, que sirven para controlar el comportamiento de una proteína (como activar o inhibir una enzima).
Ejemplos de regulación génica
- Proteínas de choque térmico en la mosca de la fruta Drosophila melanogaster.
- Operón Lac que se regula según el tipo de alimento presente.
- El uso de sistemas colineales en virus, regulados por anti-terminadores (Fago lambda) o moduladores de splicing (VIH).
- El activador transcripcional Gal4, que controla el metabolismo de galactosa en levadura, activando GAL1, GAL7 y GAL10. Este mecanismo permitió desarrollar el sistema GAL4/UAS, que permite el estudio de expresión génica in vivo.
Biología del Desarrollo
El estudio de los sistemas de regulación ha sido provisto en su mayoría por la Biología del desarrollo. De los más importantes son:
- El efecto de los genes Hox en la segmentación antero-posterior.
- La importancia de los gradientes de Sonic Hedgehog (SHH) desde la zona de actividad polarizante en las extremidades, que conllevan a la formación de los dígitos.
- La formación de somitas a partir de mesodermo. Mediante la interacción del Ácido retinóico, WNT y el FGF.
- La determinación sexual a partir de la proporción entre cromosomas autosómicos y sexuales en Drosophila.
Véase también
Referencias
- Pierce, B.A. 2010. Genética. Un enfoque conceptual. 3ª edición. Editorial Médica Panamericana.
- Becker, W.M. Kleinsmith, L.J. Hardin, J. & Bertoni,G.P. (2009) The World of the Cell (17th edition). Pearson Education, Inc.
- Gilbert, Scott F., 1949-. Developmental biology (Eleventh edition edición). ISBN 978-1-60535-470-5. OCLC 945169933. Consultado el 5 de mayo de 2020.
- Vogelstein, B.; Papadopoulos, N.; Velculescu, V. E.; Zhou, S.; Diaz, L. A.; Kinzler, K. W. (29 de marzo de 2013). «Cancer Genome Landscapes». Science (en inglés) 339 (6127): 1546-1558. ISSN 0036-8075. PMC 3749880. PMID 23539594. doi:10.1126/science.1235122. Consultado el 5 de mayo de 2020.
- Tessitore, Alessandra; Cicciarelli, Germana; Del Vecchio, Filippo; Gaggiano, Agata; Verzella, Daniela; Fischietti, Mariafausta; Vecchiotti, Davide; Capece, Daria et al. (2014). «MicroRNAs in the DNA Damage/Repair Network and Cancer». International Journal of Genomics (en inglés) 2014: 1-10. ISSN 2314-436X. doi:10.1155/2014/820248. Consultado el 5 de mayo de 2020.
- Nestler, Eric J. (2014-01). «Epigenetic mechanisms of drug addiction». Neuropharmacology (en inglés) 76: 259-268. doi:10.1016/j.neuropharm.2013.04.004. Consultado el 5 de mayo de 2020.
- Levine, A.; Huang, Y.; Drisaldi, B.; Griffin, E. A.; Pollak, D. D.; Xu, S.; Yin, D.; Schaffran, C. et al. (2 de noviembre de 2011). «Molecular Mechanism for a Gateway Drug: Epigenetic Changes Initiated by Nicotine Prime Gene Expression by Cocaine». Science Translational Medicine (en inglés) 3 (107): 107ra109-107ra109. ISSN 1946-6234. doi:10.1126/scitranslmed.3003062. Consultado el 5 de mayo de 2020.
- Robison, Alfred J.; Nestler, Eric J. (2011-11). «Transcriptional and epigenetic mechanisms of addiction». Nature Reviews Neuroscience (en inglés) 12 (11): 623-637. ISSN 1471-003X. doi:10.1038/nrn3111. Consultado el 5 de mayo de 2020.
- Lim, Lee P.; Lau, Nelson C.; Garrett-Engele, Philip; Grimson, Andrew; Schelter, Janell M.; Castle, John; Bartel, David P.; Linsley, Peter S. et al. (2005-02). «Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs». Nature (en inglés) 433 (7027): 769-773. ISSN 0028-0836. doi:10.1038/nature03315. Consultado el 5 de mayo de 2020.