Síntesis malónica
La síntesis malónica es un tipo de síntesis utilizada en química orgánica para obtener derivados mono- o disustituidos del ácido acético.[1]
Mecanismo
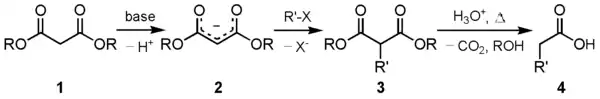
El éster malónico 1, normalmente malonato de etilo, es desprotonado por una base fuerte, por ejemplo etóxido de sodio (EtONa), dando el carbanión estabilizado por resonancia 2. Éste (2) es un nucleófilo que puede ser alquilado por un haluro de alquilo en una reacción de sustitución nucleófila dando el producto intermedio 3. Una segunda alquilación aquí sería posible ya que todavía queda un hidrógeno ácido en la posición α dicarboxílica. Así pues un segundo equivalente de base y la posterior reacción con un segundo electrófilo, p.ej. otro haluro de alquilo, permitirían la introducción de un segundo sutituyente. El último paso es la hidrólisis y posterior descarboxilación que conducen al producto final 4.
Una base fuerte es necesaria para desprotonar el carbono protón central. Los protones α a los grupos etoxicarbonilos son fácilmente sustraíbles. El éster malónico presenta de manera peculiar esta condición en virtud de estar adyacentes a dos grupos carbonilo. El carbanión formado puede someterse a la sustitución nucleófila con un halogenuro de alquilo, para dar el compuesto alquilado. Por calentamiento, el diéster sufre descarboxilación térmica, produciéndose así un ácido acético sustituido por el grupo de R adecuado.[2] Así, el éster malónico se puede considerar equivalente al sintón -CH2COOH. Los ésteres son elegidos por lo general la misma que la base utilizada, por ejemplo, para ésteres de etilo se utiliza etóxido de sodio. Esto es para prevenir la transesterificación.
Síntesis de ácidos cicloalquilcarboxílicos
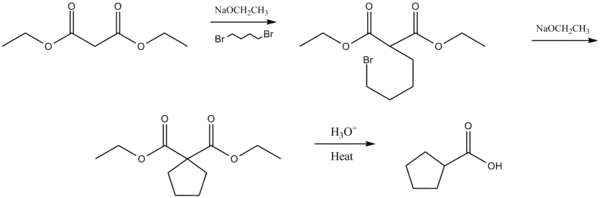
Una síntesis malónica intramolecular ocurre cuando se hace reaccionar con el dihalogenuro con un número de carbonos n-1, siendo n el número de miembros del ciclo. Los ciclos de 5 y 6 son los favorecidos.[3][4] Esta reacción es conocida como Síntesis alicíclica de Perkin, nombrada así por el químico William Henry Perkin, Jr.[5]
Referencias
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- «Malonic Ester Synthesis». Organic Chemistry Portal. Consultado el 26 de octubre de 2007.
- Smith, Janice Gorzynski. Organic Chemistry: Second Ed. 2008. pp 905-906
- Using the non-selective nature of malonic ester synthesis to produce cyclic compounds
- Ueber die Einwirkung von Trimethylenbromid auf Acetessigäther, Benzoylessigäther und Malonsäureäther W. H. Perkin Jun. Berichte der deutschen chemischen Gesellschaft Volume 16 Issue 2, Pages 1787 - 1797 1883 doi 10.1002/cber.18830160259