GLUT1
GLUT1 es un acrónimo en inglés para Glucose transporter 1 (o transportador de glucosa 1), conocido también como solute carrier family 2, facilitated glucose transporter member 1 (SLC2A1) (familia 2 de transportadores de solutos, transporte facilitado de glucosa miembro 1). Se trata de una proteína uniportadora, que en los seres humanos se encuentra codificada por el gen SLC2A1.[1] GLUT1 actúa como facilitador de la difusión de glucosa a través de la membrana plasmática de las células de los mamíferos.[2]
Descubrimiento
GLUT1 fue el primer transportador de glucosa en ser caracterizado, se encuentra altamente conservado en la naturaleza.[1] GLUT1 de humanos y ratones tienen un 98% de homología. A su vez esta proteína posee un 40% de homología con otros transportadores GLUT.
Función
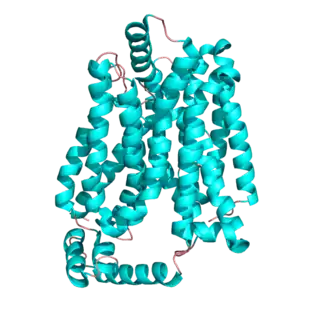
El metabolismo productor de energía en los eritrocitos depende de un aporte constante de glucosa proveniente del plasma sanguíneo, donde la concentración de glucosa se mantiene a un nivel aproximado de 5mM. La glucosa entra en los eritrocitos por difusión facilitada, vía un transportador específico de glucosa, a una velocidad que es 50 000 veces mayor que la difusión a través de la membrana. El transportador de glucosa de los eritrocitos (llamado GLUT1 para distinguirlo de otras proteínas relacionadas que se encuentran en otros tejidos) es una proteína integral de membrana de tipo III con 12 segmentos hidrofóbicos, cada uno de los cuales se cree que forma una hélice alfa atravesando la membrana plasmática. Aún no se conoce la estructura detallada de GLUT1, pero un modelo plausible sugiere que este arreglo lado-a-lado de varias hélices produce un canal iónico transmembrana alineado con residuos hidrofílicos que pueden formar enlaces hidrógeno con la glucosa, mientras esta se mueve a través del canal.[3]
El transportador GLUT1 es el responsable de la captación basal de glucosa requerida para sostener la respiración en todas las células. Los niveles de expresión de GLUT1 en las membranas celulares se incrementan en respuesta a concentraciones bajas de glucosa en el plasma, y a la inversa disminuyen con el incremento en la glucemia.
GLUT1 también es el principal receptor para la captación de vitamina C además de glucosa, en especial en las células de mamíferos que no producen vitamina C, como parte de una adaptación compensatoria participando en el proceso de reciclado de vitamina C. En los mamíferos que producen vitamina C, a menudo se expresa el transportador GLUT4 en vez de GLUT1.[4]
Distribución en los tejidos
Se encuentra ampliamente distribuido en tejidos fetales. En adultos se expresa en altos niveles en los eritrocitos y además en las células endoteliales de tejidos barrera, tal como los de la barrera hematoencefálica.[5]
Estructura
GLUT1 se comporta como una enzima de Michaelis-Menten y contiene 12 hélices alfa transmembrana, cada una de las cuales contiene 20 residuos aminoacídicos. Un análisis de estas hélices muestra que las hélices alfa transmembrana son anfipáticas, con un lado polar y el otro hidrofóbico. Se cree que seis de estas hélices alfa transmembrana se unen juntas para formar un canal polar en el centro a través del cual la glucosa puede difundir, con las regiones hidrofóbicas en el lado externo del canal adyacente a las colas de los ácidos grasos de la membrana.
Importancia clínica
Las mutaciones en el gen GLUT1 son responsables de la deficiencia de GLUT1 o Enfermedad de De Vivo, una rara enfermedad autosómica recesiva.[6] Esta enfermedad se caracteriza por una baja concentración de glucosa en el líquido cefalorraquídeo (hipoglucorraquia), un tipo de neuroglucopenia, que desemboca en una afectación del transporte de glucosa a través de la barrera hematoencefálica.
El GLUT1 también es el receptor utilizado por el virus linfotrópico T humano (HTLV) para ganar acceso a las células diana.[7]
El GLUT1, además, ha mostrado ser un poderoso marcador histoquímico para el hemangioma de la infancia.[8]
Interacciones
Se ha demostrado que GLUT1 presenta interacciones proteína-proteína con GIPC1.[9]
GLUT1 presenta dos tipos significativos en cerebro 45k y 55k. GLUT1 45k se encuentra presente en astroglías y GLUT1 55k se encuentra presente en los capilares del cerebro donde es responsable del transporte de glucosa a través de la barrera hematoencefálica, y donde su deficiencia causa los niveles bajos de glucosa en el LCR (menores a 60 mg/dl) que se puede manifestar como convulsiones en los individuos afectados.
Recientemente se ha descrito un inhibidor de GLUT1, DERL3, que se encuentra a menudo metilado en el cáncer colorrectal. En este tipo de cáncer, las metilaciones de DERL3 parecen mediar el efecto Warburg.[10]
Inhibidores
La fasentina es una pequeña molécula que actúa como inhibidor del dominio intracelular de GLUT1 previniendo la captación de glucosa.[11]
Referencias
- Mueckler M, Caruso C, Baldwin SA, Panico M, Blench I, Morris HR, Allard WJ, Lienhard GE, Lodish HF (1985). «Sequence and structure of a human glucose transporter». Science 229 (4717): 941-5. PMID 3839598. doi:10.1126/science.3839598.
- Olson AL, Pessin JE (1996). «Structure, function, and regulation of the mammalian facilitative glucose transporter gene family». Annual Review of Nutrition 16: 235-56. PMID 8839927. doi:10.1146/annurev.nu.16.070196.001315.
- Nelson DL, Cox MM (2008). Lehninger, Principles of Biochemistry. W. H. Freeman and Company. ISBN 978-0-7167-7108-1. Archivado desde el original el 19 de marzo de 2015.
- Montel-Hagen A, Kinet S, Manel N, Mongellaz C, Prohaska R, Battini JL, Delaunay J, Sitbon M, Taylor N (2008). «Erythrocyte Glut1 triggers dehydroascorbic acid uptake in mammals unable to synthesize vitamin C». Cell 132 (6): 1039-48. PMID 18358815. doi:10.1016/j.cell.2008.01.042. Resumen divulgativo – ScienceDaily (March 21, 2008).
- Devraj, K; Klinger, M E; Myers, R L; Mokanshi, A; Hawkins, R A; Simpson, I A (Dec 2011). «GLUT1 Glucose transporters in the blood-brain barrier: differential phosphorylation». Journal of Neuroscience Research 89 (12): 1913-1925. PMC 3835747. PMID 21910135. doi:10.1002/jnr.22738.
- Seidner G, Alvarez MG, Yeh JI (1998). «GLUT-1 deficiency syndrome caused by haploinsufficiency of the blood–brain barrier hexose carrier». Nat. Genet. 18 (2): 188-91. PMID 9462754. doi:10.1038/ng0298-188.
- Manel N, Kim FJ, Kinet S, Taylor N, Sitbon M, Battini JL (noviembre de 2003). «The ubiquitous glucose transporter GLUT-1 is a receptor for HTLV». Cell 115 (4): 449-59. PMID 14622599. doi:10.1016/S0092-8674(03)00881-X.
- North PE, Waner M, Mizeracki A, Mihm MC (enero de 2000). «GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas». Hum. Pathol. 31 (1): 11-22. PMID 10665907. doi:10.1016/S0046-8177(00)80192-6.
- Bunn RC, Jensen MA, Reed BC (1999). «Protein interactions with the glucose transporter binding protein GLUT1CBP that provide a link between GLUT1 and the cytoskeleton». Molecular Biology of the Cell 10 (4): 819-32. PMC 25204. PMID 10198040. doi:10.1091/mbc.10.4.819.
- Lopez-Serra P, Marcilla M, Villanueva A, Ramos-Fernandez A, Palau A, Leal L, Wahi JE, Setien-Baranda F, Szczesna K, Moutinho C, Martinez-Cardus A, Heyn H, Sandoval J, Puertas S, Vidal A, Sanjuan X, Martinez-Balibrea E, Viñals F, Perales JC, Bramsem JB, Ørntoft TF, Andersen CL, Tabernero J, McDermott U, Boxer MB, Vander Heiden MG, Albar JP, Esteller M (2014). «A DERL3-associated defect in the degradation of SLC2A1 mediates the Warburg effect». Nature Communications 5: 3608. PMC 3988805. PMID 24699711. doi:10.1038/ncomms4608.
- Wood TE, Dalili S, Simpson CD, Hurren R, Mao X, Saiz FS, Gronda M, Eberhard Y, Minden MD, Bilan PJ, Klip A, Batey RA, Schimmer AD (2008). «A novel inhibitor of glucose uptake sensitizes cells to FAS-induced cell death». Mol. Cancer Ther. 7 (11): 3546-55. PMID 19001437. doi:10.1158/1535-7163.MCT-08-0569. Consultado el 25 de abril de 2015.
Lecturas adicionales
- North PE, Waner M, Mizeracki A, Mihm MC (2000). «GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas». Human Pathology 31 (1): 11-22. PMID 10665907. doi:10.1016/S0046-8177(00)80192-6.
- Hruz PW, Mueckler MM (2001). «Structural analysis of the GLUT1 facilitative glucose transporter (review)». Molecular Membrane Biology 18 (3): 183-93. PMID 11681785. doi:10.1080/09687680110072140.
- Baumann MU, Deborde S, Illsley NP (2002). «Placental glucose transfer and fetal growth». Endocrine 19 (1): 13-22. PMID 12583599. doi:10.1385/ENDO:19:1:13.
- Mobasheri A, Richardson S, Mobasheri R, Shakibaei M, Hoyland JA (2005). «Hypoxia inducible factor-1 and facilitative glucose transporters GLUT1 and GLUT3: putative molecular components of the oxygen and glucose sensing apparatus in articular chondrocytes». Histology and Histopathology 20 (4): 1327-38. PMID 16136514.
Enlaces externos
- GeneReviews/NIH/UW entry on Glucose Transporter Type 1 Deficiency Syndrome
- MeSH: Glucose+Transporter+Type+1 (en inglés)