Sulfato de hierro(III)
El sulfato de hierro(III), sulfato férrico, vitriolo de Marte, caparrosa marciana, pálido, geruclosas, hygroskopisches o polvo sensible de humedad es un compuesto de hierro, azufre y oxígeno. Se diferencia del más frecuente sulfato de hierro(II) en la carga del catión, siendo este el estado más oxidado del átomo de hierro.
| Sulfato de hierro(III) | ||
|---|---|---|
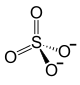 Fe3+ Fe3+  Fe3+ Fe3+  | ||
 | ||
| Nombre IUPAC | ||
| Tetraoxosulfato(VI) de hierro(III) | ||
| General | ||
| Otros nombres |
Sulfato de hierro(III) Sulfato férrico Vitriolo de Marte Pálido Polvo sensible de humedad Hygroskopisches Geruclosas | |
| Fórmula semidesarrollada |
Fe2(SO4)3 (forma anhidra) Fe2(SO4)3·9H2O (nonahidrato) | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS |
10028-22-5 (anhidro) 15244-10-7 (n-hidrato) n=9, 7, 6, 4, 3, 1 Ver CAS de cada hidrato en [1] | |
| ChEBI | 53438 | |
| ChemSpider | 23211 | |
| PubChem | 24826 | |
| UNII | 4YKQ1X5E5Y | |
| Propiedades físicas | ||
| Apariencia | Blanco cristalino | |
| Densidad | 1898 kg/m³; 1898 g/cm³ | |
| Masa molar | 399.87 (forma anhidra) g/mol | |
| Punto de fusión | 753 K (480 °C) | |
| Estructura cristalina | Rómbico | |
| Propiedades químicas | ||
| Solubilidad en agua | Soluble | |
| Termoquímica | ||
| ΔfH0sólido | -2583,0 kJ/mol | |
| S0sólido | 307,5 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | 22-36/37 | |
| Frases S | 26 | |
| Riesgos | ||
| Ingestión | Nocivo leve. Baja toxicidad en bajas cantidades. Grandes dosis pueden causar dolor abdominal, náuseas, vómitos y diarrea; decoloración urinaria. Dosis muy altas: daño al hígado, Posible coma. | |
| Inhalación | Irritaciones de las membranas mucosas y del tracto respiratorio. Tos. Dificultad respiratoria. | |
| Piel | Irritaciones. Enrojecimiento y dolor. | |
| Ojos | Irritaciones. Enrojecimiento y dolor. | |
| Compuestos relacionados | ||
| Otros aniones |
Cloruro de hierro(III) Óxido de hierro(III) Bromuro de hierro(III) Nitrato de hierro(III) | |
| Otros cationes |
Sulfato de hierro(II) Sulfato de manganeso(III) Sulfato de cobalto(III) Sulfato de amonio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Sal sólida de color amarillo, cristaliza en el sistema rómbico y es soluble en agua a temperatura ambiente.
Usos
- Se usa como mordiente antes de aplicar un colorante, y como coagulante para residuos industriales
- También se usa como pigmento colorante y en los baños de decapado para aluminio y acero.[2]
- Médicamente es usado como astringente y para lápiz estíptico.[3]
Obtención
Se produce a gran escala por reacción de ácido sulfúrico con una solución caliente de sulfato ferroso, usando un agente oxidante (como ácido nítrico o peróxido de hidrógeno).[4]
En las plantas de tratamiento de aguas residuales se usa como coagulante para favorecer la sedimentación de partículas en los cuerpos de agua sin depurar (formación de micro-flocs de coloración anaranjado-rojiza).[5]
Referencias
- (anhidro)
15244-10-7 (n-hidrato)
n=9, 7, 6, 4, 3, 1
Ver CAS de cada hidrato en [http://www.nlm.nih.gov/cgi/mesh/2006/MB_cgi?mode=&term=ferric+sulfate Número CAS] - ferric sulfate. The Columbia Encyclopedia, 6ª Ed. Visto noviembre 2007.
- Ferric sulfate Archivado el 26 de septiembre de 2008 en Wayback Machine.. Online medical dictionary. Visto noviembre 2007 (en inglés)
- Iron compounds, Art. Encyclopædia Britannica. Bajado noviembre 2007
- Spencer Hunt.Taming toxic waters. THE COLUMBUS DISPATCH.