Vía de señalización del TGF-beta
La vía de señalización del factor de crecimiento transformante beta (TGFB) son una secuencia de eventos moleculares implicados en un gran número de procesos celulares tanto en el organismo adulto como en el embrión en desarrollo. La ruta afecta a varias etapas celulares incluyendo el crecimiento y diferenciación celular, el proceso de apoptosis, la homeostasis celular, entre otras. A pesar de la gran gama de procesos celulares reguladas por la vía de señalización del TGFβ, el proceso es relativamente sencillo. La superfamilia de ligandos del TGFβ se une a un receptor, usualmente el receptor TGF-beta 2, el cual recluta y fosforlia al receptor TGF-beta 1. Este receptor TGF-beta 1 fosforila a su vez a los receptores Smad (R-Smad) las cuales se pueden unir ahora a otra proteína, la coSMAD SMAD4. Estos complejos R-SMAD/coSMAD se acumulan en el núcleo celular donde actúan como factores de transcripción y participan en el control de expresión de genes blanco.
Mecanismo
Unión a ligando
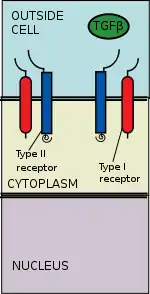
La superfamilia de ligandos TGF beta incluyen: la proteína morfogénica ósea (BMPs), factores de crecimiento y diferenciación (GDFs), la hormona antimulleriana (AMH), Activina, Nodal y el TGFβ.[1] La señalización empieza con la unión de un ligando de la superfamilia de los TGF-beta a un receptor de TGF-beta 2. El receptor TGF-beta 2 es un receptor Serina/Treonina Cinasa que cataliza la fosforilación del receptor Tipo I. Cada clase de ligando se une a un tipo concreto de receptor TGF-beta 2.[2] En los mamíferos se han descubierto siete tipos de receptores TGF-beta 1 y cinco receptores TGF-beta 2.[3]
Existen tres activinas: Activin A, Activina B y la Activina AB. Las activinas participan en la embriogenesis y osteogenesis.[4] También regulan muchas hormonas incluyendo las hormonas pituitarias, gonadales e hipotalámicas así como la insulina.[5] Son también factores de supervivencia de las células neuronales.[6]
Las BMP, por su parte, se unen al receptor de la proteína morfogénica ósea 2 (por sus siglas en inglés, BMPR2). Estas se encargan de una multitud de funciones celulares que incluyen la osteogenesis,[7][8][9] la diferenciación celular, especificación axial posterior/anterior,[10] el crecimiento celular y la eventual homeostasis.[11]
La familia de las TGF-beta incluye: el TGFβ1, TGFβ2 y la TGFβ3. Al igual que las BMPs, las TGF-beta están implicadas en la embriogénesis y la diferenciación celular. Además están asociadas también a la apoptosis, así como otras funciones celulares. Se unen al receptor de TGF-beta 2 (TGFBR2).[12]
La proteína «nodal» se une al receptor de la activina A tipo IIB (por sus siglas en inglés, ACVR2B). Una vez acoplada, forma complejos con el receptor de la activina A, del tipo IB (ACVR1B) y con el receptor de la activina A tipo IC (ACVR1C).[3]
Cuándo la unión receptor-ligando ocurre vía acción local, se conoce como efecto paracrino.[13]
Reclutamiento de receptor y fosforilación
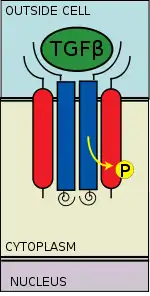
El ligando del TGF-beta se une a un dímero del receptor TGF-bea 2, el cual a su vez recluta a un dímero del receptor TGF-beta 1 formando un complejo hetero-tetramérico con el ligando.[14] Estos receptores del tipo serina/treonina cinasea, tienen un dominio extracelular rico en cisteína, dominio transmembrana y uno citoplasmático rico en serina/treonina. El dominio GS del receptor TGF-beta 1 está formado por una serie repetitiva de unos treinta groupos serina y glicina.[15] La unión de un ligando TGF-beta causa la rotación de los receptores de tal modo que su dominio cinasa citoplasmáticolos se orientan a una conformación cataliticamente favorable. El receptor TGF-2 fosforila los residuos serina del receptor TGF-beta 1, el cual activa la proteína.[16]
Fosforilación SMAD
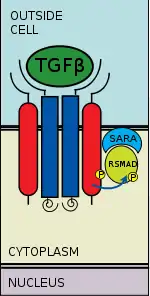
Hay cinco receptores Smad reguladas: Smad1, Smad2, Smad3, Smad5, y Smad9 (a veces llamado Smad8). Esencialmente son dos las vías intracelulares implicandas a estos receptores-Smads. La TGF-beta, las activinas, las proteínas nodal y algunos GDFs son mediados por intermedio de Smad2 y Smad3, mientras que las BMPs, AMH y unos cuantos GDFs son mediados por intermedio de Smad1, Smad5 y Smad9. La unión de los R-Smad al receptor TGF-beta 2 se realiza por intermedio de un dominio doble dedo de zinc FYVE que contiene proteína. Dos de estos tipos de proteínas que sirven de intermediarios en la vía de señalización del el TGF-beta incluye SARA (por sus siglas en inglés, anclaje de las Smad para la activación del receptor) y HGS (substrato cinasa de tirosina regulados por el factor de crecimiento de hepatocito).[17]
El SARA está presente en los endosomas recién sintetizados los cuales, por endocitosis mediada por clatrina, interioriza el complejo receptor.[18] El SARA recluta luego a un R-Smad y permite la unión del receptor Smad a la región L45 del receptor TGF-beta 1.[19] SARA ahora guía al R-Smad y la orienta de tal manera que el residuo serina presente en su región C-terminal es presentado a la región catalítica del receptor TGF-beta 1. En esta conformación, el receptor TGF-beta 1 fosforila al residuo serina del R-Smad. La fosforilación induce un cambio conformational en el dominio MH2 del R-Smad y su subsiguiente disociación del complejo receptor y del SARA.[20]
Unión CoSmad
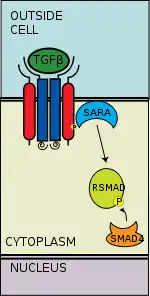
El RSmad fosforilado tiene una alta afinidad para el coSmad (p. ej. Smad4) con el que forma un complejo de unión. El grupo fosfato del RSmad no actúa como sitio de anclaje para el coSmad, sino que ese punto de fosforilación se abre para revelar un tramo de aminoácidos que permita la interacción molecular con el coSmad.[21]
Transcripción
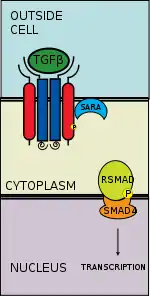
El complejo RSmad/coSmad fosforilado es heterodimérico y entra así al núcleo donde se une a promotores de transcripción/cofactores y causa la transcripción de ADN.[21]
Las proteínas morfogénicas óseas causan la transcripción de mRNA implicado en la osteogenesis, neurogénesis, y especificación del mesodermo ventral.[7]
Las TGF-betas causan la transcripción de mRNAs asociados con la apoptosis, la neogénesis de la matriz extracelular y la inmunosupresión. Está también implicada en el arresto G1 del ciclo celular.[12]
Por su parte, la activina causa la transcripción de mRNA implicados en el crecimiento gonadal, la diferenciación del embrión y la formación de la placenta.[4]
La proteína nodal causa la transcripción de mRNA implicado en la correcta especificación del eje derecho e izquierdo del cuerpo, inducción del mesodermo e inducción del endodermo.[3]
Regulación de la vía
La vía de señalización del TGF-beta está implicada en una amplia gama de procesos celulares y posteriormente se ve fuertemente regulada. Hay una variedad de mecanismos donde esta vía se ve modulada positiva o negativamente: hay agonistas para cada ligando y para cada R-Smad; hay receptores señuelo; y R-Smad y receptores que son marcadas con ubiquitina para su regulación.[22]
Agonistas/Antagonistas de los Ligandos
Tanto la cordina como la nogina fungen como antagonistas de los BMP.[23][24] Se unen al BMP impidiendo la unión del ligando a su receptor.[25] Ha sido demostrado que la cordina y la noggina dorsalizan al mesodermo. Ambas proteínas se encuentran en el labio dorsal de la especie Xenopus y convierten tejidos especializados al epidermis en tejido neuronal por medio de un proceso llamado neurulación. La noggina juega un peple clave en el patrón del cartílago y el hueso. En ratones Noggina-/- tienen cartílago sobrante y carecían de articulaciones unidas.[25]
Los miembros del familia de proteínas DAN también antagonizan a los miembros de la familia TGF-beta. Entre ellos se incluyen Cerberus, DAN, y Gremlina. Estas proteínas contienen nueve cisteínas conservadas las cuales pueden formar puentes disulfuros. Se cree que el DAN antagoniza a los factores GDF5, GDF6 y GDF7.[26]
La Folistatina también suprime a la activina cuando se une a ella. Ello afecta de manera directa la secreción de la hormona foliculoestimulante (FSH). La Folistatina también tiene una importante correlación con el cáncer de próstata, donde las mutaciones en su gen de origen puede prevenir la acción que esta tiene sobre las propiedades antiproliferativas de la activina.[25]
La proteína Lefty es un regulador de la TGFβ y está implicada en el patrón axial del animal durante la embriogénesis. Es también miembro de la superfamilia de proteínas TGF. Es expresado de manera asimétrica en el lado izquierdo de los embriones murinos y posteriormente juega papel en la especificación correcta del eje izquierdo del organismo. Lefty actúa impidiendo la fosforilación de R-Smad a través de un receptor TGFβ tipo 1 constitutivamente activo y a través de un proceso aguas abajo de su activación.[27]
Los antagonistas basados en farmacología también han sido identificados, incluyendo el SB431542, el cual inhibe de manera selectiva al ALK4, ALK5, y ALK7.[28]
Regulación del receptor
El receptor del factor de crecimiento transformante beta 3 (TGFBR3) es el más abundante de los receptores TGF-β hasta ahora descubierto, aunque se desconoce su dominio usado para señalización.[29][30] Aun así puede ser empleado para realizar la unión de los ligandos del TGF-beta al receptor TGF-beta 2 uniéndose a los TGFβ y presentándolos al TGFBR2. Uno de los blancos agua abajo de la señalización TGF β es el GIPC, el cual se une a su dominio PDZ, el cual impide su degradación proteosomal, y posteriormente aumenta la actividad TGFβ. También puede servir como correceptor inhibina del receptor Activina 2.[25]
El inhibidor BMP y activina unido a membrana (BAMBI), tiene un dominio extracelular similar a los receptores TGF-beta 1. Carece de un dominio serina/treonina proteincinasa intracelular por lo que actúa como pseudoreceptor. Se une al receptor TGF-beta 1 impidiendo su activación. Sirve como regulador negativo de la señalización del TGF-beta y puede limitar la expresión del TGF-beta durante la embriogeneis. Requiere señalización BMP para su expresión.[31][32]
La FKBP12 se une a la región GS del receptor TGF-beta 1, lo que impide la fosforilación del receptor por receptores TGF-beta 2. Se cree que la FKBP12 y sus homólogos ayudan a impedir la activación del receptor TGF-beta 1 en la ausencia de ligandos, en visa que el ligando causa su disociación obligatoria.[33]
Función de las Smad inhibitorias
Hay otro dos Smad para completar la familia Smad, los Smad inhibitorios (I-SMAD): Smad6 y Smad7. Estos juegan un papel clave en el control de la señalización TGF-beta y están implicados en procesos de retroalimentación negativa. Como otros SMAD, estos tienen un dominio MH1 y un dominio MH2. El Smad7 compite con otros receptores Smad, con el receptor TGF-beta 1 e impide sus fosforilaciones.[25][34] Reside en el núcleo y cuando el receptor TGF-beta se activa, se transloca al citoplasma donde se une al receptor TGF-beta 1. El Smad6 se une al Smad4 impidiendo la unión de otros R-Smad con el coSmad. Los niveles de Smad1 aumentan con la señalización del TGF-beta sugiriendo que son dianas agua abajo en la vía de señalización TGF-beta.[35]
Alteraciones R-Smad
Las proteína ligasa de ubicuitina E3 llamadas SMURF1 y SMURF2 regulan los niveles de Smad. Aceptan al marcador ubiquitina de una enzima conjugante E2 donde transfieren al R-SMAD causando su marcaje y subsiguiente degradación proteasomal. El SMURF1 se une a los Smad1 y Smad5 mientras que el SMURF2 se une a los Smad1, Smad2, Smad3, Smad6 y SMAD7. Realza la acción inhibitoria del Smad7 y reduce las actividades de transcripción del Smad2.[22]
Tabla resumen
| Ligando de la superfamilia TGF-beta |
Receptor TGF-beta 2 |
Receptor TGF-beta 1 |
R-Smad | coSmad | Inhibidor de los ligandos |
|---|---|---|---|---|---|
| Activina A | ACVR2A | ACVR1B (ALK4) | SMAD2, SMAD3 | SMAD4 | Folistatina |
| GDF1 | ACVR2A | ACVR1B (ALK4) | SMAD2, SMAD3 | SMAD4 | |
| GDF11 | ACVR2B | ACVR1B (ALK4), TGFβRI (ALK5) | SMAD2, SMAD3 | SMAD4 | |
| Proteína morfo- génica ósea |
BMPR2 | BMPR1A (ALK3), BMPR1B (ALK6) | SMAD1, SMAD5, SMAD8 | SMAD4 | Nogina, Cordina, SMURF1 |
| Nodal | ACVR2B | ACVR1B (ALK4), ACVR1C (ALK7) | SMAD2, SMAD3 | SMAD4 | Lefty |
| TGFβs | TGFβRII | TGFβRI (ALK5) | SMAD2, SMAD3 | SMAD4 | LTBP1, THBS1, Decorina |
Referencias
- «Prosite Documentation PDOC00223» (en inglés). Prosite.com. Consultado el 17 de diciembre de 2015.
- Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). Molecular Biology of the Cell. New York, NY: Garland Science. ISBN 0-8153-3218-1.
- Munir S, Xu G, Wu Y, Yang B, Lala PK, Peng C (July 2004). «Nodal and ALK7 inhibit proliferation and induce apoptosis in human trophoblast cells». J. Biol. Chem. 279 (30): 31277-86. PMID 15150278. doi:10.1074/jbc.M400641200.
- Grégory Alfonso García, Ómar Mejía, Ananías García Cardona, Dianney Clavijo Grimaldi, Jimmy Muñoz, Sergio Hernández (2006). «Factor inhibidor de la leucemia y su papel en procesos fisiológicos y patológicos». MedUNAB 9 (3): 236-245.
- Cuschieri J, Bulger E, Grinsell R, Garcia I, Maier RV. (2008). «Insulin regulates macrophage activation through activin A.». Shock. 29 (2): 285-90. PMID 17693932.
- Arber C1, Precious SV2, Cambray S3, Risner-Janiczek JR, Kelly C, Noakes Z, Fjodorova M, Heuer A, Ungless MA, Rodríguez TA, Rosser AE, Dunnett SB, Li M (April 2015). «Activin A directs striatal projection neuron differentiation of human pluripotent stem cells.». Development 142 (7): 1375-86. PMID 17693932. doi:10.1242/dev.117093.
- Allegrini S, Yoshimoto M, Salles MB, König B (febrero de 2004). «Bone regeneration in rabbit sinus lifting associated with bovine BMP». J. Biomed. Mater. Res. Part B Appl. Biomater. 68 (2): 127-31. PMID 14737759. doi:10.1002/jbm.b.20006.
- Schlegel KA, Thorwarth M, Plesinac A, Wiltfang J, Rupprecht S (diciembre de 2006). «Expression of bone matrix proteins during the osseus healing of topical conditioned implants: an experimental study». Clin Oral Implants Res 17 (6): 666-72. PMID 17092225. doi:10.1111/j.1600-0501.2006.01214.x.
- Schliephake H, Aref A, Scharnweber D, Bierbaum S, Roessler S, Sewing A (octubre de 2005). «Effect of immobilized bone morphogenic protein 2 coating of titanium implants on peri-implant bone formation». Clin Oral Implants Res 16 (5): 563-9. PMID 16164462. doi:10.1111/j.1600-0501.2005.01143.x.
- Subach BR, Haid RW, Rodts GE, Kaiser MG (2001). «Bone morphogenetic protein in spinal fusion: overview and clinical update». Neurosurg Focus 10 (4): E3. PMID 16732630.
- Burkus JK, Gornet MF, Schuler TC, Kleeman TJ, Zdeblick TA (mayo de 2009). «Six-year outcomes of anterior lumbar interbody arthrodesis with use of interbody fusion cages and recombinant human bone morphogenetic protein-2». J Bone Joint Surg Am 91 (5): 1181-9. PMID 19411467. doi:10.2106/JBJS.G.01485.
- «Entrez Gene: TGFBR2 transforming growth factor, beta receptor II (70/80kDa)». Consultado el 16 de diciembre de 2015.
- Müller-Esterl, Werner (2008). Bioquímica. Fundamentos para Medicina y Ciencias de la Vida. Editorial Reverté. p. 393. ISBN 8429173935. Consultado el 16 de diciembre de 2015.
- Wrana JL, Attisano L, Cárcamo J, etal (December 1992). «TGF beta signals through a heteromeric protein kinase receptor complex». Cell 71 (6): 1003-14. PMID 1333888. doi:10.1016/0092-8674(92)90395-S.
- «Pfam entry TGF_beta_GS». Consultado el 1 de julio de 2006. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Abraham L Kierszenbaum, Laura Tres (2012). Histologia e Biologia Celular. Elsevier Brasil. p. 93. ISBN 8535259821. Consultado el 16 de diciembre de 2015.
- Spellman DS, Deinhardt K, Darie CC, Chao MV, Neubert TA. (Junio de 2008). «Marcaje isotópico estables de aminoácidos en las neuronas primarias cultivadas: aplicación a la señalización de fosfotirosina asociada dependiente del factor neurotrófico derivado del cerebro.». Mol Proteómica Celular 7 (6): 1067-76. doi:10.1074/mcp.M700387-MCP200.
- Runyan CE, Schnaper HW, Poncelet AC (March 2005). «The role of internalization in transforming growth factor beta1-induced Smad2 association with Smad anchor for receptor activation (SARA) and Smad2-dependent signaling in human mesangial cells». J. Biol. Chem. 280 (9): 8300-8. PMID 15613484. doi:10.1074/jbc.M407939200.
- Moustakas A (September 2002). «Smad signalling network». J. Cell. Sci. 115 (Pt 17): 3355-6. PMID 12154066.
- Souchelnytskyi S, Rönnstrand L, Heldin CH, ten Dijke P (2001). «Phosphorylation of Smad signaling proteins by receptor serine/threonine kinases». Methods Mol. Biol. 124: 107-20. PMID 11100470. doi:10.1385/1-59259-059-4:107.
- Samanthe M. Lyons1 and Ashok Prasad Cross-Talk and Information Transfer in Mammalian and Bacterial Signaling PLoS One. 2012; 7(4): e34488. doi: 10.1371/journal.pone.0034488 PMCID: PMC3329486
- Vanegas, Adriana Lucía, & Vásquez, Gloria María. (2011). Smad y otros blancos terapéuticos en esclerodermiaSmad and other therapeutic targets in scleroderma Revista Colombiana de Reumatología 18(4), 285-294. Accesado el 16 de diciembre de 2015
- Gilbert, Scott F. (2006). «3». Developmental Biology (Octava edición). Sinauer Associates, Inc. pp. 53-58. ISBN 9780878932504. Consultado el 19 de noviembre de 2011. (requiere registro).
- Pourquie, O. (2001). «Vertebrate somitogenesis». Annu. Rev. Cell Dev. Biol. 17: 311-50. PMID 11687492. doi:10.1146/annurev.cellbio.17.1.311.
- Massagué J, Chen YG (March 2000). «Controlling TGF-beta signaling». Genes Dev. 14 (6): 627-44. PMID 10733523.
- Devendra Kumar Gupta, Neetu Singh y Dinesh Kumar Sahu. TGF-β Mediated Crosstalk Between Malignant Hepatocyte and Tumor Microenvironment in Hepatocellular Carcinoma. Cancer Growth Metastasis 2014; 7: 1–8. doi: 10.4137/CGM.S14205 PMCID: PMC3988670
- Ulloa L, Tabibzadeh S (June 2001). «Lefty inhibits receptor-regulated Smad phosphorylation induced by the activated transforming growth factor-beta receptor». J. Biol. Chem. 276 (24): 21397-404. PMID 11278746. doi:10.1074/jbc.M010783200.
- Laping NJ, Grygielko E, Mathur A, Butter S, Bomberger J, Tweed C, Martin W, Fornwald J, Lehr R, Harling J, Gaster L, Callahan JF, Olson BA (July 2002). «Inhibition of transforming growth factor (TGF)-beta1-induced extracellular matrix with a novel inhibitor of the TGF-beta type I receptor kinase activity: SB-431542». Mol Pharmacol. 62 (1): 58-64. PMID 12065755. doi:10.1124/mol.62.1.58.
- Blobe GC, Liu X, Fang SJ, How T, Lodish HF (October 2001). «A novel mechanism for regulating transforming growth factor beta (TGF-beta) signaling. Functional modulation of type III TGF-beta receptor expression through interaction with the PDZ domain protein, GIPC». J. Biol. Chem. 276 (43): 39608-17. PMID 11546783. doi:10.1074/jbc.M106831200.
- OMIM 600742
- «Entrez Gene: BMP and activin membrane-bound inhibitor homolog (Xenopus laevis)».
- Degen WG, Weterman MA, van Groningen JJ, Cornelissen IM, Lemmers JP, Agterbos MA, Geurts van Kessel A, Swart GW, Bloemers HP (February 1996). «Expression of nma, a novel gene, inversely correlates with the metastatic potential of human melanoma cell lines and xenografts». Int. J. Cancer 65 (4): 460-5. PMID 8621228. doi:10.1002/(SICI)1097-0215(19960208)65:4<460::AID-IJC12>3.0.CO;2-E.
- Y G Chen, F Liu, and J Massague Mechanism of TGFbeta receptor inhibition by FKBP12. EMBO J. 1997 Jul 1; 16(13): 3866–3876. doi: 10.1093/emboj/16.13.3866 PMCID: PMC1170011
- Itoh F, Asao H, Sugamura K, Heldin CH, ten Dijke P, Itoh S (August 2001). «Promoting bone morphogenetic protein signaling through negative regulation of inhibitory Smads». Embo J. 20 (15): 4132-42. PMC 149146. PMID 11483516. doi:10.1093/emboj/20.15.4132.
- Francisco Javier Gálvez-Gastélum, Ana Soledad Sandoval-Rodríguez, Juan Armendáriz-Borunda. El factor de crecimiento transformante β como blanco terapéutico Archivado el 22 de diciembre de 2015 en Wayback Machine. Salud Pública Méx 2004; Vol. 46(4):341-350
Enlaces externos
- Kyoto Enciclopedia de Genes y Genomas - mapa de la vía de señalización del TGF-beta